水解酸化-好氧处理含油污水中微生物群落变化研究
2011-01-03包木太闫广彬陈庆国杜春安郭省学李希明
包木太,闫广彬,陈庆国,杜春安,郭省学,李希明
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东青岛 266100;2.中国石化胜利油田分公司采油工艺研究院,山东东营 257000)
水解酸化-好氧处理含油污水中微生物群落变化研究
包木太1,闫广彬1,陈庆国1,杜春安2,郭省学2,李希明2
(1.中国海洋大学海洋化学理论与工程技术教育部重点实验室,山东青岛 266100;2.中国石化胜利油田分公司采油工艺研究院,山东东营 257000)
为揭示水解酸化-好氧处理系统处理油田采出水过程中生物群落的变化规律,考察对不同水力停留时间(tHRT)下好氧池的生物相,提取水解酸化池和好氧池中菌体的脱氧核糖核酸(DNA),以细菌通用引物对DNA V3高变异区聚合酶链式反应(PCR)扩增后进行变性梯度凝胶电泳(DGGE)分析。结果表明:当水解酸化池和好氧池的水力停留时间分别大于12和16 h时,镜检有高级原生动物,出水CODCr去除率大于58.73%,含油去除率大于98.61%;水解酸化-好氧处理工艺在不同tHRT条件下运行后,在形成的细菌群落中,既有相同的优势群落,也有各自特有的优势群落;随着tHRT的延长,水解酸化池中优势群落的种类和数量增加,当tHRT>12 h时,优势群落变化较小,形成稳定的细菌群落,出水水质趋于稳定;随着tHRT的延长,好氧处理池中优势群落的种类和数量减少,当tHRT>16 h时,优势群落变化较小,形成稳定的生态系统,出水水质趋于最佳。
微生物群落;水解酸化;好氧处理;含油污水;变性梯度凝胶电泳
我国油田普遍采用“隔油—混凝—过滤”[1]“三”处理工艺,对去除废水中的石油类、悬浮物等杂质效果理想,但对于中溶解性的石油类和CODCr去除效果不明显。活性污泥是由细菌、微生物与悬浮物质、胶体物质混杂在一起所组成的絮状体颗粒[2-3],与传统的活性污泥法相比,水解酸化-好氧处理工艺具有投资小、能耗低和运转费用低等优点,可以用于含油和化学需氧量(CODCr)的去除。随着以16S rDNA为主要基石的细菌分子分类学的发展,出现了变性梯度凝胶电泳(DGGE)技术[4-6]。用DGGE研究微生物群落中的细菌多样性在污水处理中得到应用[7]。笔者针对水解酸化-好氧处理系统,利用DGGE技术对不同水力停留时间(tHRT)的活性污泥进行研究,通过分析生物群落,考察污泥中生物群落的变化与出水水质的关系。
1 实验
实验仪器包括:MyCycler PCR扩增仪(BIORAD,USA);SX-300成像系统(Shanghai Sixing Biological Technology Co Ltd);DYY-8C型电泳仪(北京六一仪器厂);Mini-Transilluminator紫外透射仪(BIORAD,USA);GS-15R Centrifuge离心机(Beckman,USA);Reagent TaKaRa MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0(宝生物工程(大连)有限公司)。
1.1 实验方法
1.1.1 样品脱氧核糖核酸提取
保持水解酸化-好氧处理系统运行参数稳定,通过调节进水水量,改变水力停留时间,对反应池中的生物相进行镜检,并测定出水的CODCr质量浓度(ρCOD)和所含油的质量浓度。ρCOD采用密封微波消解法测定[8],含油质量浓度采用紫外分光光度法测定[9]。
当系统出水水质稳定后,用2 mL无菌离心管取反应池中的混合液,12 000 r/min离心分离10 min,弃去上清液,样品保存于-20℃冰箱中[10]。
采用TakaRa的ReagentTaKaRa MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0试剂盒,提取污泥中的脱氧核糖核酸(DNA)。试剂盒中包括:Lysozyme、Glycerol、EDTA Buffer、SP Buffe、Solution A、Solution B、Solution C、DB Buffer、Rinse A 、Rinse B、Elution Buffer、Filter Cup、Spin Column、Collection Tube(2 mL)。提取方法参照说明书。
配置1%的琼脂糖凝胶,每个样品取5 μL,然后加入约1 μL 6×Loading buffer的点样液,向凝胶点样孔中点样,并用λm作marker。电泳大约30 min,将琼脂糖凝胶放于含有溴化已锭(EB)的溶液中染色10 min,最后用UVI凝胶成像系统记录结果。提取的DNA样品保存在-20℃的冰箱中。
1.1.2 DNA V3区的PCR扩增
将纯化的基因组DNA试样作为聚合酶链反应的模板,用基因扩增仪(PCR)对模板DNA的16S rDNA的V3可变区进行扩增,基因扩增所用引物为SP2(5'-ATTACCGCGGCTGCTGG-3'),SP3(5'-cgcccgccgcgcgcggcgggcggggcgggggcacgggggg CCTACGGGAGGCAGCAG-3')[11],PCR 扩增体系及程序采用Muyzer等[5]的方法。
PCR体系的基本参数为:正向引物 SP2 0.4 μL;反向引物 SP3 0.4 μL;10×Buffer 2.5 μL;dNTP(含 MgCl2)2 μL;Taq 酶 0.2 μL;模板 DNA 1 μL;ddH2O 18.5 μL。总体积 25 μL。
PCR扩增采用的程序为:94℃ 1 min;(94℃ 1 min,65℃ 1 min,72℃ 1.5 min)20个循环;(94℃1 min,55℃ 1 min,72℃ 1 min)10个循环,72℃ 6 min,4 ℃保温。
使用1%的琼脂糖凝胶电泳检测扩增结果,用UVI凝胶成像系统记录实验结果。
1.1.3 DGGE分析
16S rDNA V3区的PCR扩增产物可以通过DGGE进行分离。使用Bio-Rad公司DCode系统进行DGGE分析,变性剂梯度为30% ~60%(100%变性剂的浓度为7 mol/L尿素和40%去离子甲酰胺)。实验采用8%聚丙烯酰胺凝胶,电泳缓冲液为1×Tris-Acetate-EDTA(TAE,pH=8.4)[12]。在电压200 V,温度60℃的条件下电泳240 min,电泳结束后Gene finder染色30 min,然后用UVI凝胶成像系统保存实验结果。
采用美国Bio-Rad公司的Quantity One软件对DGGE图谱进行优化分析[13],根据戴斯相关系数计算两组条带之间的相似性,利用算术平均数非加权配对组算法进行聚类分析[14]。
1.2 实验流程
实验用水为陈庄注水站采出水,采用水解酸化-好氧处理工艺进行处理,如图1所示。来水由反应器底部进入水解酸化池,颗粒物质和胶体物质迅速被截留和吸附,截留下来的物质吸附在水解反应池污泥的表面,慢慢地被分解代谢,在大量水解细菌的作用下将不溶性有机物水解为溶解性物质,同时在产酸菌的协同作用下将大分子物质、难以生物降解的物质转化为易于生物降解的小分子物质,重新释放到液体中,提高了废水的可生化性,利于后续好氧活性污泥生物降解[15]。
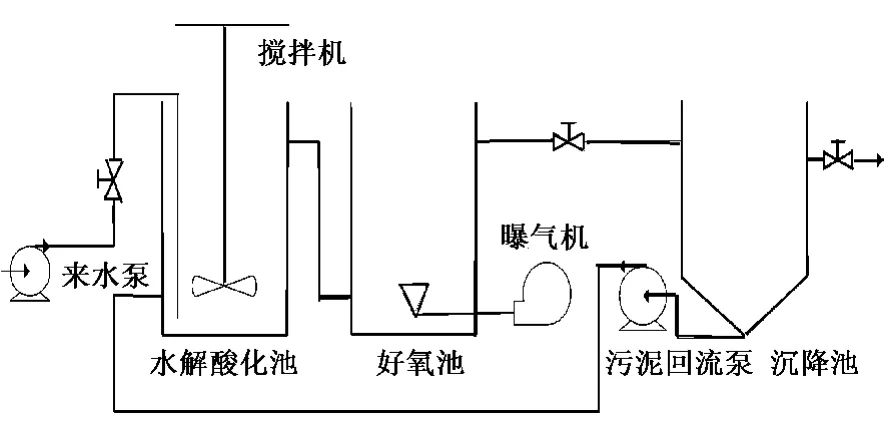
图1 实验工艺流程示意图Fig.1 Schematic diagram of technological process
水解酸化池和好氧处理池的有效容积均为10 L。水解酸化池为上流式污泥床(UASB)反应器,通过控制反应停留时间和曝气、搅拌等措施将反应控制在水解酸化阶段。来水经过水解酸化池处理后进入好氧处理池,最后进入沉降池泥水分离后出水。沉降池中一部分活性污泥回流进入水解酸化池。实验过程中,污泥参数保持稳定,温度控制在24~26℃,好氧处理池的溶解氧为3~5 mg/L。
2 实验结果
2.1 不同tHRT的出水水质
污水中污染物主要由微生物去除,水解酸化池和好氧处理池的tHRT即为微生物生长代谢的时间。从进水后的8 h起,每隔4 h取一次样,测定了不同停留时间条件下的ρCOD和含油量,结果如图2和图3所示。
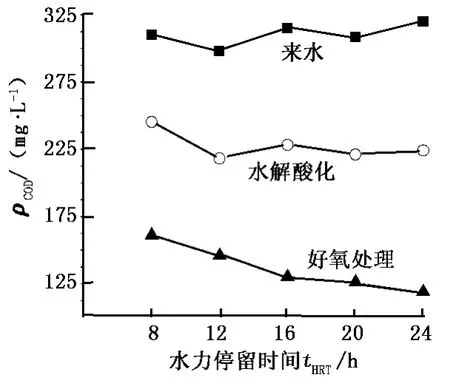
图2 不同tHRT下CODCr的去除效果Fig.2 Removal of CODCrat different hydraulic retention time

图3 不同tHRT下含油的去除效果Fig.3 Removal of oil at different hydraulic retention time
由图2、3可以看出:经过水解酸化,对废水中CODCr有部分去除,对原油的降解较为明显;随着tHRT的延长,两个反应池的CODCr和原油的去除有所提高;对于水解酸化池,当tHRT大于12 h后,CODCr和原油的去除变化幅度较小;对于好氧处理池,当tHRT大于16 h时,ρCOD和含油量达到最低值。
2.2 生物相的观察
水解酸化池中没有原生动物,细菌含量大约在107个/mL,且随着tHRT的改变,细菌的种类和数量有所变化。对好氧处理池中不同tHRT的活性污泥进行镜检,当tHRT为8 h时,出水的ρCOD和含油量较高,且好氧处理池的污泥略微发黑,细菌数量较多,大量的草履虫、滴虫的出现表明污泥负荷较高。当tHRT为12 h时,经处理后的水质有所改善,好氧处理池中出现了变形虫,说明水质正在发生变化。当tHRT为16 h时,出水水质得到很大改善,生物群落发生了明显的变化,出现了轮虫、游仆虫等高级原生动物,细菌数量明显减少。当tHRT为20 h时,ρCOD和含油量变化较小,钟虫的出现说明好氧处理池中的污泥形成了稳定的生态系统,此时出水水质较好。当tHRT为24 h时,出水水质的变化不大,盖虫的出现表明污泥的负荷较低。
2.3 DNA V3片段扩增后的琼脂糖凝胶电泳
微生物可以利用污水中的污染物进行代谢活动,而污染物的种类和含量限制微生物的生长和繁殖。对不同tHRT污泥样品进行16S rDNA V3区扩增,结果见图4。琼脂糖凝胶电泳所得条带即为目的扩增片段。条带编号1、2、3、4、5对应的 tHRT分别为 8、12、16、20、24 h。得到的 DNA 基因片段约为230 bp。扩增产物可以用于DGGE分析。

图4 不同tHRT的PCR结果Fig.4 PCR result at different hydraulic retention time
2.4 不同tHRT的DGGE分析
遗传多样性是生物多样性的重要组成部分,物种是构成微生物群落进而组成生态系统的基本单元[16]。因此,生态系统的多样性离不开物种的多样性和物种具有的遗传多样性。分析了不同tHRT条件下水解酸化和好氧处理系统中细菌的16S rDNA V3区扩增,结果见表1。
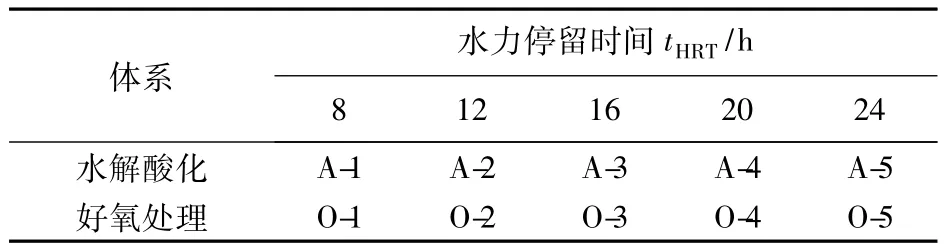
表1 不同tHRT的DGGE条带Table 1 Result of DGGE at different hydraulic retention time
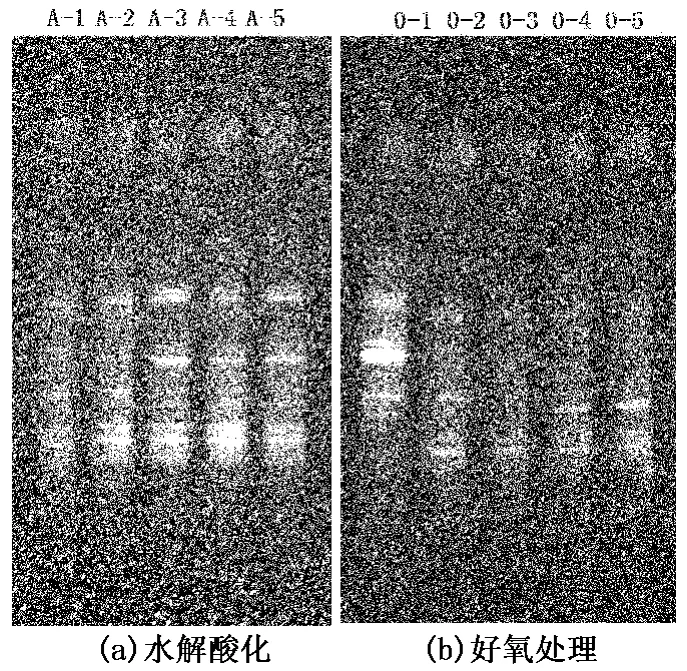
图5 不同tHRT的DGGE结果Fig.5 DGGE result at different hydraulic retention time
污泥样品PCR-DGGE结果见图5。每个样品分离出不同的若干电泳条带,且各条带所代表的PCR产物的产量和迁移率不同,因而表征了污泥样品中的优势菌落的分布。根据DGGE对DNA不同片段的分离原理,这些分离出来的条带都是不同细菌16S rRNA基因V3区片段。每个条带原理上可以代表一个微生物种属。条带信号越强表示该微生物种属在污泥样品中的优势地位越明显。根据DGGE图谱可以初步判断微生物种属的种类和数量与tHRT和出水水质的关系。
由图5(a)可看出:随着tHRT的延长,细菌的种类和数量不断增加,当tHRT>12 h时,细菌群落趋于稳定;随着细菌的种类和数量增加,出水中COD和原油的去除增加幅度较大,当tHRT>12 h时,细菌群落生长受到营养的限制,细菌群落趋于稳定,出水中COD和原油的去除效果变化较小,趋于稳定。对于水解酸化池优势细菌种类和数量的变化与污水的处理效果趋势吻合。
由图5(b)看出:随着tHRT的延长,细菌的种类和数量逐渐减少,当tHRT>16 h时,细菌群落趋于稳定。当tHRT=8 h时,进水中易被细菌利用的营养物质较丰富,污泥中细菌迅速繁殖,对进水COD和原油的去除效果较明显;当tHRT>12 h时,随着进水中可被利用的营养物质的减少,污泥中细菌种类和数量也不断减少,形成新的优势细菌群落,出水COD和原油的去除率不断增加,增幅不断减小。当tHRT>16 h时,形成的优势细菌群落的种类和数量趋于稳定,出水的COD和原油的去除效果也趋于稳定。
通过DGGE图谱可以发现,不同tHRT条件下,水解酸化池和好氧处理池的优势菌种既有相同又有不同:对于水解酸化池,随着tHRT的延长,细菌群落的种类和数量增加;对于好氧处理池,随着tHRT的增加,细菌群落的种类和数量有减少的趋势。在整个过程中既存在始终保持稳定的优势菌种或始终稳定存在但并不占优势的菌种,也有随着培养驯化逐渐被淘汰的菌种,还有在新的环境驯化下逐渐演替为优势地位的菌种[17]。
通过聚类分析,对不同tHRT条件下的水解酸化池和好氧处理池的细菌群落进行相似性分析[18],结果见图6。对于水解酸化池,A-2与A-1、A-3的相似性变化较大,说明细菌群落发生较大变化;随着tHRT的延长,相邻tHRT的菌落的相似性不断增加,A-4和A-5的相似性高达91%,表明污泥中细菌群落比较稳定。对于好氧处理池,O-2与O-1、O-3的相似度变化较大,表明随着tHRT的延长细菌群落变化较大;O-3、O-4、O-5之间的相似度较高,表明当 tHRT>16 h时,随着tHRT的延长细菌群落变化较小。
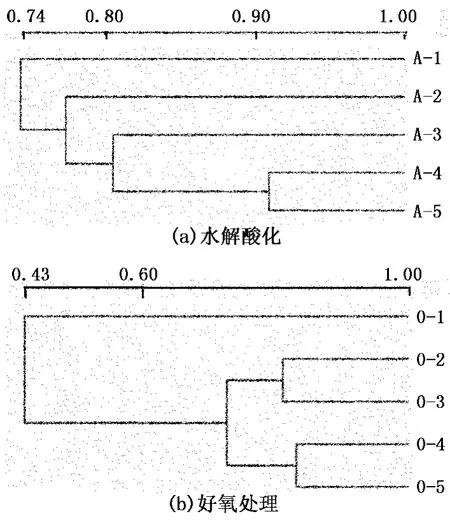
图6 不同tHRT条件下细菌群落相似性的分析Fig.6 Bacterial community similarity analysis at different hydraulic retention time
3 结论
(1)当水解酸化池和好氧处理池的tHRT分别大于12和 16 h时,镜检有高级的原生动物,出水CODCr的去除率大于58.73%,原油的去除率大于98.61%。
(2)水解酸化-好氧处理工艺在不同tHRT条件下运行后,在形成的细菌群落中,既有相同的优势群落,也有各自特有的优势群落:水解酸化池中,随着tHRT的延长,优势群落的种类和数量增加,当tHRT>12 h时,优势群落变化较小,形成稳定的细菌群落,出水水质趋于稳定;好氧处理池中,随着tHRT的延长,优势群落的种类和总量减少,当tHRT>16 h时,优势群落变化较小,形成稳定的生态系统,出水水质趋于最佳。
[1]YANG Y,WANG Z.Oilfield produced water treatment with surface modified fiber ball media filtration[J].Water Science Technology,2002,46(11):165-170.
[2]任琳.活性污泥中原生动物的特征和作用[J].山西建筑,2008,34(22):183-184.
REN Lin.Features and functions of the protozoa in the activated sludge [J].Shanxi Architecture,2008,34(22):183-184.
[3]洪安安,刘德华,刘灿明.活性污泥的主要微生物菌群及研究方法[J].工业水处理,2009,29(2):10-14.
HONG An-an,LIU De-hua,LIU Can-ming.Main microbial community in activated sludge and the research method of it[J].Industrial Water Treatment,2009,29(2):10-14.
[4]MARTINS A M,PAGILLAa K,HEIJNEN J J,et al.Filamentous bulking sludge-a critical review[J].Water Research,2004,38(4):793-817.
[5]MUYZER G,DE WAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993,59(3):695-700.
[6]周琳,张晓君,李国勋,等.DGGE/TGGE技术在土壤微生物分子生态学研究中的应用[J].生物技术通报,2006(5):70-74.
ZHOU Lin,ZHANG Xiao-jun,LI Guo-xun,et al.The application of DGGE/TGGE techniques in molecular microbial ecology of soil[J].Biotechnology Bulletin,2006(5):70-74.
[7]肖勇,杨朝晖,曾光明,等.PCR-DGGE研究处理垃圾渗滤液序批式生物膜反应器(SBBR)中的细菌多样性[J].环境科学,2007,28(5):1095-1101.
XIAO Yong,YANG Chao-hui,ZENG Guang-ming,et al.Bacterial diversity in sequencing batch biofilm reactor(SBBR)for landfill leachate treatment using PCR-DGGE[J].Environmental Science,2007,28(5):1095-1101.
[8]国家环保总局.HJ/T399-2007水质-化学需氧量的测定快速消解分光光度法[S].北京:中国环境科学出版社,2008.
[9]中国石油天然气总公司.SY/T0530-93油田污水中含油量测定方法:分光光度法[S].北京:石油工业出版社,2005.
[10]ZHAO L J,MA F,GUO J B.Applicability of anoxicoxic process in treating petrochemical wastewater[J].Journal of Zhejiang University,2008,10(1):133-141.
[11]CURBS T P,HEAD L M,GRAHAM D W.Theoretical ecology for engineering biology[J].Environmental Science & Technology,2003,37(3):64-70.
[12]王海燕,周岳溪,戴欣,等.16SrDNA克隆文库方法分析MDAT-IAT同步脱氮除磷系统细菌多样性研究[J]. 环境科学学报,2006,26(6):903-911.
WANG Hai-yan,ZHOU Yue-xi,DAI Xin,et al.Bacterial diversity study for the simultaneous nitrogen and phosphorus removal system(MDAT-IAT)by 16SrDNA cloning method [J].Acta Scientiae Circumstantiae,2006,26(6):903-911.
[13]KAO C M,CHEN C S,TSA F Y,et al.Application of real-time PCR,DGGE fingerprinting and culture-based method to evaluate the effectiveness of intrinsic bioremediation on the control of petroleum-hydrocarbon plume[J].Journal of Hazardous Materials,2010,178(1/3):409-416.
[14]LABBE D,MARGESIN R,SCHINNER F,et al.Comparative phylogenetic analysis of microbial communities in pristine and hydrocarbon-contaminated Alpine soils[J].FEMS Microbiology Ecology,2007,59(2):466-475.
[15]刘芳,赵朝成,张秀霞,等.水解酸化-生物接触氧化工艺处理锦纶6废水的脱氮特性分析[J].中国石油大学学报:自然科学版,2007,31(6):112-116.
LIU Fang,ZHAO Chao-cheng,ZHANG Xiu-xia,et al.Characteristics of nitrogen removal from nylon-6 wastewater in hydrolysis acidification-submerged biofilm process[J].Journal of China University of Petroleum(Edition of Natural Science),2007,31(6):112-116.
[16]中国科学院生物多样性委员会.生物多样性的原理与研究方法[M].北京:中国科学技术出版社,1994.
[17]牟洁,孙宝盛,陈谊.利用PCR-DGGE研究膜生物反应器中微生物的群落结构[J].环境科学学报,2010,30(4):729-734.
MOU Jie,SUN Bao-sheng,CHEN Yi.Microbial community structure in a membrane bioreactor determined using PCR-DGGE [J].Acta Scientiae Circumstantiae,2010,30(4):729-734.
[18]DONG X L,REDDY G B.Soil bacterial communities in constructed wetlands treated with swine wastewater using PCR-DGGE technique [J].Bioresource Technology,2010,101(4):1175-1182.
Study on change of microbial community structure in hydrolytic acidification-aerobic biological treatment oily wastewater
BAO Mu-tai1,YAN Guang-bin1,CHEN Qing-guo1,DU Chun-an2,GUO Sheng-xue2,LI Xi-ming2
(1.Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,Ocean University of China,Qingdao 266100,China;2.Research Institute of Oil Production Technology,Shengli Oilfield,SINOPEC,Dongying 257000,China)
In order to reveal the biological community changes of hydrolytic acidification-aerobic system in oilfield produced water treatment,the biological phase of aerobic tank was observed,and the genomic DNA of microbial communities was extracted.The V3 region in DNA was amplified by the universal primers,and the bacterial community structure of hydrolytic acidification-aerobic system was studied by polymerase chain reaction(PCR)amplification and denaturing gradient gel electrophoresis(DGGE).The results show that the removals of CODCrand oil content in oil wastewater are more than 58.73%and 98.61%when the hydraulic retention times(HRT)of anoxic tank and aerobic tank are beyond 12 h and 16 h respectively.The senior protozoa could be found in treated wastewater by the microscopic.From the profiles of DGGE bands,it can be seen that both the similarities and differences existed in the main bacterial community of treated wastewater after hydrolytic-aerobic biological treatment under different HRT condition.In the hydrolysis tank,with the increase of HRT,the species and quantity of the main bacterial communities increase.When the HRT is longer than 12 h,the main microbial community seldom changes,and the stable community and water quality are formed.While in the aerobic treatment tank,the species and quantity of the main bacterial communities decrease with the increase of HRT.When the HRT is longer than 16 h,the main microbial community seldom changes,and the stable community is also formed,the best water quality is obtained.
microbial community;hydrolytic acidification;aerobic biological treatment;oily wastewater;denaturing gradient gel electrophoresis(DGGE)
X 703.1
A >
10.3969/j.issn.1673-5005.2011.04.032
1673-5005(2011)04-0167-05
2011-03-20
青岛市应用基础研究计划项目(09-1-3-17-jch);“十一五”国家科技支撑计划项目(2006BAB04B02)
包木太(1971-),男(汉族),山东临沂人,教授,博士,博士生导师,主要从事微生物驱油理论、环境生物修复应用基础、油品指纹信息提取与鉴别及生物氧化除油技术研究。
(编辑 刘为清)
