C掺杂WO3-x的制备及其光解水活性研究
2010-12-31李耀民李文章
王 旋,郭 芹,李耀民,王 晨,李文章,李 洁
(1.中南大学 有色金属资源化学教育部重点实验室,湖南 长沙 410083;2.沈阳铝镁设计研究院,辽宁 沈阳 110001;3.中南大学材料科学与工程学院,湖南 长沙 410083)
0 引言
作为重要的战略有色金属,钨资源的利用和高附加值深加工意义重大。WO3是常见的光催化析氧材料[1-2],可实现H2O的完全分解,这为WO3的利用提供了有效途径。与常用的光催化剂TiO2、ZnO等相比,WO3具有较小的禁带宽度和较大的光吸收范围,能更有效地利用占太阳辐射能量近一半的可见光。然而,尽管WO3光解水引起了人们极大兴趣,但目前能产生的光转换效率还远未达到预期目标。
大量研究[3-8]表明金属离子掺杂明显提高了WO3的光解水活性,但掺杂金属离子也往往成为光生电子和空穴的复合中心而不利于光电子的传输[9]。Asahi等首先通过理论计算证实了非金属掺杂光催化剂的可行性[10];Sun等[11]利用喷雾热解法以葡萄糖为碳源制备了C掺杂WO3薄膜,发现C掺杂在一定程度上降低了WO3的禁带宽度,并明显提高了WO3的光响应电流。
本文采用溶胶-凝胶法制备了C掺杂WO3粉体(C-WO3-x),通过扫描电镜(SEM)、X-射线衍射(XRD)、紫外可见漫反射(DRS)、X-射线光电子能谱(XPS)等对粉体催化剂进行表征,并在以Fe3+为牺牲剂的催化剂悬浮液体系中测试其在紫外(UV)和可见光(VIS)照射下的光解水析氧活性。
1 实验部分
将一定量钨酸和H2O2混合后在40℃下搅拌形成溶胶,用Pt网去除剩余的H2O2,按质量分数(m(C)/m(WO3)=2.0%)加入四丁基氢氧化铵(分子式[CH3(CH2)3]4NOH)的乙醇溶液,陈化12h后在60℃下烘干得到掺杂催化剂前驱体,随后在500℃下煅烧1h得到C-WO3-x光催化剂。不加入四丁基氢氧化铵时则得到WO3-x粉末。
采用日本JEOL公司JSM-5600LV型扫描电子显微镜(SEM)观测催化剂的表面形貌及颗粒大小;采用日本Rigaku公司D/max2250型X-射线衍射仪(XRD)检测样品的晶体结构;采用英国Kratos公司XSAM800型X-射线光电子能谱仪(XPS)测定样品表面化学组成;采用美国EDAX公司GENESIS 60S型能量散射X-射线光谱(EDS)检测光催化剂的化学组成及C-WO3的C元素含量;采用北京普析通用TU-1901紫外可见分光光度计(BaSO4为参比标准白板)对样品进行紫外可见漫反射光谱(DRS)分析。
光催化活性评价采用自制的内置光源中空夹套式石英反应器(约560mL)。光源分别为主频500nm和365nm的250W氙灯和高压汞灯。反应前将560mL的蒸馏水煮沸20min以尽量除去反应体系中的空气,待其冷却至室温后加到反应装置中,同时加入2g粉体催化剂,控制反应的pH值为2.0,电子接受体Fe3+的浓度为16.0mmol/L。采用磁力搅拌器使催化剂保持悬浮,利用外部循环水控制反应体系温度为室温,并采用排水法测量析氧体积。
2 结果与讨论
2.1 WO3-x和C-WO3-x的形貌及晶体结构
图1为WO3-x与C-WO3-x的SEM图,可见掺杂前后的样品均为不规整纳米颗粒,尺寸在150nm左右,说明C掺杂没有引起WO3-x形貌和粒度的明显变化。

图1 WO3-x和C-WO3-x的SEM图
图2给出了WO3-x和C-WO3-x的XRD图谱,2θ约为23°和34°的主要衍射峰表明掺杂前后样品均以单斜晶型为主。对于C-WO3-x,在2θ=13.86°、27.16°和28.00°处出现的新衍射峰(标记为“C”)表明C掺杂在一定程度上改变了WO3-x的晶体结构,这预示着C原子有可能进入WO3-x的晶格,改变其结晶机制从而产生新相。同时,C掺杂还影响了WO3-x的择优生长取向和晶体生长习性,C-WO3-x在2θ=23.10°的特征峰(单斜WO3{002}晶面)衍射强度明显强于WO3-x。衍射峰强度变强,表明该晶面显露多,晶体生长速度加快。这表明在烧结过程中C掺杂有利于单斜WO3晶体的生长,因而出现大的晶粒。以上结果还表明,C掺杂导致了一定程度的晶格畸变,使C-WO3-x中具有相对高的晶格缺陷,适量的晶格缺陷将有助于提高光催化剂的催化活性。

图2 WO3-x和C-WO3-x的XRD图谱
2.2 WO3-x和C-WO3-x的化学成分及元素形态
图3为WO3-x和C-WO3-x的XPS全谱图,可看出,WO3-x和C-WO3-x粉体表面均含有O和W两种元素,其中W4f的电子结合能约为36eV,而O1s的电子结合能约在530eV附近,定量分析结果表明O与W的原子比略低于3,说明产物中存在一定含量的氧空位。由于掺杂元素的含量特别是其在样品表面的含量极低,加之仪器检出限的限制,因此在XPS谱中未能发现两C的特征峰,但却在C-WO3的EDS谱(见图4)中证实了C元素的存在,其含量约为0.84%(原子分数)。

图3 WO3-x和C-WO3-x的XPS全谱图

图4 C-WO3-x的能谱图
对W4f电子电离区域精细结构进行分析发现WO3-x表面W物种存在2种价态(见图5a),35.50eV和37.50eV分别对应于W6+的4f7/2和4f5/2,占99.66%;34.80eV和36.80eV分别对应于W5+的4f7/2和4f5/2,占6.34%。从图5b可知,C-WO3-x表面W物种也存在2种价态,35.55eV和37.55eV分别对应于W6+的4f7/2和4f5/2,占90.89%;34.65eV和36.65eV分别对应于W5+的4f7/2和4f5/2,占9.11%。
同样分析WO3-x及C-WO3-x的O1s电子解离区域的XPS图谱时发现其并不对称,说明样品表面氧的存在并非单一形态,通过高斯分布函数对其进行拟合后认为样品表面存在晶格氧(约530.74eV)和吸附氧(约531.25eV)两种形式。经过拟合计算后得知,C掺杂后WO3-x表面的晶格氧含量由95.88%降低至94.16%。
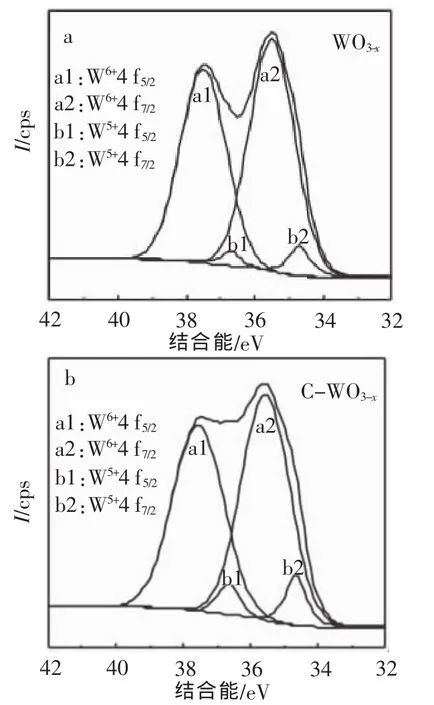
图5 WO3-x和C-WO3-x的W4f区域XPS拟合图
上述结果表明,C掺杂基本上没有引起各种元素存在形态的电子结合能发生偏移,但在一定程度上增加了催化剂表面W5+和吸附氧的含量,而降低了W6+和晶格氧的含量。这些变化都证实了催化剂中的氧空位含量增加,这可能是因为掺杂元素在WO3-x晶格表面发生氧化还原反应后通过扩散而形成的。
Yu等[12]在研究F掺杂TiO2时认为F掺杂可以通过电荷补偿促使Ti4+向Ti3+转化,而Ti3+的存在有助于抑制光生电子和空穴的复合。类似地,化学计量比的WO3中W原子为失去了5d轨道所有电子的W6+,当有氧空位存在时,与氧空位相邻的W原子的5d轨道可被部分占据而出现W5+,此时其5d轨道可用于电子传递从而抑制光生电子和空穴的复合。非金属掺杂WO3时,能促进W6+转化为W5+,增加W5+含量从而增加光生电子和空穴有效分离的几率。
2.3 WO3-x和C-WO3-x的光吸收性能
WO3-x和C-WO3-x的紫外可见漫反射光谱如图6所示,在200~380nm的紫外光区WO3-x与CWO3-x的反射率没有明显差别;然而在380~700nm的可见光区,C掺杂极大地降低了WO3-x的反射率,这表明C-WO3-x具有比纯WO3-x更好的光吸收性能。非金属掺杂引入中间能级是改善光催化剂光吸收性能的重要原因,但鉴于C掺杂没有引起吸收边缘发生明显的红移,我们认为催化剂光吸收性能增强的主要原因是氧空位含量的增加所导致的非本征吸收[13-15]增加的结果。
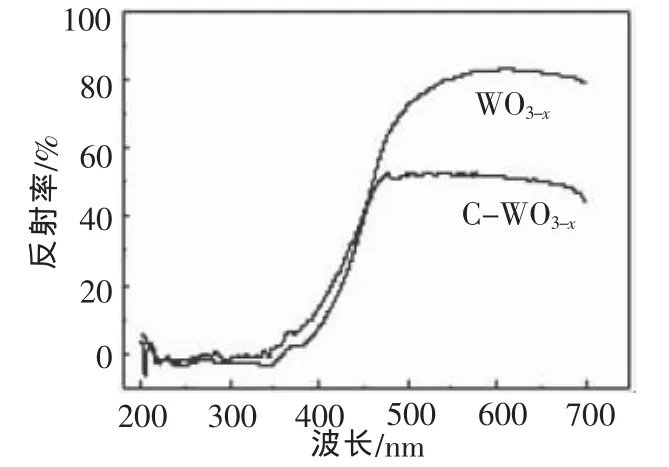
图6 WO3-x和C-WO3-x的DRS图谱
2.4 WO3-x和C-WO3-x的光解水析氧活性
图7给出了WO3-x和C-WO3-x催化剂在紫外光照射下光解水产氧量随时间的变化。由图可知,C-WO3-x在12h内平均产氧速率达到90.0μmol/(L·g·h),是同等条件下WO3-x(47.1μmol/(L·g·h))的1.91倍。由于DRS结果表明在紫外区掺杂催化剂具有与纯WO3-x相似的光吸收性质,因此这种光催化活性的提高应主要归因于晶格缺陷和氧空位的存在所导致的非本征吸收的增加以及光电子传输性能的改善。
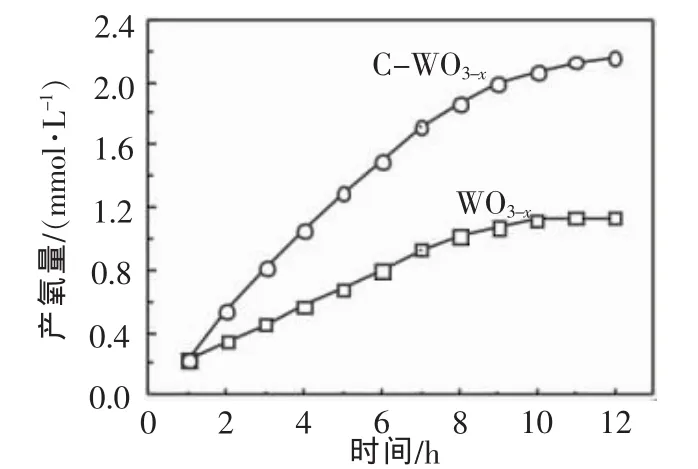
图7 紫外光下WO3-x和C-WO3-x的光解水析氧活性

图8 可见光下WO3-x和C-WO3-x的光解水析氧活性
我们同样考察了WO3-x和C-WO3-x催化剂在可见光照射下的光解水析氧速率(见图8),结果发现C-WO3-x在12h内平均产氧速率由WO3-x的17.5μmol/(L·g·h)增加到26.6μmol/(L·g·h),提高了52%。这与DRS显示C-WO3-x在可见光区吸收增强的结果是一致的。Cole等[16]研究发现N掺杂可提高WO3-x薄膜的光吸收性能,但由于其晶体结构被严重破坏反而降低了其光电流,其认为主要原因是过量的晶格缺陷导致产生晶体学切变,从而降低了催化剂的电子传输性能,而本研究中晶体结构没有发生这种显著的改变。
3 结论
C掺杂在一定程度上改变了WO3的晶体结构,在不产生晶体学切变的前提下,使得催化剂表面W5+和氧空位含量增加,这些都提高了WO3-x的光吸收性能和电子传输性能,从而有利于光催化活性的提高。在紫外和可见光照射下,C掺杂WO3光解水析氧速率分别比WO3-x提高了91%和52%。
[1]高友良,陈启元,尹周澜,等.O2/Ar气氛中仲钨酸铵热分解制备的WO3光催化分解水析氧活性[J].中国有色金属学报,2006,16(5):904-908.
[2]高友良,陈启元,尹周澜,等.氧空位对WO3光催化析氧活性影响的研究[J].无机化学学报,2005,21(10):1510-1514.
[3]Radecka M,Sobas P,Wierzbicka M,et al.Photoelectrochemical properties of undoped and Ti-doped WO3[J].Physica B,2005,364(1-4):85-92.
[4]Hameed A,Gondal M A,Yamani Z H.Effect of transition metal doping on photocatalytic activity of WO3for water splitting under laser illumination:role of 3d-orbitals[J].Catal Commun,2004,5(11):715-719.
[5]杜俊平,李 洁,陈启元.低含量Pr3+掺杂WO3的制备及其光催化分解水析氧活性[J].中国有色金属学报,2007,17(10):1695-1699.
[6]杜俊平,李 洁,陈启元,等.低量La3+掺杂WO3的表征及其光解水催化性能的研究[J].有色金属:冶炼部分,2008,(1):48-51.
[7]杜俊平,陈启元,赵 娟,等.铈掺杂WO3的表征及其光解水催化性能的研究[J].无机化学学报,2007,23(6):1005-1010.
[8]赵 娟,刘士军,李 洁,等.钇掺杂WO3的制备及光催化分解水析氧活性[J].中国有色金属学报,2008,18(2):330-335.
[9]Choi W,Termin A,Hoffmann M R.The role of metal ion dopants in quantum-sized TiO2:correlation between photoreactivity and charge carrier recombination dynamics[J].J Phys Chem,1994,98(51):13669-13679.
[10]Asahi R,Morikawa T,Ohwaki T,et al.Visible-light photocatalysis in nitrogen-doped titanium oxides[J].Science,2001,293(5528):269-271.
[11]Sun Y,Murphy C J,Reyes-Gil K R,et al.Photoelectrochemical and structural characterization of carbon-doped WO3films prepared via spray pyrolysis[J].Int J Hydrogen Energy,2009,34(20):8476-8484.
[12]Yu J C,Yu J,Ho W,et al.Effects of F-doping on the photocatalytic activity and microstructures of nanocrystalline TiO2powders[J].ChemMater,2002,14(9):3808-3816.
[13]Li D,Haneda H,Hishita S,et al.Fluorine-doped TiO2powders prepared by spray pyrolysis and their improved photocatalytic activity for decomposition of gas-phase acetaldehyde[J].J Fluorine Chem,2005,126(1):69-77.
[14]Xu J,Ao Y,Fu D,et al.Low-temperature preparation of F-doped TiO2film and its photocatalytic activity under solar light[J].Appl Surf Sci,2008,254(10):3033-3038.
[15]Li D,Haneda H,Labhsetwar N K,et al.Visible-light-driven photocatalysis on fluorine-doped TiO2powders by the creation of surface oxygen vacancies[J].Chem Phys Lett,2005,401(4/6):579-584.
[16]Cole B,Marsen B,Miller E L,et al.Evaluation of nitrogen doping of tungsten oxide for photoelectrochemical water splitting[J].J Phys Chem C,2008,112(13):5213-5220.
