酶法制备瓜尔胶半乳甘露低聚糖的研究
2010-12-28亮何紫姣李存芝陈勇孙颖莺
傅 亮何紫姣李存芝陈 勇孙颖莺
(1.暨南大学食品科学与工程系,广东 广州 510632;2.佛山市广粮饮料食品有限公司,广东 佛山 528137)
酶法制备瓜尔胶半乳甘露低聚糖的研究
傅 亮1何紫姣1李存芝1陈 勇2孙颖莺2
(1.暨南大学食品科学与工程系,广东 广州 510632;2.佛山市广粮饮料食品有限公司,广东 佛山 528137)
以瓜尔胶为原料,采用β-甘露聚糖酶酶法制备半乳甘露低聚糖。通过单因素试验及L9(34)正交试验对酶解反应条件进行优化和验证。结果表明,其最佳反应条件为:瓜尔胶浓度0.5%,加酶量20IU/g,pH 6.0,50℃,反应时间8h。在此条件下,酶解率为24.2%,平均聚合度为4.13。采用高效液相色谱定性分析发现,酶解产物是以二糖为主要成分的半乳甘露低聚糖。
瓜尔胶;β-甘露聚糖酶;半乳甘露低聚糖
瓜尔胶(guar gum)又名瓜胶、瓜尔豆胶,是一种天然半乳甘露聚糖胶。其主键为(1-4)-β-D-甘露糖单位,侧键则由单个的α-D-半乳糖以(1-6)键与主链相连接,在主键上平均每两个甘露糖单位中有一个半乳糖单位在C-6位与之相连,甘露糖对半乳糖之比为1.8∶1(约为2∶1)[1]。β-1,4-D-甘露聚糖水解酶是一类从甘露聚糖、葡甘露聚糖、半乳甘露聚糖和半乳葡甘露聚糖的主链内部随机切割β-1,4-D-甘露糖苷键的水解酶,简称β-甘露聚糖酶(β-mannanase)[2],广泛存在于动植物和微生物中。据文献[3]报道,某些植物胶(如魔芋胶、角豆胶、瓜尔豆胶、田菁胶等)经β-甘露聚糖酶水解后的产物含有不同单糖分子组成的低聚糖。
半乳甘露低聚糖(galacto-mannan-oligosaccharides,简称GMOS)是低聚糖家族的新成员,是半乳甘露聚糖的不完全降解产物,它能显著增进人体肠道内以双歧杆菌为代表的有益菌的增殖,且具有减少动物肠道病原菌、增强免疫、提高肠黏膜功能等多种特性[4-7]。目前,在日本已有以瓜儿胶为原料制备的甘露低聚糖功能食品,但中国多是用魔芋胶制取葡甘露低聚糖[8-10],而且对由瓜尔胶制备半乳甘露低聚糖的研究较少。随着瓜尔豆在中国的推广种植[11],用瓜尔胶为原料制备半乳甘露低聚糖将会具有重要的现实意义。本试验采用β-甘露聚糖酶对瓜儿胶进行酶解,优化酶法制备半乳甘露低聚糖的工艺条件,并对酶解产物进行定性检测,旨在为产品的工业化生产提供参考。
1 材料与方法
1.1 材料与试剂
瓜尔胶:广东大地食用化工有限公司;
β-甘露聚糖酶:昆明爱科特生物科技有限公司;
甘露糖、甘露二糖:广州市齐云生物技术有限公司;
其他试剂均为国产分析纯。
1.2 仪器与设备
定时恒温磁力搅拌器:90-2型,上海沪西分析仪器有限公司;
数字旋转黏度计:SNB-1型,上海恒平科学仪器有限公司;
可见光分光光度计:JH 722S型,上海菁华科技仪器有限公司;
高效液相色谱分析仪:Shimadzu LC-20AT型,日本岛津公司;
示差折光检测器:RID-10A型,日本岛津公司。
1.3 检测方法
1.3.1 β-甘露聚糖酶活力的测定 参照文献[12]。取0.5%的瓜尔胶溶液(pH 5.0的磷酸氢二钠-柠檬酸缓冲液配置)20mL,加入0.1mL用pH 5.0缓冲液配置的粗酶液,于50℃反应30min,用DNS法测还原糖量。在上述试验条件下,以每分钟水解底物产生1μmol还原糖(以甘露糖计)所需的酶量定义为一个β-甘露聚糖酶酶活单位(IU/g)。
1.3.2 黏度测定 采用SNB-1数字旋转黏度计。
1.3.3 瓜尔胶总糖测定 准确称取0.05g瓜尔胶置于20mL具塞试管内,依次加入10mL水和0.4mL浓硫酸,于100℃水解2h,冷却后用NaOH中和,然后定容100mL。取1.0mL用DNS法测定还原糖(以甘露糖计)量,计算总糖量。总糖含量按公式(1)计算:

1.3.4 瓜尔胶酶解率 不同浓度的瓜尔胶溶液中加入一定活力单位的β-甘露聚糖酶(加酶量以IU/g瓜尔胶计),于不同温度下反应一定时间,取样适当稀释后用DNS法测定酶解液中的还原糖(以甘露糖计)量。酶解率按公式(2)计算:

1.3.5 平均聚合度(DP) 聚合度为寡糖中组成寡糖的单糖单位的个数[13]。半乳甘露低聚糖的DP按公式(3)计算:

1.3.6 酶解产物高效液相色谱定性检测 酶解液加入2倍体积的无水乙醇,静置后离心,取上清液,浓缩,采用高效液相色谱仪定性分析。色谱条件:色谱柱Kromasil 100-5NH2(150×4.6mm),柱温40℃,流速1mL/min,进样量20μL,流动相为乙腈∶水=70∶30,示差折光检测器分析。
1.4 试验方法
1.4.1 单因素试验 以酶解率和DP为指标,依次分别对加酶量、底物浓度、酶解温度、pH值和反应时间进行单因素试验。在0.5%的瓜尔胶溶液中分别加入10,15,20,25,30,40IU/g的β-甘露聚糖酶,于pH 5.0,50℃反应30min,以确定最佳加酶量;分别配置浓度为0.25%、0.5%、1.0%、1.5%、2.0% 的瓜尔胶溶液,各加入β-甘露聚糖酶20IU/g,于pH 5.0,50℃反应30min,以选择合适的底物浓度;在0.5%的瓜尔胶溶液中加入20IU/gβ-甘露聚糖酶,分别在pH 5.0,温度分别为30,40,45,50,55,60,70,80℃的条件下反应30min,以确定合适的反应温度;分别用pH 4.0,5.0,6.0,7.0,8.0的缓冲液配置0.5%的瓜尔胶溶液,各加入20IU/gβ-甘露聚糖酶,于50℃反应30min,以选择最佳pH;0.5% 的 瓜 尔 胶 溶 液 加 入 20IU/gβ-甘 露 聚 糖 酶,pH 5.0,50℃进行反应,在1~10h内,每间隔1h取样测定酶解率,以确定合适的酶解反应时间。每个水平重复3次,测定结果并取平均值。
1.4.2 正交试验设计 由于瓜尔胶酶解过程不仅受加酶量、底物浓度、温度、时间、pH等因素影响,而且这些因素还存在复杂的交互作用,故而设计L9(34)正交试验,以确定酶解瓜尔胶制备半乳甘露低聚糖的最佳条件。
2 结果与分析
2.1 甘露糖标准曲线的绘制
以甘露糖含量为横坐标,吸光度为纵坐标做标准曲线(见图1),得出回归方程为:y=0.012 4x-0.016,线性相关系数R2=0.998 6。
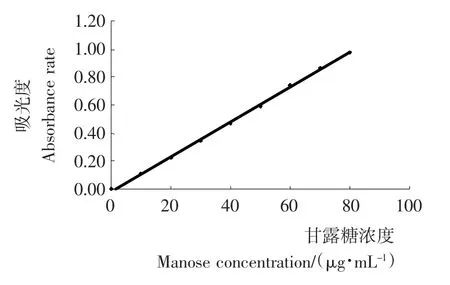
图1 甘露糖标准曲线Figure 1 Standard curve of mannose
2.2 黏度测定
瓜尔胶酶解前后的黏度变化测定结果见表1。1%的瓜尔胶黏度为4 294MPa·s,加入一定量β-甘露聚糖酶后,在5min后,黏度迅速下降,说明β-甘露聚糖酶能很好的降解瓜尔胶。可利用这种特性,通过补充底物的方式获得高浓度的水解液。
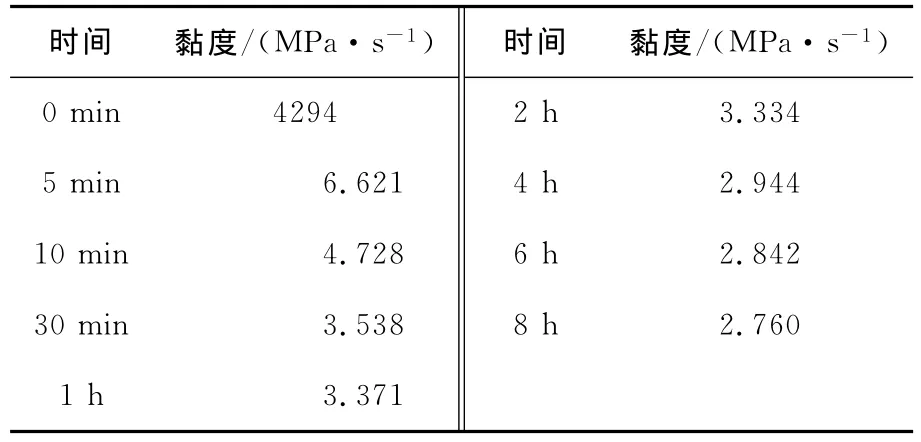
表1 酶解过程中瓜尔胶溶液的黏度变化Table 1 The change of guar gum’s viscosity during hydrolysis
2.3 瓜尔胶总糖测定
0.05 g瓜尔胶被浓硫酸水解后中和定容至100mL,取1mL测定还原糖量。通过计算测得瓜尔胶总糖含量为77.1%。
2.4 酶解试验结果与分析
通过单因素试验,分别获得各因素的最佳试验结果,即加酶量20IU/g、瓜尔胶浓度0.5%、酶解温度45℃、pH 6、时间8h。考虑到高浓度的瓜尔胶因为黏度过大而不利于酶解反应的进行,故在单因素试验的基础上,固定瓜尔胶溶液浓度为0.5%,选择加酶量、酶解温度、酶解pH和时间4因素设计L9(34)正交试验,以确定酶解瓜尔胶制备半乳甘露低聚糖的最佳条件。正交试验因素及水平见表2,正交试验结果见表3。根据正交结果分析,pH对酶解率的影响最大,其次是加酶量,反应时间和温度对酶解率率的影响相对较小。酶解的最佳条件为A2B3C2D2,即瓜尔胶浓度0.5%,加酶量20IU/g,pH 6.0,50℃,反应时间8h。由于此条件在正交表中并未列入,故按此条件进行验证[14],测得其酶解率为24.2%,平均聚合度为4.13,优于正交表中的试验值。
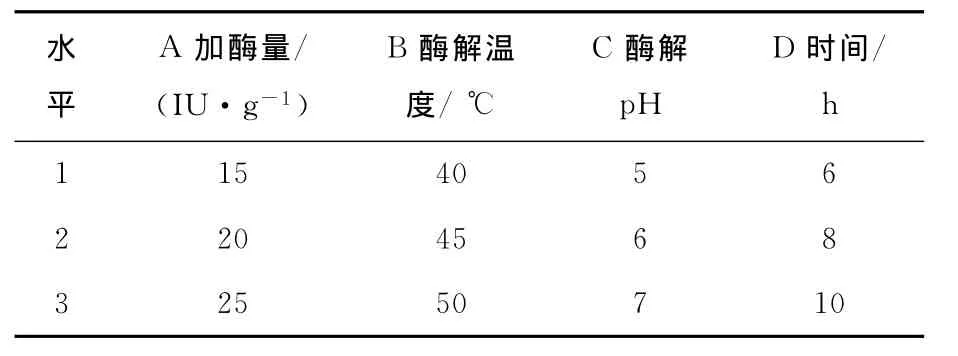
表2 L9(34)正交试验因素水平Table 2 Factor and level of orthogonal test(n=3)

表3 L9(34)正交试验结果Table 3 Results of orthogonal experiment(n=3)
2.5 酶解产物高效液相色谱定性分析
分别取甘露糖和甘露二糖标准溶液以及酶解液进行高效液相色谱检测,结果见图2。
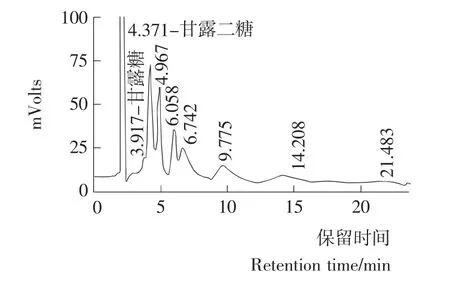
图2 瓜尔胶酶解液高效液相色谱图Figure 2 HPLC of guar gum hydrolysate
根据甘露糖和甘露二糖标准溶液的保留时间(分别是3.667和4.234)分析,酶解产物中主要以二糖为主。
3 结论
由于酶解反应可以在短时间内降低瓜尔胶的黏度,因此在工业生产上,可以采用批量添加瓜尔胶的方式,从而获得高浓度的水解液。在单因素试验基础上,通过正交试验确定酶解制备半乳甘露低聚糖的最佳反应条件为瓜尔胶浓度0.5%,加酶量20IU/g,pH 6.0,50℃,反应时间8h。在此条件下,酶解率为24.2%,平均聚合度为4.13。经HPLC定性检测,瓜尔胶酶法制备的半乳甘露低聚糖以二糖为主。
1 胡国华,翟瑞文.瓜尔豆胶的特性及其在食品工业中的应用[J].冷饮于速冻食品工业,2002,8(4):26~28.
2 齐军茹,廖劲松,彭志英.β-甘露聚糖酶的制备及其应用研究进展[J].中国食品添加剂,2002(6):12~16.
3 杨文博,佟树敏,沈庆,等.β-甘露聚糖酶酶解植物胶及其产物对双歧杆菌促生长作用[J].微生物学通报,1995,22(4):204~207.
4 Takahashi T,Yokawa T,Ishihara N,et al.Hydrolyzed guar gum decreses postprandial blood glucose and glucose absorption in the rat small intestine[J].Nutrition Research,2009,(29):419~425.
5 Yamatoya K,Kuwano K,Suzuki J.Effects of hydrolyzed guar gum on cholesterol and glucose in humans[J].Food Hydrocolloids,1997,11(2):239~242.
6 Hidehisa T,Yang S I,Mujo K.Protein and energy utilization of growing rats fed on the diets containing intact or partially hydrolyzed guar gum[J].Comparative Biochemistry and Physiology Part A:Physiology,1994,107(1):255~260.
7 石军,李俊婷,陈安国.甘露寡糖在动物生产中的应用[J].粮油食品科技,2003,11(1):36~37.
8 李剑芳,邬敏辰,程科,等.β-甘露聚糖酶制备魔芋葡甘露低聚糖的研究[J].食品与发酵工业,2007,33(1):21~24.
9 吴长菲,董岩岩,李俊俊,等.魔芋葡甘露低聚糖的酶法制备工艺的初步研究[J].生物技术通报,2010(1):118~122.
10 余红英,杨幼慧,孙远明,等.β-甘露聚糖酶作用魔芋胶条件研究[J].食品工业科技,2003,24(7):33~35.
11 徐又新,史劲松,孙达峰,等.瓜尔豆的资源分布及引种栽培[J].中国野生植物资源,2009,28(2):69~71.
12 余红英,杨幼慧,杨耀生,等.枯草芽孢杆菌β-甘露聚糖酶补料发酵及其特性研究[J].微生物通报,2002,29(5):25~29.
13 石波.玉米芯酶法制备低聚木糖的研究[D].北京:中国农业大学,2001.
14 胥彩云,童军茂,周晓宏.酶水解法提高大豆蛋白水解度的研究[J].食品与机械,2010,26(1):9~11.
Enzymatic preparation of galacto-mannan-oligosaccharides from guar gum
FU Liang1HE Zi-jiao1LI Cun-zhi1CHEN Yong2SUN Ying-ying2
(1.Department of Food Science and Engineering,Jinan University,Guangzhou,Guangdong,510632,China;2.Foshan Guangliang Drink and Food Inc.,Foshan,Guangdong528137,China)
Guar Gum was used as raw material to prepare Galacto-Mannan-Oligosaccharides(GMOS)byβ-Mannanase.The factors,including the guar gum concentration,pH value,temperature,enzyme amount and reaction time on the hydrolysis of guar gum were studied respectively.Based on the results,the orthogonal experiment was designed to obtain optimized conditions for GMOS.The result indicated that pH was the most critical factor on the rate of hydrolysis,and then the enzyme amount.Reaction time and temperature had relatively low effect on the rate of hydrolysis.The optimum enzymatic hydrolysis conditions were guar gum concentration 0.5%,enzyme amount 20IU/g,pH 6.0,50℃,8h.Under optimal conditions,the hydrolysis rate was 24.2%,and the polymerization in average degree was 4.13.The hydrolysate was detected by high performance liquid chromatography(HPLC)and the result showed that the main component of GMOS was disaccharide.
guar gum;β-mannanase;galacto-mannan-oligosaccharides
10.3969 /j.issn.1003-5788.2010.05.035
傅亮(1968-),男,暨南大学副教授,博士。E-mail:fuliang@188.com
2010-05-01
