131I-1H12的制备及对非小细胞肺癌细胞A549的结合及生物学效应研究
2010-12-25殷宁杜明华钟英曲海船
殷宁,杜明华,钟英,曲海船
(东南大学附属中大医院核医学科,江苏南京 210009)
表皮生长因子受体(EGFR)在非小细胞肺癌的治疗中已成为一个重要的靶点,目前针对EGFR的肺癌靶向治疗药物(易瑞沙、特洛凯等)早已进入临床应用[1-2]。为研究应用抗EGFR抗体进行非小细胞肺癌放射免疫显像及治疗的可能性,本实验通过放射性碘标记EGFR单克隆抗体(monoclonal antibody,McAb)1H12,探讨了131I-1H12与人肺癌细胞A549在体外结合情况及其生物学效应。
1 材料与方法
1.1 A549细胞
人非小细胞肺癌A549细胞系22代,购于中国科学院上海细胞生物研究所。
1.2 主要仪器
FH463A自动定标器(西安二六二厂核仪器分厂);RM-905a活度计(中国计量科学研究所);HERA Cell CO2培养箱(美国Kendro公司);Eppendorf cenhifuge低温冷冻离心机(德国Eppendorf公司);YJ-875超净工作台(苏州苏净净化设备有限公司);流式细胞仪:FACS Vantage SE型。
1.3 主要试剂
鼠抗人EGFR McAb(1H12):美国CST公司产品,纯度>98%。Na131I溶液:中国核动设计院第一研究所(无还原剂、无载体)产品。Iodogen(四氯二苯基甘脲):美国Sigma公司产品。葡聚糖凝胶G-50(SephadexG-50):瑞典Amersham Biosciences公司产品。细胞培养液RPMI 1640培养液:Gibcobrl公司产品。胎牛血清(FCS):杭州四季青生物工程材料有限公司产品。
1.4 131I-1H12 的标记与鉴定[3]
(1)标记前准备:将Iodogen溶解于二氯甲烷中制成浓度为 1 μg·μl-1的 Iodogen 溶液,取 100 μl加入乙烯Eppendorf管中,氮气吹干后在试管底部内壁形成一层均匀的Iodogen膜,制备完成后保存于4℃备用。(2)Iodogen法131I标记1H12:在涂布 Iodogen的 Eppendorf管中依次加入0.5 mol·L-1、pH 7.6 的磷酸盐缓冲液 50 μl,1H12 25.0 μg(pH 7.6 PBS 溶解,浓度1 μg·μl-1),Na131I 46.25 MBq,充分混匀后在室温下反应10 min,其间温和振荡数次。(3)分离纯化反应:将反应液滴加于预先经PBS(0.01 mol·L-1、pH 7.4)平衡、2%牛血清白蛋白封闭饱和的SephadexG-50层析柱上,用0.01 mol·L-1、pH 7.4 的 PBS 洗脱层析柱,自动收集器收集部分洗脱液,流速每管1.0 ml·min-1,共收集20管,按收集时间顺序排列各管;RM905放射性活度计测定各管的活度,以Rf为横坐标,对应各管的放射性活度为纵坐标,制作时间-放射性活度洗脱曲线。(4)放射化学纯度(radio chemical purity,RCP)测定:生理盐水纸层析法测定标记物RCP。(5)计算标记率、放射浓度:标记率=蛋白峰各管放射性活度总和/蛋白峰加游离峰各管放射性活度之和;放射浓度=投入的Na131I总量×标记率/蛋白峰收集的总ml数。(6)比活度的测定:放射性比活度=投入的Na131I总量×标记率/投入的1H12量。(7)131I-1H12的体外稳定性,置于室温37℃,于第24小时、48小时、72天测定各自放射化学纯度,评价其体外稳定性。(8)131I-1H12收集液过滤除菌备用。
1.5 131I-1H12对A549细胞株的体外实验
(1)A549细胞EGFR表达率:取对数生长期细胞,调整细胞浓度至106ml-1,用-20℃预冷的80 ml·L-1乙醇固定过夜,流式细胞测定EGFR的表达率。(2)131I-1H12免疫活性的鉴定:常规培养的肺癌细胞株(A549)、脐静脉血管内皮细胞,用RPMI 1640完全培养液制备细胞悬液调至细胞浓度1×106ml-1,两种细胞分别装入6孔培养板使细胞浓度在1×106细胞·(1.0 ml)-1·孔-1(足量),每组细胞中分别加入131I-1H12(105 cpm),摇匀,常规培养12 h,每2 h振荡1次,培养12 h后将每孔的上清液移入试管,0.25 ml胰蛋白酶消化A549细胞与脐静脉血管内皮细胞,将细胞移入装有相应上清液的试管。在FH463A自动定标器上测定每孔的总放射性。1 000 r·min-1离心5 min,去上清液。沉淀用PBS洗涤3次,最后测沉淀物放射性。按如下公式计算体外细胞结合率:体外细胞结合率(%)=沉淀部分放射性计数(cpm)/总放射性计数(cpm)×100%[4]。(3)药物实验分组:将24瓶对数生长期A549细胞分成A~F 6组,每组4瓶,A、B、C组分别加入131I-1H12 148、74、37 kBq,D 组加入 Na131I溶液 148 kBq,E 组加入 1H12 80 nmol·L-1,F 组加入等量培养液[5]。(4)检测131I-1H12对细胞的生物学作用:给药后的各组细胞用小铅砖分隔培养12 h后换液(普通培养液),继续分隔培养36 h。显微镜下观察细胞形态,收集细胞以调整浓度至106ml-1,用-20℃预冷的80 ml·L-1乙醇固定过夜,并用以 AnnexinⅤ-FIFC/PI双染法测定药物对细胞的早期诱导凋亡作用,采用DNA 倍体分析法检测细胞周期[4,6]。
1.6 统计学处理
数据用均数±标准差表示,SPSS 13.0软件处理,采用方差分析;两两比较采用LSD法。
2 结 果
2.1 EGFR McAb131I-1H12的标记及鉴定
Iodogen法碘化标记McAb(1H12),经SephadexG-50柱层析分离游离碘和EGFR McAb131I-1H12,从洗脱曲线上(图1)可见:131I-1H12蛋白峰出现在第3、4、5管;游离碘峰出现在第10、11、12管。标记产物进行纸层析,根据公式计算其标记率为50.14%,比活度为4.63 MBq·μg-1,其放射浓度为 77.31 MBq·ml-1,生理盐水纸层析法测定放射性化学纯度为96.92%。24、48、72 h我们测得的放射性化学纯度依次为95.33%、94.79%和91.03%,说明标记产物在体外具有较好稳定性。
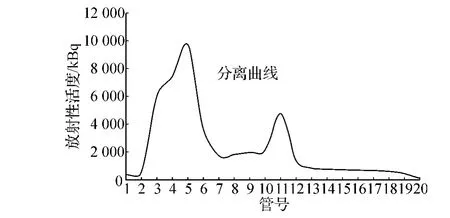
图1 洗脱曲线Fig 1 Elution curve
2.2 标记抗体131I-1H12的免疫活性
标记抗体经体外细胞结合分析显示131I-1H12与A549细胞体外结合率达61.12%,而与人脐静脉血管内皮细胞不发生特异性体外结合,其结合率仅为7.16%,和前者比差异具有统计学意义(P<0.001)。说明:(1)1H12经131I Iodogen法标记后保持有良好的免疫结合特性。(2)131I-1H12与A549细胞呈特异性结合。
2.3 131I-1H12对A549细胞的生物学作用
流式细胞仪测得A549细胞的EGFR表达率为75%。光镜下细胞形态改变[7]:倒置显微镜下见A、B、C组A549细胞不同程度变圆,胞体皱缩,细胞轮廓渐趋模糊,形态异常。有的细胞结构松散,细胞质粗糙,颗粒明显增多,出现堆积现象,多数细胞脱壁,漂浮于培养液中。而F组细胞未见有上述现象,细胞生长旺盛,有很多分裂相(图2)。流式细胞术分析各组细胞的细胞周期及凋亡(表1):通过亚G1峰检测其凋亡率分别为A组(44.35±3.31)%、B组(16.29±2.76)%、C组(9.36±2.32)%、D组(8.03±1.38)%、E组(1.51±0.79)%、F组(1.44±0.34)%,各组与 F组比较,细胞凋亡率有统计学差异,A、B、C组的凋亡率随放射性浓度增加而升高。细胞周期阻滞亦随药物剂量增加而升高,从(33.84±1.92)%升高至(51.17±2.98)%,呈明显剂量效应关系(图3、4)。A组与D组比较存在统计学差异,说明发挥肿瘤杀伤作用的是与细胞结合的131I-1H12。

图2 倒置显微镜下A549细胞形态比较Fig 2 Comparison of A549 cell morphology under inverted microscope
表1 各组细胞周期及细胞凋亡率(±s) %Tab 1 Cell cycles analysis and apoptosis rates of different sub-groups(±s) %
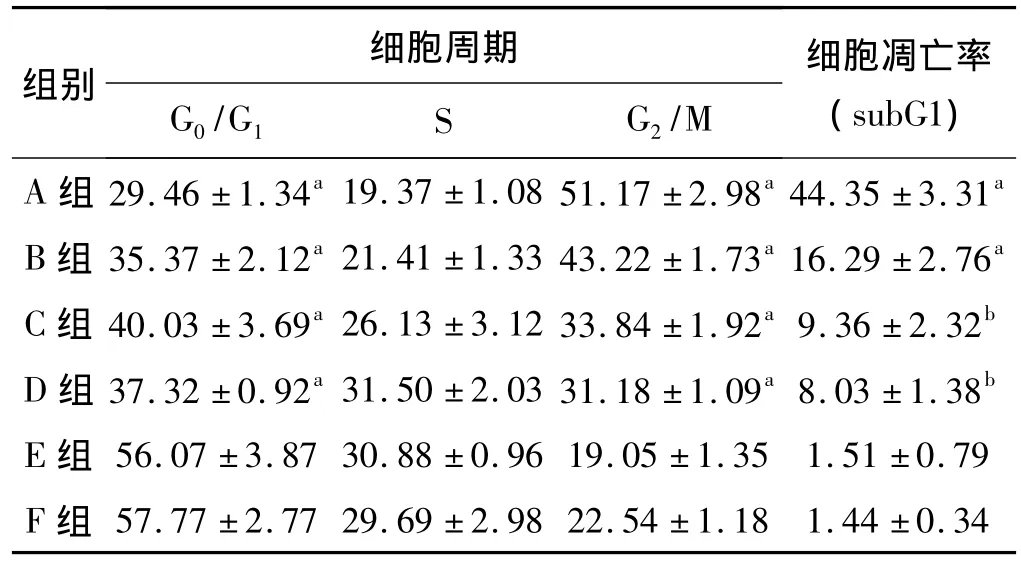
表1 各组细胞周期及细胞凋亡率(±s) %Tab 1 Cell cycles analysis and apoptosis rates of different sub-groups(±s) %
与F组相比,a P<0.01,b P<0.05;未标记的表明无统计学差异
组别细胞周期G0/G1 S G2/M细胞凋亡率(subG1)A组 29.46±1.34a19.37±1.08 51.17±2.98a44.35±3.31a 57.77±2.77 29.69±2.98 22.54±1.18 1.44±0.34 B组35.37±2.12a21.41±1.33 43.22±1.73a16.29±2.76a C组40.03±3.69a26.13±3.12 33.84±1.92a9.36±2.32b D组37.32±0.92a31.50±2.03 31.18±1.09a8.03±1.38b E组 56.07±3.87 30.88±0.96 19.05±1.35 1.51±0.79 F组

图3 各组细胞周期及凋亡柱状图Fig 3 Histogram of cell cycles and apoptosis of different sub-groups
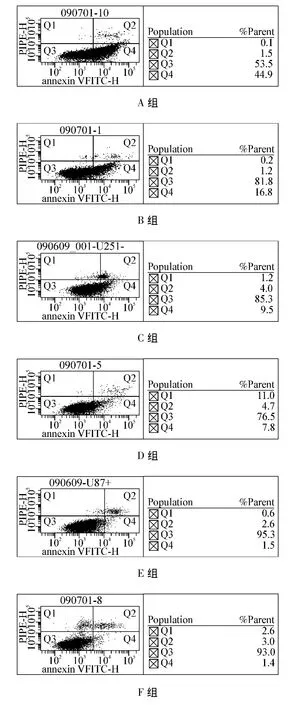
图4 各组凋亡图示例Fig 4 Examples of each group's apoptosis diagram
3 讨 论
鼠抗人EGFR McAb(1H12)系免疫球蛋白IgG,分子质量为17.5 kDa,本实验以Iodogen法对1H12进行131I标记,标记率为50.14%,放化纯度>95%,在体外稳定性良好。抗体的同位素标记技术中最重要的是要保持抗体尤其是McAb的生物、免疫学活性,否则即使标记工作做得再好也无法将标记抗体应用于下一步的实验或临床领域。我们实验结果证实抗EGFR McAb(1H12)经碘化标记以后保持原有的免疫学活性,131I-1H12能与肺癌A549细胞发生特异性结合。
已有研究表明,细胞周期的阻滞与细胞凋亡、分化密切相关,细胞通过2个限制点(G0/S期和G2/M期限制点)保证细胞的复制[8]。细胞受损时,通过激活限制点分别导致细胞的G0期或G2期延迟,使细胞有时间完成复制前和有丝分裂前的修复,以保证细胞存活;当损伤超过细胞的修复能力时,则促使细胞凋亡。为探讨131I-1H12对A549细胞的生物学效应,我们使用流式细胞术对各组A549细胞的细胞凋亡情况及细胞周期的变化进行了观察。实验结果表明,给药48 h后A、B、C组A549细胞随着药物放射性活度增强,G0/G1期细胞逐渐减少,G2/M期细胞明显增多,呈明显剂量效应关系。凋亡率也由(9.36±2.32)%升至(44.35±3.31)%,说明A549细胞抑制作用可能与G2/M期阻滞有关。C组与D组的凋亡率无统计学差异(P>0.05),说明小剂量长时间131I-1H12与大剂量短时间Na131I对A549细胞的凋亡作用相当。
有研究表明大多数非小细胞肺癌细胞EGFR能够高密度表达和(或)发生突变,而正常人肺组织EGFR表达呈阴性[1]。目前以肺癌EGFR为靶点的肿瘤靶向治疗方法较多,很多靶向药物已经开始应用于临床。我们选用高敏感性鼠抗人EGFR McAb(1H12)做了放射性碘标记的实验,并探讨了标记后的131I-1H12对EGFR表达阳性(75%)的A549细胞的生物学效应,为体内进行非小细胞肺癌EGFR为靶点的放射免疫显像及治疗奠定实验基础[9-10]。与以往单纯的抗肺癌单克隆抗体介导的放射免疫治疗相比[11-12],131I-1H12并不仅仅作为非小细胞肺癌的靶向治疗药,只要是高表达EGFR的肿瘤都能适用,且运用低剂量131I-1H12进行肿瘤EGFR的放射免疫显像,可作为其他针对EGFR的靶向治疗初筛条件[2],从而减少不必要的医疗资源消耗。虽然运用表皮生长因子(EGF)作为核素的载体,同样可以达到对肿瘤的EGFR靶向治疗的效果[13],考虑到EGF本身作为促进肿瘤生长的因素之一,其作为放射性核素载体在实际的临床应用的安全性仍将受到质疑。综上所述,无论用放射免疫显像进行肿瘤表达EGFR与否的分类和初筛,还是本身作为靶向治疗剂,放射性核素标记EGFR单克隆抗体都具有潜在而可观的应用前景[14-15]。
关于131I-EGFR McAb对体内非小细胞肺癌的相关实验,笔者将在接下来的工作中继续深入研究。相信随着研究的不断深入,必将使非小细胞肺癌的此类靶向诊断及治疗模式逐渐趋于完善。
[1]FUKUOK M,YANO S,GIACCONE G,et al.Multi-institutional randomized phaseⅡtrial of gefinitib for previously treated patients with advanced non-small-cell lung cancer[J].Clin Oncol,2003,21(12):2237.
[2]MATTES M J,GOLDENBERG D M.Therapy of human carcinoma xenografts with antibodies to EGFr and HER-2 conjugated to radionuclides emitting low-energy electrons[J].Eur J Nucl Med Mol Imaging,2008,35:1249-1258.
[3]任均田,李峰.Iodogen法碘标记McAb技术探讨[J].放射免疫学杂志,1996,9(3):145-146.
[4]FROIDEVAUX S,EBERLE A N.Somatostatin analogs and radiopeptides in cancer therapy[J].Biopolymers,2002,66:161-183.
[5]孙俊杰,范我,许玉杰,等.125I-[Tyt3]-octreotide内化及杀伤NCI-H446细胞的研究[J].中华核医学杂志,2004,24:144-146.
[6]URROWS F,ZHANG H,KAMAL A.asp90 activation and cell cycle regulation[J].Cell Cycle,2004,3(12):1530-1536.
[7]MICHEL R B,BRECHBIEL M W,MATTES M J.A comparison of 4 radionuclides conjugated to antibodies for single-cell kill[J].Nucl Med,2003,44:632-640.
[8]OSAKA M,OSHIMURA M,HO H.PI3K-Akt pathway:its functions and alterations in human cancer[J].Apoptosis,2004,9:667-676.
[9]GOLDENBERG D M,DELAND F,KIM E,et al.Use of radiolabeled antibodies to carcinoembryonic antigen for the detection and localization of diverse cancers by external photoscanning[J].N Eng J Med,1978,298:1384-1386.
[10]孙晓春,周前.几种抗人肺癌细胞单克隆抗体及其片段放射免疫显像的实验研究[J].中华核医学杂志,1997,17(1):46-48.
[11]葛棣,曾亮,葛锡锐,等.90钇标记单克隆抗体LC1对荷肺癌裸鼠局部放射免疫治疗[J].复旦学报:医学版,2003,30(2):160-163.
[12]刘黎,李少林.131I-22F7抗体对荷小细胞肺癌裸鼠体内分布及其对肿瘤的生长抑制作用[J].中华核医学杂志,2006,26(6):357-360.
[13]徐卫云,李云,春何生,等.放射性碘标记表皮生长因子核素靶向治疗乳腺癌的实验研究[J].中华外科杂志,2005,43(1):14-17.
[14]LEE S Y,HONG Y D.Radiolabeling of monoclonal antivascular endothelial growth factor receptor 1(VEGFR 1)with(177)Lu for potential use in radioimmunotherapy[J].Appl Radiat Isot,2009,67(7-8):1185-1189.
[15]STEIN R,GOVINDAN S V.Improved iodine radiolabels for monoclonal antibody therapy[J].Cancer Res,2003,163(1):111-118.
