超临界CO2流体提取复方川芎丹参中的有效成分*
2010-12-18张伟丘泰球
张伟,丘泰球
(华南理工大学轻工与食品学院,广东 广州,510640)
超临界CO2流体提取复方川芎丹参中的有效成分*
张伟,丘泰球
(华南理工大学轻工与食品学院,广东 广州,510640)
通过设计单因素和正交试验,利用高效液相色谱法(HPLC)测定复方川芎丹参中阿魏酸、川芎嗪和丹参IIA等多指标的含量进行综合评分,优选出复方川芎丹参中有效成分超临界CO2最佳提取工艺条件。结果表明:超临界CO2萃取法提取复方川芎丹参中有效成分的适宜工艺条件是,提取压力20 MPa,提取温度55℃,原料粒度为24目,夹带剂用量为0.75 mL/g。在这一条件下,阿魏酸、川芎嗪和丹参酮IIA的提取率分别可达到125.74μg/g(RSD=0.84%)、61.68μg/g(RSD=1.23%)和 131.31μg/g(RSD=0.81%)。
超临界CO2提取,高效液相色谱法(HPLC),多指标综合评分法,阿魏酸,川芎嗪,丹参酮IIA
中药川芎(Ligusticum chuanxiong Hort.)是伞形科藁本属植物,具有活血行气,祛风止痛之功效。中药丹参是唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根,具有祛瘀止痛,活血通经,清心除烦之功效[1]。川芎中主要药效成分有川芎嗪、阿魏酸、苯酞类物质[2]等,丹参中主要功效成分主要是丹参酮IIA、丹酚酸[3]等。川芎配伍丹参使二者的药效有相互协同作用[4]。
超临界 CO2萃取技术已经广泛用于精油[5-9]、抗氧化剂[10]、色素[11]、医药品[12-13]、杀虫剂[14-16]等物质的提取中,是一种无毒的绿色提取技术[17]。本文利用超临界CO2萃取技术提取复方川芎丹参中的有效成分,通过设计正交试验方案,以测定阿魏酸、川芎嗪及丹参酮IIA多指标的含量,用综合评分法优选出其提取工艺。
1 材料、试剂和设备
1.1 实验材料、试剂
川芎、丹参(广州南北行中药饮片有限公司,产地四川,质量标准符合《中华人民共和国药典》);阿魏酸对照品、盐酸川芎嗪对照品、丹参酮IIA对照品
≥98%),西安慈缘生化科技有限公司;甲醇(色谱纯),江苏永华精细化学品有限公司;冰醋酸(分析纯),成都市联合化工试剂研究所;蒸馏水,广州屈臣氏食品饮料有限公司;CO2(质量分数99.9%),广州市卓正气体有限公司。
1.2 实验设备
HL-5L/50 MPa-ⅡB型超临界萃取装置,杭州华黎泵业有限公司;Dionex高效液相色谱系统(配有P680高压泵,ASI-100自动进样器,PDA-100光电二极管阵列检测器),美国戴安公司;旋转蒸发仪(RE-52A),上海亚荣生化仪器厂;精密电子天平(FA2004),上海精科仪器厂。
2 实验方法
2.1 超临界CO2萃取复方川芎丹参有效成分单因素试验
通过预实验,发现原料粒度、提取压力、提取温度、提取时间、分离釜压力和温度等因素对复方川芎丹参有效成分提取的得率都有影响,并且在使用无水乙醇作为夹带剂时,可以显著提高有效成分的得率及缩短提取时间,所以选取原料粒度、提取压力、提取温度、提取时间和夹带剂用量作为考察因素,分离釜I、II的压力分别设为 6、5 MPa,温度分别为 35、30℃,以药物浸膏得率为指标,初步考察各因素对复方川芎丹参有效成分提取的影响。
2.1.1 原料粒度的影响
将川芎和丹参分别粉碎,选取粒径为12目、24目、40目、60目、80目的川芎和丹参,分别称取每一粒径的川芎和丹参各100 g,混合均匀,放入萃取釜进行提取,提取压力20 MPa、提取温度50℃、提取时间1.5 h,夹带剂用量200 mL。将提取物减压蒸除夹带剂,称重,计算浸膏得率。
2.1.2 提取压力的影响
分别称取100 g粉碎过40目筛的川芎和丹参粉末,混合均匀,放入萃取釜中,分别在10、15、20、25 和

表1 因素水平表
2.3 HPLC测定阿魏酸、川芎嗪含量方法[18-19]
2.3.1 色谱条件
色谱柱:DIONEX C18柱(250 mm×4.6 mm 5 μm);流动相:甲醇-1%冰醋酸(体积比90∶10);检测波长280 nm,流速:1 mL/min;柱温:35℃,进样量:10 μL。
2.3.2 对照品溶液制备
精密称取阿魏酸对照品11 mg、盐酸川芎嗪对照品5 mg,分别用甲醇溶于5 mL容量量瓶中,定容(浓度分别为2.2和1.0mg/mL),制成阿魏酸对照品和盐酸川芎嗪对照品储备液,各精密吸取1mL,加入到一个10 mL的容量瓶中,甲醇定容,制成阿魏酸和川芎嗪的混合标准品溶液(浓度分别为0.22和0.1mg/mL)。
2.3.3 线性关系
将制备好的阿魏酸和川芎嗪的混合标准品溶液用 0.22μm 微孔滤膜过滤,准确进样 2、5、10、15、20μL,按2.2.1所述方法测定,以峰面积积分值为纵坐标,进样量为横坐标,绘制标准曲线,得到阿魏酸和川芎嗪的回归方程分别为y=10.644x-8.589 4,R2=0.999 9;y=3.998 4x-7.324 5,R2=0.989。结果表明,阿魏酸和盐酸川芎嗪进样量分别在0.44~4.4 μg和0.2~2 μg内呈良好线性关系。
2.4 HPLC测定丹参酮ⅡA含量方法[20]
2.4.1 色谱条件
色谱柱:DIONEX C18柱(250 mm×4.6mm 5μm);流动相:甲醇-水(体积比 70∶30);检测波长265 nm,流速:1 mL/min;柱温:35℃,进样量:10 μL。
2.4.2 对照品溶液制备
精密称取丹参酮IIA对照品5 mg于50 mL容量瓶中,制成丹参酮IIA对照品储备液(浓度为0.1 mg/mL)。
2.4.3 线性关系
将制备好的丹参酮IIA对照品储备液用0.22μm微孔滤膜过滤,准确进样 2、5、10、15、20μL,按 2.3.1方法测定,以峰面积积分值为纵坐标,进样量为横坐标,绘制标准曲线,得到丹参酮IIA回归方程分别为y=8.827 2x-1.725 3,R2=0.999。结果表明,丹参酮ⅡA进样量在0.2~2 μg内呈良好线性关系。
2.5 样品溶液的测定
将超临界CO2提取复方川芎丹参所得的提取物减压蒸馏,除去夹带剂,用甲醇溶解转移至25 mL棕色容量瓶中,甲醇定容,制成样品储备液。精密吸取样品储备液1 mL至10 mL容量瓶中,甲醇定容,制成样品溶液,0.22μm微孔滤膜过滤,准确进样10μL,按2.3.1和2.4.1所述方法分别测定其中阿魏酸、川芎嗪和丹参酮IIA的含量。
3 结果与分析
3.1 单因素结果30 MPa压力下进行提取,提取温度50℃,其他条件同2.1.1。将提取物减压蒸除夹带剂,称重,计算浸膏得率。
2.1.3 提取温度的影响
分别称取100 g粉碎过40目筛的川芎和丹参粉末,混合均匀,放入萃取釜中,分别在 30、40、50、60 和70℃的提取温度在进行提取,提取压力20 MPa,其他条件同2.1.1。将提取物减压蒸除夹带剂,称重,计算浸膏得率。
2.1.4 提取时间的影响
分别称取100 g粉碎过40目筛的川芎和丹参粉末,混合均匀,放入萃取釜中分别提取0.5、1、1.5、2.0和2.5 h,其他条件同2.1.1。将提取物减压蒸除夹带剂,称重,计算浸膏得率。
2.1.5 夹带剂用量的影响
分别称取100 g粉碎过40目筛的川芎和丹参粉末,混合均匀,放入萃取釜中,分别按 0.25、0.5、0.75、1.0和1.25 mL/g加入夹带剂无水乙醇进行提取,其他条件同2.1.1。将提取物减压蒸除夹带剂,称重,计算浸膏得率。
2.2 超临界CO2萃取复方川芎丹参有效成分正交试验
在单因素实验基础上,按表1设计提取试验的因素水平表。选L9(34)正交表对复方川芎丹参有效成分进行超临界萃取。分别称取100g粉碎过筛的川芎和丹参药材,混合均匀,放入超临界CO2萃取装置中萃取2 h,利用HPLC法测定萃取物中阿魏酸、川芎嗪和丹参酮IIA的含量。以阿魏酸、川芎嗪和丹参酮IIA含量为评价指标,采用综合评分法进行数据分析(其权重系数分别为阿魏酸:0.35,川芎嗪:0.35,丹参酮IIA:0.3)。
3.1.1 原料粒度的影响

图1 原料粒度对复方川芎丹参浸膏得率的影响
从图1中可以看出,在粒度<60目,复方川芎丹参浸膏的得率随着原料粒径的减小而增大,而当粒度上升到80目时,浸膏的得率呈下降趋势。这是因为在一定范围内,原料的粒径变小,细胞壁被破坏的程度增大,整个原料的颗粒被溶剂浸润的时间缩短,有效成分溶剂化的速度和扩散速度则自然加快,同时粒径减小也增加了超临界CO2与原料的接触面积和提取通道,从而有利于提高提取率,但并不是原料的粒径越小越好,原料过细,虽然此时对原料细胞壁的破坏更加彻底,但却增加了原料的堆积密度,通透性变差,致使超临界CO2只能沿着阻力小的线路穿过料层,形成许多针孔,使提取显著不均匀。同时,颗粒太细,不仅会导致流路堵塞,使提取柱柱压过高,而且还会造成原料结块,提取不利,因此,提取过程中原料的粒径应该适当,故选择颗粒粒径为40~60目。
3.1.2 提取压力的影响
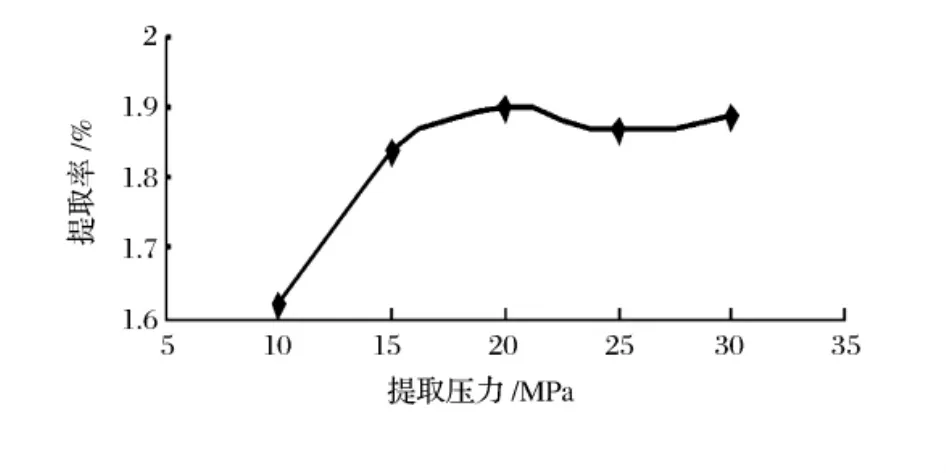
图2 提取压力对复方川芎丹参浸膏得率的影响
从图2中可以看出,随着提取压力的增大,复方川芎丹参浸膏得率也增大,这是因为提取压力的升高意味着超临界CO2密度的增加。当压力超过20 MPa后,再增大萃取压力,浸膏得率增加的速度已经放缓。虽然提取压力越大,浸膏得率越高,然而压力增加,生产成本也增加,而且压力过高还会增加不安全因素,因此最终选择提取压力为20 MPa。
3.1.3 提取温度的影响

图3 提取温度对复方川芎丹参浸膏得率的影响
从图3中可以看出,当提取温度从30℃升高50℃时,复方川芎丹参浸膏得率呈上升趋势,当提取温度>50℃后浸膏得率呈下降趋势。这是因为温度对萃取效果的影响主要体现在2个方面:(1)温度升高时,溶质的蒸汽压升高,且分子热运动加快,扩散性加强,因此增强了传质;(2)在一定压力下升高温度,萃取剂CO2的密度降低,溶解能力下降。因此,提取温度选择40~50℃较为合适。
3.1.4 提取时间的影响

图4 提取时间对复方川芎丹参浸膏得率的影响
图4 结果表明,随着提取时间的延长,浸膏得率也相应的增加,但其浸膏得率的曲线斜率是逐渐减小的,以至最后趋于平缓。从工艺和生产而言,也不应用延长时间来提高生产率。因此较佳提取时间为1.5 ~2 h。
3.1.5 夹带剂用量的影响

图5 夹带剂用量对复方川芎丹参浸膏得率的影响
图5结果表明,复方川芎丹参浸膏得率随着夹带剂用量的增大而迅速增大,但当萃取剂用量>1.0 mL/g后,夹带剂用量的增加对萃取率的增强效果已经开始放缓,因此选择夹带剂用量为0.75~1.0 mL/g。
超临界CO2是非极性物质,当提取阿魏酸等极性物质时,需要在高压下才能使之溶解,且效果不明显。乙醇无毒,是功能食品及药物加工过程中唯一允许使用的有机试剂,通过引入无水乙醇作为夹带剂,不单可以增加超临界流体的密度,而且其分子质量小,在基体中扩散、渗透能力强,能够与溶质发生氢键缔合作用,促使其脱离基体,提高超临界流体的溶解效果,因此在加入了夹带剂后,极大地提高了极性物质的提取效果。
3.2 正交试验结果和极差分析

表2 正交试验结果
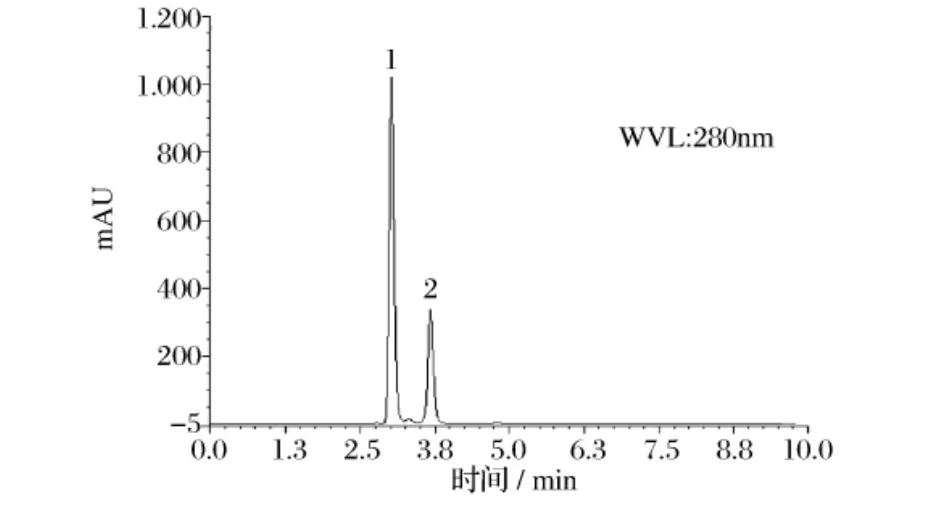
图6 阿魏酸(1)、川芎嗪(2)对照品HPLC图
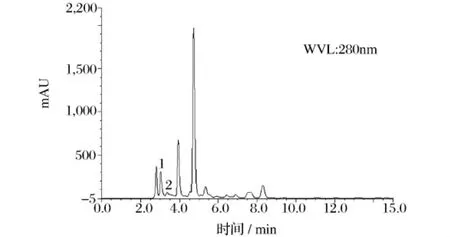
图7 样品HPLC图(1:阿魏酸,2:川芎嗪)
川芎、丹参两味中药在中医临床上多同时广泛用于治疗心脑血管疾病[21],而川芎嗪、阿魏酸和丹参酮ⅡA、丹参素等都是主要的药效成分[22-23],根据文献[23]分别观察了丹参酮ⅡA、丹参素、川芎嗪和阿魏酸对ADP诱导大鼠和人血小板聚集的影响,4种成分抑制血小板聚集的相互作用类型为协同作用,4种成分的配比关系为24.8、37.6、25.0和25.3 mg/mL。但由于实验条件和科研经费所限,笔者不能对所有药效成分一一测定和评定,综合考虑,在综合评分中选取川芎嗪、阿魏酸和丹参酮ⅡA3种化合物的权重系数分别为0.35、0.35和0.30。
由正交表可以明显看出,各因素作用主次为A>D>C>B,即提取压力>夹带剂用量>原料粒度>提取温度。并且最优提取组合为A2B3C1D2,即提取压力为20 MPa,提取温度55℃,原料粒度为24目,夹带剂用量为0.75 mL/g。
3.3 HPLC测定阿魏酸、川芎嗪和丹参IIA含量结果
按2.2.1和2.3.1所述方法和条件进行测定,得到阿魏酸、川芎嗪和丹参酮IIA对照品及样品的HPLC图(图6~图9)。
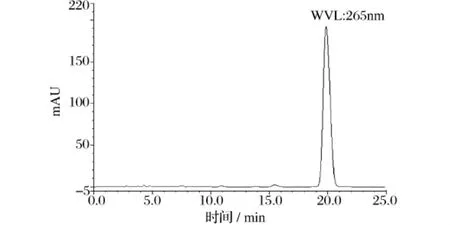
图8 丹参酮IIA对照品HPL C图
图9 样品HPLC图(丹参酮IIA)
4 结论
利用超临界CO2提取复方川芎丹参中有效成分是一种经济有效的方法,其最佳提取工艺为提取压力为20 MPa,提取温度55℃,原料粒度为24目,夹带剂用量为0.75 mL/g。在此条件下对复方川芎丹参重复3次提取,对提取物依法测定,得阿魏酸、川芎嗪和丹参酮 IIA提取率分别为 125.74 μg/g(RSD=0.84%)、61.68 μg/g(RSD=1.23%)和 131.31 μg/g(RSD=0.81%)。
本文采用HPLC法对提取物中阿魏酸、川芎嗪和丹参酮IIA等多指标的含量进行测定,这样能对提取物的质量进行综合评定。
[1] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2005:28-52.
[2] Ru Yana,Song Linlia,Chung Hoising.Simultaneous quantification of 12 bioactive components of Ligusticum chuanxiong Hort.by high-performance liquid chromatography[J].Journal of Pharmaceutical and Biomedical Analysis,2005,37:87-95.
[3] 赵小亮,雷浩东,张继.丹参有效成分提取的研究概述[J].安徽农业科学,2007,35(6):1 795-1 796.
[4] 郭冬,刘珍,张恩户.丹参酮IIA、丹参素、川芎嗪和阿魏酸抑制血小板聚集的相互作用类型及配比关系研究[J].陕西中医,2007 ,28(6):743-745.
[5] Rodrigues V M,Tosa P T V,Marques M O M,et al.Supercritical extraction of essential oil from Aniseed(Pimpinella anisum L.)using CO2:solubility,kinetics and composition data[J],J Agric Food Chem.,2003,51:1 518 -1 523.
[6] Porta G Della,Taddeo R,UrsoE D,et al.Isolation of clovebud and star anise essential oil by supercritical CO2extraction[J],Lebensm Wiss U Technol,1998,31:454 –460.
[7] Monteiro A R,Meireles M A,Marques M O M,et al.Extraction of the soluble material from the shells of the bacuri fruit(Platonia insignis Mart)with pressurized CO2and other solvents[J].J Supercrit Fluids,1997,11:91 - 102.
[8] Rozzi N L,Phippen W,Simon J E.Supercritical fluid extraction of essential oil components from lemon-scented botanicals[J].Lebensm Wiss U Technol,2002,35:319 -324.
[9] Carlson L H C,Machado R A F,Spricigo C B,et al.Extraction of lemongrass essential oil with dense carbon dioxide[J].J Supercrit Fluids,2001,21:33 -39.
[10] Ibanez E,Oca A,Murga G De,et al.Supercritical fluid extraction and fractionation of different preprocessed rosemary plants[J],J Agric Food Chem,1999,47:1 400 -1 404.
[11] Vagi E,Simandi B,Daood H G,et al.Recovery of pigments from Origanum majorana L.by extraction with supercritical carbon dioxide[J].J Agric Food Chem,2002,50:2 297-2 301.
[12] Catchpole O J,Perry N B ,Dasilva B M T,et al.Supercritical extraction of herbs and Echinacea[J].J Supercrit Fluids,2002,22:129 - 138.
[13] Rompp H,Seger C,Kaiser C S,et al.Enrichment of Hyperforin from St.John’s Wort(Hypericum perforatum)by pilotscale supercritical carbon dioxide extraction[J].Eur J Pharm Sci,2004,21,443 -451.
[14] Quan C,Li S,Tian S,et al.Supercritical fluid extraction and clean-up of organochlorine pesticides in ginseng[J]J Supercrit Fluids,2004,31:149 -157.
[15] Porta G Della,Reverchon E.Fourth International Symposium on High Pressure Process Technology and Chemical Engineering[M].Italy:Venice,2002:223.
[16] Kiriamiti H K,Camy S,Gourdon C,et al.Pyrethrin extraction from pyrethrum flowers using carbon dioxide[J].J Supercrit Fluids,2003,26:193 -200.
[17] Reverchon Ernesto,Iolanda,Marco De.Supercritical fluid extraction and fractionation of natural matter[J].J of Supercritical Fluids,2006,38:146 -166.
[18] 宋金春,王杨杨,杨鹤,等.高效液相色谱法同时测定古方生化汤中阿魏酸和川芎嗪的含量[J].中国医院药学杂志,2004,24(7):419 -420.
[19] 杨宁莲,杨文远,杨振红,等.高效液相色谱法测定生化汤口服液中阿魏酸含量[J].中国医院药学杂志,1999,19(2):88.
[20] 国家药典委员会,中华人民共和国药典[M].北京:化学工业出版社,2005:72.
[21] 李晓莉,李晓蓉,王丽娟,等.RP-HPLC测定丹芎方中丹参素、阿魏酸、隐丹参酮和丹参酮ⅡA的含量[J].中成药,2008,30(1):77 -80.
[22] 冯彬彬,张建海,张继芬,等,川芎嗪、阿魏酸及其配伍药代动力学比较研究[J].中国中药杂志,2010,35(7):900-903.
[23] 郭冬,刘珍,张恩户.丹参酮ⅡA、丹参素、川芎嗪和阿魏酸抑制血小板聚集的相互作用类型及配比关系研究[J].陕西中医,2007,28(6):743 -745.
Optimization of the Extraction for Effective Ingredients from Ligusticum chuanxiong Hort.and Salvia miltiorrhiza Bge.with Supercritical CO2
Zhang Wei,Qiu Tai-qiu
(College of Light Industry and Food Science,South Univesity of Technology,Guangzhou 510640,China)
To optimize the extraction for effective ingredients from Ligusticum chuanxiong Hort.and Salvia miltiorrhiza Bge.by Supercritical CO2extraction,single factor experiments and orthogonal test,Multi-index comprehensive evaluation were performed.The content of the interest compounds(ferulic acid,tetramethylpyrazine and Tanshinone IIA)was measured by HPLC.It showed that the optimal extraction conditions were:extraction pressure 20 MPa,extraction temperature 55℃,Granularity size of raw materials were 24 mush,solvent dosage 0.75 mL/g.The yield of ferulic acid,tetramethylpyrazine and Tanshinone IIA was 125.74 μg/g(RSD=0.84%),61.68 μg/g(RSD=1.23%)and 131.31 μg/g(RSD=0.81%)respectively.
supercritical carbon dioxide extraction,high performance liquid chromatography(HPLC),multi-index comprehensive evaluation,ferulic acid,tetramethylpyrazine,tanshinone IIA
硕士研究生(丘泰球博士为通讯作者,E-mail:tqqiu@scut.edu.cn)。
*广东省科技计划项目(2009A030100007)
2010-02-02,改回日期:2010-09-06
