辛伐他汀对慢性心力衰竭兔心肌PPARγ mRNA、蛋白表达及核因子κB表达、活性的影响
2010-12-14齐洪涛刘志华赵彩明李红霞韩莲花蒋庭波宋建平蒋文平
齐洪涛,刘志华,蒋 彬,邹 操,赵彩明,李红霞,韩莲花,蒋庭波,宋建平,蒋文平
(1.苏州大学附属第一医院心内科,江苏苏州 215006;2.青岛大学第二附属医院心功能科,山东青岛 266042)
过氧化物酶体增殖物激活受体(peroxisome proliferators activated receptor,PPAR)是核甾体激素受体,能被脂肪酸以及外源性过氧化体增殖物激活剂激活,调控参与脂类代谢的某些酶的基因表达[1],同时PPARs的激活对一些细胞的生长、分化、凋亡有重要影响[2]。最近的研究显示PPARγ对心肌肥厚具有抑制作用,PPARγ激活能改善左室重构和恢复心功能,抑制心肌细胞肥大和纤维化。PPARγ灭活,导致心肌肥厚。PPARγ对心室重构的影响,主要与降低核因子 κB(nuclear factor kappa B,NF-κB)的活性有关。NF-κB是一种具有基因转录多向调控作用的核转录因子,在心肌肥厚、心肌细胞凋亡、心力衰竭的发生中,NF-κB发挥重要作用,NF-κB的过分表达导致心肌细胞肥大。近期研究证明,PPARγ对NF-κB有负向调节关系[3],他汀类药物对PPARγ有激活作用,并通过激活PPARγ抑制NF-κB活性,抑制心肌肥厚[4,5]。本研究观察了辛伐他汀对PPARγ mRNA及蛋白表达的影响,及辛伐他汀对NF-κB亚基p65蛋白表达及活性的影响。
1 材料与方法
1.1 实验动物 24只新西兰白兔均来自苏州大学实验动物中心,♀♂不拘,体重1.8~2.8 kg,分为4组,每组6只,1组:假手术组;2组:心衰对照组,术后观察8 wk。3组:早干预组,手术后给予辛伐他汀(Merck Sharp&Dohme Ltd产品,杭州默沙东公司分装)5 mg·kg-1·d-1,采用灌胃方法给药,连续服8 wk。4组:晚干预组,术后4 wk给予辛伐他汀5 mg·kg-1·d-1,灌胃方法给药,连续4 wk。
1.2 心脏前后负荷增加模型制作 通过破坏主动脉瓣造成主动脉瓣返流,2 wk后实施腹主动脉缩窄术,制作前、后符合增加心力衰竭模型[6]。心脏超声检查:于主动脉瓣破坏后及观察结束时,做心脏超声检查,用12 Hz专用探头,做M超及彩色多普勒超声,观察左心室内径及室壁厚度、左室射血分数(EF)、左室长轴缩短率(FS),破瓣后主动脉瓣返流情况。实验观察终止时,再次手术,分离另一侧颈总动脉,测量左室舒张末压。取出心脏称全心及左室重量,计算心脏重量/体重、左室重量/体重。左心室组织放液氮中储存。
1.3 测定蛋白浓度 用德国Merck KgaA ProteoExtract®Subcellular proteome Extraction Kit提取心肌组织细胞核蛋白。Bradford蛋白浓度测定试剂盒(上海西唐生物科技有限公司)测定蛋白浓度。
1.4 Western blot检测细胞核PPARγ、p65蛋白表达 PPARγ、p65蛋白分子量均为65 ku,配制10%分离胶。胶凝固后,配制5%的浓缩胶。分别取80 μg细胞膜蛋白加5×上样缓冲液2 μl,沸水变性5 min。将样品蛋白及预染蛋白Marker加入上样孔,电泳、转膜。免疫反应:用封闭液稀释一抗到要求浓度,抗 PPARγ(5 mg·L-1),抗 p65(10 mg·L-1),抗β-actin(1∶500)。将膜放入一抗稀释液中,4℃孵育过夜。将膜放入二抗稀释液,室温下在摇床上孵育1 h。化学发光,显影,定影。图像分析用扫描仪将X光片图像扫至电脑,用UVIDoc软件进行条带灰度分析,计算每标本PPARγ、p65与β-actin灰度比。
1.5 RT-PCR检测心肌组织PPARγ mRNA表达每一标本取100 mg心肌组织,用TRIzol提取mRNA,室温干燥,测A260/A280值。用美国Fermentas逆转录试剂盒做逆转录。扩增:将PCR管置于冰上,建立下列反应体系:10 × buffer 2.5 μl,MgCl22 μl,Tag 酶 0.25 μl,dNTP 0.5 μl,10 mmol·L-1引物(S)0.625 μl,10 mmol·L-1(A)0.625 μl,模板 2 μl,加DEPC 水至25 μl。引物:PPARγ 上游:5′-TTCCTGTCAAGATCGCCCTCG-3′;下 游:5′-TGGGGATGTCTCATAATGCCA-3′。β-actin 上游:5′-GTGCTGTCCCTGTACGCCTCTGG-3′;下游:5′-CTTCTCCTTGATGTCCCGCACGAT-3′。扩增条件为94℃预变性4 min,然后,94℃变性 1 min,55℃退火1 min,72℃延长1 min 20 s,35个循环,72℃延伸10 min。电泳及图像分析:用Bio Rad凝胶成像系统quantity one软件分析条带灰度,计算每一样本PPARγ mRNA灰度与βactin mRNA灰度比。
1.6 电泳迁移率变动试验(EMSA)检测心肌细胞核p65活性 用Subcellular proteome Extraction Kit(Merck KgaA ProteoExtract®,German)提取细胞核蛋白。用含NF-κB核苷酸同序列(5′-AGTTGAGGGGACTTTCCCAGGC-3′)结合位点的寡核苷酸完成电泳迁移率变动试验。在下列反应中完成寡核苷酸标记:2 μl寡核苷酸(1.75 pmol/Al),2 μl T4 多核苷酸激酶缓冲液,1 μl T4多核苷酸激酶(10 U/Al),2.5 μl[γ-32P]ATP(185 TBq/mmol at 370 MBq/ml),37℃孵育1 h。加入90 μl TE 缓冲液(10 mmol·L-1Tris-HCl pH 7.4 and 1 mmol·L-1EDTA)。10 μg核蛋白在冰上加入缓冲液(10 mmol·L-1Tris-HCl pH 8.0,25 mmol·L-1KCl,0.5 mmol·L-1DTT,0.1 mmol·L-1EDTA pH 8.0,5%glycerol,5 g·L-1BSA,100 mg·L-1tRNA and 50 mg·L-1poly(dI-dC)),反应 10 min,然后加入 15 μl标记探针(约60.000 cpm),4℃孵育15 min。同时完成特异性竞争试验。在标记探针加入前先加入未标记同序列竞争核苷酸。在标记探针4℃孵育前加入p65抗体,然后将蛋白-DNA复合物4℃ 5%的聚丙酰胺电泳,将胶放在滤纸上,干燥后,用磷屏压胶1 h,用磷屏扫描仪检测32P放射量,扫描磷屏,用ImageQuant软件分析各标本图像中32P放射量。
2 结果
2.1 4组心脏、左心室重量及心脏/体重、左心室/体重比较 心力衰竭对照组心脏重量、左心室重量、心脏重量指数、左心室重量指数均大于假手术组,早干预组上述指标均低于心力衰竭对照组,晚干预组心脏重量、左心室重量、心脏重量指数低于心力衰竭对照组,见Tab 1。
2.2 4组观察开始及结束时左室最大舒张压比较实验开始时,各组左室舒张末压(LVEP)无差异。实验终止时,心衰对照组高于假手术组,早、晚干预组LVEP均低于心衰对照组,见Tab 2。
Tab 2 Change after heart failure and effect of simvastatin on LVEDP±s,n=6)

Tab 2 Change after heart failure and effect of simvastatin on LVEDP±s,n=6)
**P<0.01 vs groupⅡ;ΔΔP<0.01 vs groupⅠ
GroupⅠ GroupⅡ GroupⅢ GroupⅣbegin of experiment -2.50±1.41 -3.00±1.65 -2.00±0.63 -2.50±1.52 end of experiment -0.50±1.34** 14.00±2.67ΔΔ 0.33±1.97**2.33±1.89**
2.3 4组心肌组织PPARγ mRNA表达比较 与假手术组比较,心力衰竭组PPARγ mRNA表达降低,辛伐他汀干预后,PPARγ mRNA表达明显增加,且早干预组表达增加比晚干预组更加明显,见Tab 3及Fig 1。
Tab 3 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear PPARγ mRNA expression(±s,n=6)

Tab 3 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear PPARγ mRNA expression(±s,n=6)
**P<0.01 vs groupⅠ;△△P<0.01 vs groupⅡ;#P<0.05 vs groupⅣ
GroupⅠ GroupⅡ GroupⅢ GroupⅣPPARγ mRNA 0.720±0.018 0.308±0.010**0.522±0.009△△#0.448±0.024△△
2.4 4组心肌组织细胞核PPARγ蛋白表达的比较
心衰组PPARγ表达低于健康对照组,经辛伐他汀治疗后,早干预组及晚干预组PPARγ蛋白表达增加(P<0.01,P<0.01)。早干预组PPARγ蛋白表达比晚干预组增加明显,但差异无统计学意义,见Tab 4,Fig 2。
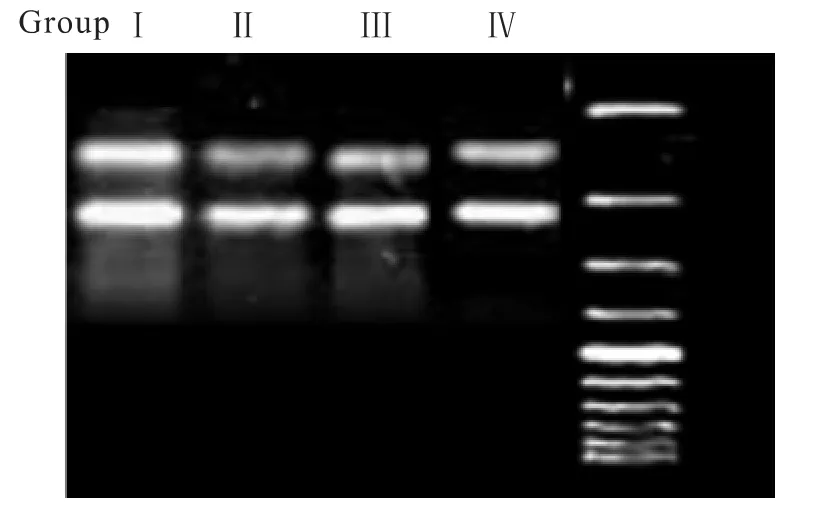
Fig 1 RT-PCR of cardiomyocyte nuclear PPARγ mRNA expression in four groups(n=6)
Tab 4 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear PPARγ protein expression(±s,n=6)

Tab 4 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear PPARγ protein expression(±s,n=6)
**P<0.01 vs groupⅠ;△△P<0.01 vs groupⅡ
GroupⅠ GroupⅡ GroupⅢ GroupⅣPPARγ protein 0.819±0.038 0.403±0.016**0.638±0.017△△0.587±0.021△△

Fig 2 Western Blot of cardiomyocyte nuclear PPARγ protein expression in four groups(n=6)
2.5 4组心肌组织细胞核NF-κB亚基p65蛋白表达的比较 心力衰竭组心肌细胞和中p65表达明显增加,辛伐他汀干预后p65表达降低,早干预组表达比晚干预组降低更明显,但未达到统计学意义,见Tab 5,Fig 3。
Tab 5 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear p65 protein expression( ± s,n=6)

Tab 5 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear p65 protein expression( ± s,n=6)
**P<0.01 vs groupⅠ;△△P<0.01 vs groupⅡ
GroupⅠ GroupⅡ GroupⅢ GroupⅣp65 0.417±0.013 0.715±0.038**0.491±0.015△△0.537±0.032△△
Tab 1Changes after heart failure and effects of simvastatin on HW,LVW,HW/BW radio and LVW/BW(±s,n=6)
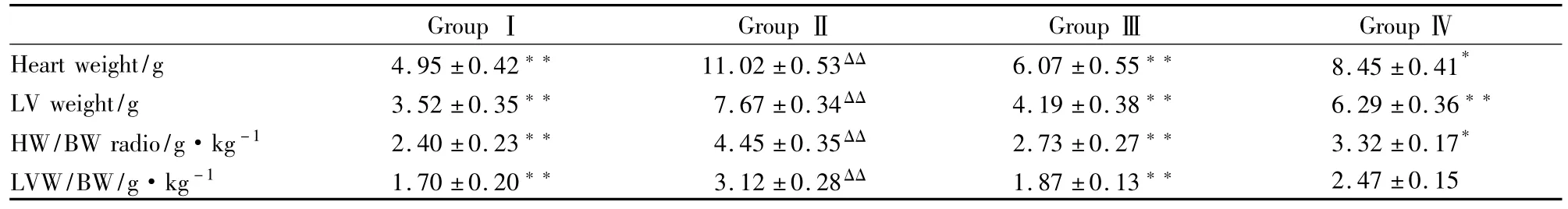
Tab 1Changes after heart failure and effects of simvastatin on HW,LVW,HW/BW radio and LVW/BW(±s,n=6)
*P<0.05,**P <0.01 vs groupⅡ;ΔΔP<0.01 vs groupⅠ
GroupⅠ GroupⅡ GroupⅢ GroupⅣHeart weight/g 4.95±0.42** 11.02±0.53ΔΔ 6.07±0.55** 8.45±0.41*LV weight/g 3.52±0.35** 7.67±0.34ΔΔ 4.19±0.38** 6.29±0.36**HW/BW radio/g·kg-1 2.40±0.23** 4.45±0.35ΔΔ 2.73±0.27** 3.32±0.17*LVW/BW/g·kg-1 1.70±0.20** 3.12±0.28ΔΔ 1.87±0.13**2.47±0.15
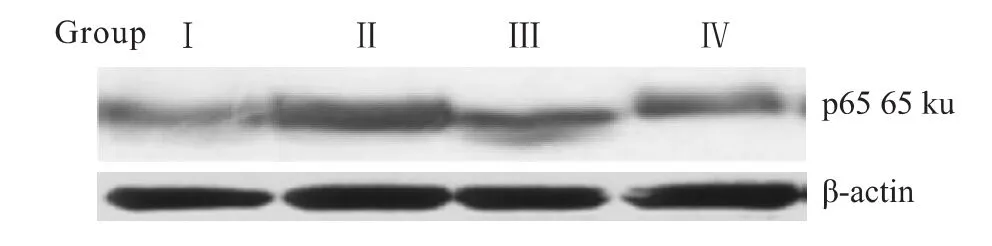
Fig 3 Western Blot of cardiomyocyte nuclear p65 protein expression in four groups(n=6)The p65 protein expression of cardiomyocyte nuclear was increased in failure heart(groupⅡ),simvastatin inhibited the p65 protein expression of cardiomyocyte nuclear(groupⅢ,groupⅣ)
2.6 4组心肌组织细胞核NF-κB亚基p65活性比较 心力衰竭组心肌细胞核p65活性明显增强,给予辛伐他汀干预后p65活性明显降低,早干预组表达降低比晚干预组更加明显,见Tab 6,Fig 4。
Tab 6 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear p65 activity(±s,n=6)
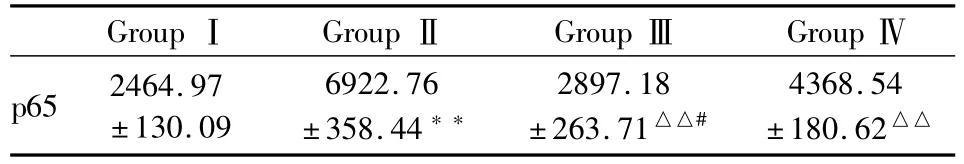
Tab 6 Change after heart failure and effect of simvastatin on cardiomyocyte nuclear p65 activity(±s,n=6)
**P<0.01 vs groupⅠ;△△P<0.01 vs groupⅡ;#P<0.05 vs groupⅣ
GroupⅠ GroupⅡ GroupⅢ GroupⅣp65 2464.97±130.09 6922.76±358.44**2897.18±263.71△△#4368.54±180.62△△

Fig 4 EMSA of cardiomyocyte nuclear p65 activity in four groups(n=6)The p65 activity of cardiomyocyte nuclear was increased in failure heart(groupⅡ),simvastatin inhibited the p65 activity of cardiomyocyte nuclear(groupⅢ,groupⅣ)
3 讨论
成年心脏心肌代谢主要依靠线粒体氧化长链脂肪酸,参与脂肪氧化酶的基因受PPARs调节[7]。最近的研究发现,心肌肥厚与心肌代谢发生改变、脂肪氧化减少,葡萄糖氧化增加有关,而这样的代谢为胎儿心肌的代谢特点。这一变化被认为是为减少耗氧而发生的适应性反应,但因受损的脂肪酸氧化而导致脂质在心脏沉积,并导致心肌肥厚[8]。
许多研究显示PPARγ对心肌肥厚、心肌纤维化具有抑制作用,抑制细胞表面积增大及心肌肥厚相关基因的表达。抑制心肌肥厚及间质纤维化,改善心肌重构。Yuan等[9]在大鼠中研究显示,PPARγ抑制心肌细胞增长、胚胎基因表达,并抑制NF-κB的活性。Yamamoto等[10]在研究中也发现,PPARγ激活抑制NF-κB激活,抑制心肌肥厚发生。
核因子-κB(nuclear factor kappa B,NF-κB)是一种具有基因转录多向调控作用的核转录因子,NF-κB存在于血管内皮细胞、血管平滑肌细胞及心肌细胞,在心肌肥厚、心肌细胞凋亡、心力衰竭的发生中,发挥重要作用[11]。内分泌-细胞因子引起的心室重构、心室肥厚的信号通路最终都经过NF-κB[12]。
近期研究证明[13],他汀类药物对抑制心室重构,改善心功能有重要作用,其机制与激活PPARγ[14,15],抑制 NF-κB 活性有关。Delerive 等[15]在研究中发现,PPARα与NF-κB亚单位p65第12-317号氨基酸有弱的相互作用,通过蛋白-蛋白作用,PPARα 对 NF-κB 产生抑制作用。Planavila等[16]研究也发现,在压力负荷增加导致的心肌肥厚过程中,Atorvastatin干预抑制了NF-κB激活,并防止了PPARs蛋白表达降低,抑制心肌肥厚的发生。
与以往研究结果相似[5,15],本研究结果显示在压力负荷及容量负荷增加导致的心力衰竭心肌组织中,心肌细胞核PPARγ蛋白表达较假手术组明显减少,RT-PCR分析显示心力衰竭心肌组织细胞核中PPARγ mRNA表达降低,而心肌细胞核NF-κB亚基p65蛋白表达增加,电泳移动转变分析(EMSA)显示,心力衰竭心肌组织中,p65活性较健康对照明显增强。表明PPARγ表达减少,对心肌肥厚的抑制作用减弱,导致心肌肥厚发生,p65表达增加、活性增强是心肌肥厚的重要原因,PPARγ与p65存在负向调节关系。辛伐他汀干预后 PPARγ mRNA、蛋白表达增加,细胞核p65表达减少,活性降低,表明辛伐他汀通过调节转录,提高PPARγ表达,PPARγ表达增加抑制p65表达及活性,从而对心肌肥厚产生影响。比较早干预组与晚干预组发现,早干预使PPARγ mRNA表达增加比晚干预组更加明显,且早干预组对p65活性抑制比晚干预组更强。
[1]Schoonjans K,Martin G,Staels Auwerx J.Peroxisome proliferatoractivated receptors,orphans with ligands and functions[J].Curr Opin Lipidol,1997,8(3):159-66.
[2]Chawla A,Repa J J,Evans R M,et al.Nuclear receptors and lipid physiology:opening the X-files[J].Science,2001,294(5548):1866-70.
[3]Purcell N H,Tang G L,Yu C F,et al.Activation of NF-kappa B is required for hypertrophic growth of primary rat neonatal ventricular cardiomyocytes[J].Proc Natl Acad Sci USA,2001,98(12):6668-73.
[4]Higuchi Y,Otsu K,Nishida S,et al.Involvement of reactive oxygen species-mediated NF-kappa B activation in TNF-alpha-induced cardiomyocyte hypertrophy[J].J Mol Cell Cardiol,2002,34(2):233-40.
[5]Asakawa M,Takano H,Nagai T,et al.Perexisome proliferator-activated receptor γ plays a critical role in inhibition of cardiac hypertrophyin vitroandin vivo[J].Circulation,2002,105(10):1240-46.
[6]邹 操,刘志华,赵彩明,等.超容量负荷联合压力负荷制备家兔心衰模型的可行性探讨[J].实验动物与比较医学,2005,4(25):248-54.
[6]Zou C,Liu Z H,Zhao C M,et al.A model of heart failure induced by volume plus pressure overload in rabbits[J].Lab Anim Comp Med,2005,4(25):248-54.
[7]Tian Q,Barger P M.Deranged energy substrate metabolism in the failing heart[J].Curr Hypertens Rep,2006,8(6):465-71.
[8]Barger P M,Brandt J M,Leone T C,et al.Deactivation of peroxisome proliferator-activated receptor-alpha during cardiac hypertrophic growth[J].J Clin Invest,2000,105(12):1723-30.
[9]Yuan Z,Liu Y,Liu Y,et al.Cardioprotective effects of peroxisome proliferator activated receptor γ activators on acute myocarditis:anti-inflammatory actions associated with nuclear factor kB blockade[J].Heart,2005,91(9):1203-8.
[10]Yamamoto K,Ohki R,Lee R,et al.Peroxisome proliferator-activated receptorγ activators inhibit cardiac hypertrophy in cardiac myocytes[J].Circulation,2001,104(14):1670-5.
[11]Hirotani S,Otsu K,Nishida K,et al.Involvement of nuclear factor-Kappa B and apoptosis signal-regulating kinase 1 in G-proteincoupled receptor agonist-induced cardiomyocyte hypertrophy[J].Circulation,2002,105(4):509-15.
[12]Li Y,Ha T,Gao X,et al.NF-κB activation is required for the development of cardiac hypertrophyin vivo[J].Am J Physiol Heart Circ Physiol,2004,287(4):H1712-20.
[13]胥雪莲,覃 数,雷 寒,等.辛伐他汀改善大鼠心肌梗死后心室重塑与 p-ERK1/2的关系[J].中国药理学通报,2008,24(2):258-61.
[13]Xu X L,Qin S,Lei H,et al.Simvastatin ameliorates rat ventricular remodeling after myocardial infarction:the role of phosphorylating extracellular signal-regulated kinase1/2[J].Chin Pharmacol Bull,2008,24(2):258-61.
[14]Planavila A,Laguna J C,Väzquez-Carrera M.Atorvastatin improves peroxisome proliferator-activated receptor signaling in cardiac hypertrophy preventing nuclear factor-κB activation[J].Biochim Biophys Acta,2005,1687(1-3):76-83.
[15]Delerive P,De Bosscher K,Sandrine B,et al.Peroxisome proliferator-activated receptor a negatively regulates the vascular inflammatory gene response by negatively regulates the vascular inflammatory gene response by negative cross-talk with transcription factors NF-κB and AP-1[J].J Biol Chem,1999,5274(45):32048-54.
[16]Planavila A,Rodriguez-Calvo R,Jove M,et al.Peroxisome proliferator-activated receptor beta/delta activation inhibits hypertrophy in neonatal rat cardiomyocytes[J].Cardiovasc Res,2005,65(4):832-41.
