IGF-II在原核生物中的表达*
2010-12-12王庆忠任科云
王庆忠,任科云
(潍坊学院,山东 潍坊 261061)
IGF-II在原核生物中的表达*
王庆忠,任科云
(潍坊学院,山东 潍坊 261061)
胰岛素生长因子IGF-Ⅰ和 IGF-Ⅱ在机体的许多组织中都有表达,具有促进细胞生长和分裂等的多种生物学功能。在本研究中,我们采用RT-PCR法克隆和扩增到了IGF-Ⅱ基因,通过双酶切、胶回收纯化、连接后得到了p ET21b-IGF-Ⅱ重组质粒载体,然后将其转化DH5α中,经IPTG诱导后表达的重组蛋白经纯化,并用Western blot检测,显示重组质粒p ET21b-IGF-Ⅱ编码一个约25kD的外源蛋白。
IGF-Ⅱ;RT-PCR;原核表达载体;表达
胰岛素样生长因子(insulin-like grow th factors,IGFs)是一类既有细胞分化和增殖活性,又有胰岛素样作用的多肽,包括IGF-Ⅰ和IGF-Ⅱ两种。IGF-Ⅱ也被称为生长调节素A(somatomedio A)。是Dechiara T M等发现的第一个内源性印迹基因表达产生的生长因子[1]。IGF2为单链多肽,分子量7.5ku,有A、B、C、D四个区域[2-3]。IGFs在结构和功能上与胰岛素相似,具有促进细胞有丝分裂的生物学功能,对细胞的生长与分化起重要的调节作用,机体的许多组织器官都有IGFs的表达[4]。最近又发现IGF-Ⅱ能刺激神经及肌肉再生,是目前生物、医学领域研究的热点。由于天然IGF-Ⅱ的分离困难,阻碍了研究的深入。因此,我们利用基因工程方法克隆IGF-Ⅱ基因,构建原核表达载体,并在原核细胞中表达IGF-Ⅱ因子,为其调控机制研究以及它的应用打下基础。
1 实验材料
ICR小鼠购自潍坊医学院实验动物中心。
菌株为DH5α和BL21(DE3)。质粒为p GEM-T vector(Promega)和p ET21b vector(Novagen)主要化学试剂及耗材包括 TRlzol Reagent(Invitrogen)、Ribonuclease Inhibito r(aKaRa Biotech)、限制性内切酶(TaKaRa Biotech)、LA Taq DNA polymerase(TaKaRa Biotech)、M-MLV(Invitrogen life technologies)、T4 DNA Ligase(Promega)、凝胶回收试剂盒和质粒回收试剂盒(天为时代)、低分子量蛋白M arker (上海生科院研制)等。
2 研究方法
2.1 引物设计与合成
以p rimer 5.0软件设计引物,并用verto r N TI 9.0进行分析。引物序列如下:
Sense p rime:5’-GCGAA TTCGCCCGCTGTTCGGTT-3’
Anti-sense p rime:5’-CGGAA TTCGAGGA GGTCACAGA TTG-3’
正向引物和反向引物中同时引入了EcoR I酶切位点。引物由上海生工合成。克隆基因的测序由上海博亚(三博远志)完成。
2.2 组织总RNA的提取
(1)取小鼠心脏组织200mg,放到匀浆器中,加1m lTrizol试剂研磨。
(2)转至DEPC水处理管,然后以每1m lTrizol加入0.2m l的比例加入氯仿,盖紧离心管,用手剧烈震荡离心管15秒,室温放置5min。
(3)4℃下12000g离心5m in。
(4)取上层水相于一新的离心管,按每1m lTrizol加入0.5m l的比例加入异丙醇,室温放置10min,4℃下12000g离心15min。
(5)弃去上清液,按每1m lTrizol加入1m l的比例加入75%乙醇(用DEPC水现配),涡旋混匀,4℃下7500g离心5min。
(6)小心弃去上清液,然后室温或真空干燥5-10min,注意不要干燥过分,否则会降低RNA的溶解度。然后将RNA溶于20-40ulDEPC水中,必要时可55-60℃水溶10分钟,70℃保存。
2.3 RT-PCR克隆IGF-Ⅱ基因
反转录酶是M-MLV,反应体系如下:
总RNA 5.0μl(2.0μg)
Oligo(d T)18 1.0μl
M-MLV 5×buffer 8.0μl
dN TP(10mM) 2.0μl
M-MLV 2.0μl(200U/μl)
RNasin 1.0μl
DEPC水 1μl
混匀后,瞬间离心10秒。置42℃作用60min,然后置70℃10min以终止反应。取上述模板DNA(反转录产物)1μl,加入Ep管中,PCR反应体系如下:
dd H 2O 13.5μl
10×RNA PCR Buffer 2μl
4×dN TP混合物(2.5mM) 1μl
有义引物 1μl
反义引物 1μl
模板 1μl
TaqDNA聚合酶 0.5μl
混匀后,瞬时离心。PCR参数设定为:94℃预变性4 min;然后是94℃变性1 m in、55℃复发45sec、72℃延伸1 min,共30循环;最后是72℃延伸10 min。
2.4 电泳回收DNA与连接到T载体
PCR产物经琼脂糖电泳后加以回收。回收操作按试剂盒说明书进行。然后将回收的产物连接到 T载体,连接反应按T-Vecto r使用说明进行,体系10μl,混匀15℃连接16个小时。
2.5 大肠杆菌感受态细胞的转化与筛选
常规方法转化和进行蓝白斑筛选。
2.6 测序
分别挑取6-8个阳性菌落,接种到LB培养中培养,然后提取质粒,电泳检测后,送公司测序。
2.7 构建原核表达载体
分别取5μl测序结果中序列正确的质粒和5μlp ET21b表达质粒载体,分别加1μl内切酶切缓冲液, EcoRⅠ酶1μl,无菌水补至总体积10μl,37℃保温1.5h。然后,通过琼脂糖产凝胶电泳检测酶切结果,并回收酶切产物。连接体系同前,连接完毕后,转化BL21(DE3)感受态细菌,并筛选阳性菌落和进行PCR扩增鉴定。
2.8 IPTG诱导表达与Western blo t检测
先将含IGF-II基因的表达菌株在LB培养基中预培养过夜。
100m lTM培养基加入100μl50m g/m LAM P,使终浓度达50μg/m l;然后按1/50-1/100比例加入过夜培养的上述菌液,于37℃恒温摇床250r/m in培养3h左右,使其 OD600值达0.7-0.8。再加入50μl1ol/L IPTG,使终浓度达0.5mmol/l,进行外源基因的诱导表达。于37℃恒温摇床250r/min,继续培养4-5h后,4℃低温离心收集菌体,弃上清,裂解菌体,95℃变性菌体蛋白。取25μl上样,进行SCSPA GE。
将电泳产物转移至PVDF膜,5%无脂牛奶封闭1h,小鼠抗人IGF-Ⅱ单克隆抗体(1:500)4℃箱孵育1hr后,加入HRP一标记的二抗(1:1 000)室温2 h,显色并暴光于X线胶片。
3 结果
3.1 IGF-Ⅱ目的基因片段的RT-PCR结果与分析
小鼠的心脏组织mDNA为模板。用RT-PCR法,以olig(d T)引物反转录合成lGF-ⅡcDNA第一链,然后以合成的特异性引物和以cDNA为模板进行PCR扩增。反应产物经琼脂糖凝胶电泳显示(图1),扩增带大小(664bp)与预期的的结果一致。
3.2 重组表达质粒的酶切与电泳鉴定
如图2,泳道1为p ET21b-IGF-Ⅱ原核表达质粒经EcoRI酶切及扩增后,酶切片段与预期的一致,说明lGF-Ⅱ基因插入进了原核表达载体p ET21b中,泳道2为对照组,显示空白质粒p ET21b酶切扩增后电泳结果。

图1 PCR扩增的目的片断大小注:1为Marker;2为PCR产物
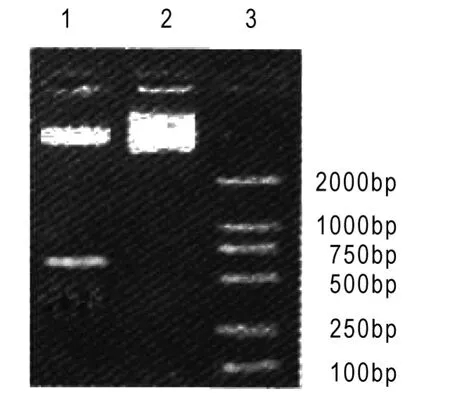
图2 重组p ET21b-c IGF-Ⅱ的酶切与电泳结果注:1为p ET21b-IGF-Ⅱ原核表达质粒经EcoRI酶切后电泳结果;2为空白质粒p ET21b酶切后电泳结果; 3为Marker。

图3 诱导表达的重组蛋白的Western blot分析注:1为未诱导组(阴性对照);2与3为IPTG诱导4 h的实验组。
3.3 Western blot分析
分别将未诱导表达的重组蛋白、两组诱导表达4 h的重组蛋白进行Western blot反应,结果如图3所示。两组诱导表达的重组菌均有明显的免疫印迹条带出现,而作为阴性对照的未诱导组则无此条带。
4 分析
在本实验中,我们通过引物设计导入了酶切位点。在完成PCR之后,纯化PCR产物,用限制性内切酶切割,而形成黏性末端[5]。再用同样的内切酶切割质粒载体后进行连接,从而构建了含有IGF-Ⅱ外源片段的T-载体和p ET21b-IGF-Ⅱ原核表达质粒载体。
大肠杆菌表达系统是目前应用最为广泛的经典表达系统。但许多外源蛋白在大肠杆菌内表达时,往往不能白发折叠生成有一定空间结构和特定生物功能的蛋白质,而是以一种不可溶的沉淀即包涵体的形式存在于胞内。虽然以包涵体形式表达具有易于纯化、表达产物较稳定等优点,但位于包涵体中的重组蛋白往往缺乏生物话性,进一步的包涵体体外复性产率也低[6-7]。
重组质粒p ET21b-IGF-Ⅱ导入宿主菌,加IPTG诱导进行表达经IPTG诱导,以非融合形式表达了lGF-II。本研究克隆了IGF-II的基因并构建了原核表达系统,这为获得大量IGF-II产品以便进一步研究IGF-II的生物学活性、作用机理及开发IGF2的临床应用奠定了一定的基础。
[1]DeChiara T M,Robertson E J,Efstratiadis A.Parental imp rinting of the mouse insulin-like grow th facto r IIgene[J]. Cell,1991,64:849-859.
[2]吕勇刚,陈蕤.胰岛素样生长因子-2研究进展[J].中国医学文摘:肿瘤学,2001,14(2):163-164.
[3]李瑗.胰岛素样生长因子-2与人及实验动物的肝细胞癌[J].临床与实验病理学杂志,1998,14(5):500-501.
[4]高玉红,李庆章.胰岛素样生长因子系统研究进展[J].中国乳品工业,2006,34(4):46-49.
[5]吴岚晓,李明,王萍,等.人胰岛素样生长因子-1在大肠杆菌中的表达[J].药物生物技术,2001,8(4):185-188.
[6]曾凡星,杨锡让,杨则宜.人胰岛素样生长因子的研究进展[J].北京体育大学学报,1998,21(3):42-45.
[7]岳凤鸣,赵焕英.人胰岛素样生长固子-1基因的克隆、表达和活性检测[J].解剖学报,2003,34(3):307-311.
(责任编辑:刘乃生)
IGF-IIExpressed in Prokaryotic Organ ism
WANG Qing-zhong,REN Ke-yun
(Weifang Un iversity,Werfang 261061,China)
IGF-Ⅰand IGF-Ⅱare exp ressed in many organs,and have important roles in cell grow th and p roliferation.In this study,we,the target gene,IGF-Ⅱ,was cloned and amp lified By RT-PCR method from cardiac m uscle and then inserted into T-vecto r,and then inserted the exp ression vecter p ET21b.The recom binant vecto r w as indicated exp ressing IGF-Ⅱp rotein in E.coli DH5αafter induced by IPTG.We then purified reeombinant p rotein and analyzed via Western blot.
IGF-Ⅱ,RT-PCR,p rokaryotic exp ression vector,exp ression
2010-09-22
王庆忠(1961-),男,山东青州人,潍坊学院生物工程学院教授,博士。
R394 文献标识码:A 文章编号:1671-4288(2010)06-0103-03
