解脲支原体不同生物群别对小鼠体外受精的影响
2010-12-08武蓉珍刘胜勇陈东红周美青金卓杏张晓兰陈晓方周丽红周铁丽
武蓉珍 刘胜勇 陈东红 周美青 金卓杏 张晓兰 陈晓方 周丽红 周铁丽
解脲支原体(UU)是人类泌尿生殖道内最常见的支原体,可分为 14个血清型。由于各血清型之间具有较高的抗原同源性,交叉反应明显,给 UU临床分离株的血清分型工作及筛选有毒力的血清型株带来一定的困难,而不同生物群之间的交叉反应较少见。2002年,Robertson等[1]根据UU两个生物群的表型和基因型特征,建议将两者划分为脲原体属下两个完全独立的物种,提出了生物群概念。生物群 1(或 Parvo生物型)包括血清型 1,3,6和 14共计 4种含较小基因(DNA长度 0.75~0.76Mbp)的 UU,生物群 2(或 T960生物型)则包括血清型 2,4,5,7,8,9,10,11,12和 13共 10种含较大基因(DNA长度0.88~1.2Mbp)的UU。近年来,解脲支原体的检出率不断上升,临床上常常对宫颈分泌物、精液和前列腺液中检测出 UU的就医者盲目投以大量抗生素药物,导致UU临床分离株的耐药性日益严重。生殖系统UU的致病性如何,UU是否只有某些生物群达到一定浓度时,才能影响精子的授精能力和胚胎的发育,从而致病,目前尚无一个系统的、有说服力的研究来证实这一点。人类配子的受精、卵裂、2~8细胞期的胚胎发育都在输卵管中完成,此时若受到 UU感染将会对受精、卵裂及随后的早期胚胎发育有何影响尚不明了。针对这一现象,我们用血清型 3型 UU代表含有较小基因的生物群 1(或 Parvo生物型),血清型 8型UU代表含有较大基因的生物群 2(或 T960生物型),分别与 ICR小鼠精子、成熟卵丘 -卵母细胞复合体共孵育,观察不同生物群别的 UU对小鼠成熟卵母细胞体外受精(IVF)及卵裂的影响。
材料与方法
一、标准菌株及动物
解脲支原体血清型 3型(菌株号:ATCC27815)、血清型 8型(菌株号:ATCC27618)标准菌株购于南京东南大学公共卫生学院流行病学教研室,传代后 -80℃冻存备用。清洁级ICR小鼠,雌鼠 50只,5~8周龄,体重(25±5)g;成熟雄鼠 5只,10~16周龄,体重(30±5)g。由浙江大学实验动物中心提供。
二、主要试剂与仪器
培养液 HTF和 HTF-HEPES为 InVitroCare公司产品;矿物油为 MediCult公司产品;血清替代品 SSS、磷酸盐缓冲液(PBS)为Irvine公司产品;解脲支原体培养基购于珠海丽珠试剂公司;孕马血清促性腺激素 (PMSG)和人绒毛膜促 性腺激素 (HCG)为宁波第二激素制品厂产品;高纯度(99.999%)CO2气体为杭州新世纪气体有限公司生产。体视显微镜、倒置显微镜、相差显微镜均为日本 Nikon公司产品;CO2培养箱为英国 Galaxy公司产品;IVF工作站为丹麦 K-system系列产品。
三、实验方法
1.UU的菌数测定 采用颜色改变单位法(CCU),将菌液用培养基稀释成 1×10-1~ 1×10-9系列浓度,经 37℃恒温培养 7d后,以培养基由黄色变为红色时的最高稀释度作为颜色改变单位(CCU),菌液浓度以 CCU/ml计。
2.UU的培养方法 于取鼠卵前一天,取 -80℃冻存的UU标准菌株进行传代培养,颜色由黄色变为略深的红色时将培养基离心,弃上清,加入 100μl平衡的 HTF(含 10%SSS)培养液中,轻轻吹打混匀。取 50μl作 CCU培养,进行菌数测定,其余置培养箱中备用。
3.小鼠超促排卵方法和成熟卵丘 -卵母细胞复合体(COCS)的获得 根据 Hogan等[2]采用的方法进行小鼠卵子的超排。于注射HCG后 16~18h用颈椎脱臼法处死雌鼠,切取双侧输卵管,在培养液中划破,COCS自动释放后,将其移入HTF(含 10%SSS)培养液中,用细巴斯德管吹散,获单个COCS。随机分组后移入已平衡过夜的培养液中等待受精。
4.小鼠精子的采集及 IVF 选取健康的 8~10周龄的ICR雄鼠,处死后将附睾尾部及附带的部分输精管,置于 HTF(含 10%SSS)培养液中,划破雄鼠附睾尾部,精子自然游出,置培养箱内孵育 1h使其获能。将获能后的精子用 Makler精子计数板计数,并用 HTF(含 10%SSS)培养液调整浓度至 1×106~5×106个/ml。按精卵比 10 000:1的比例将精子加入含有卵母细胞的培养液中进行受精。
5.卵子分级标准 Ⅰ级:卵细胞呈深色,放射冠完全没有分散开,卵丘细胞紧密排列在一起,颜色偏深,卵丘细胞很小。常为不成熟或退化的卵子;Ⅱ级:卵细胞外观颜色变浅,放射冠已呈不同程度的分散,卵丘细胞排列变疏松,颜色变浅。通常为已接近成熟的卵子;Ⅲ级:卵细胞外观颜色很淡,形状为规则的圆形,放射冠完全分散,卵丘细胞通常较大,排列疏松,颜色很淡。通常为成熟卵子;Ⅳ级:卵细胞颜色变深,放射冠分散,但外周卵丘细胞团很小或缺失,通常为过熟卵子。选择Ⅲ级卵子后续操作。
6.胚胎评分方法 对取卵后第 2天(D2组)或第 3天(D3组)胚胎分别按胚胎发育速度(细胞数目评分)、碎片程度和卵裂球对称性进行评估,计三者总分为一个胚胎的得分,具体评分方法见表 1。

表 1 胚胎质量评分方法
7.不同生物群别 UU对小鼠IVF影响 实验组加入不同浓度的 3型或 8型 UU菌液,对照组不加 UU。按精卵比为10 000:1的比例将小鼠精子和COCS加入,培养过夜。第 2天,更换新鲜HTF(含 10%SSS)培养液后继续培养 72~75h,每天记录胚胎生长情况。统计实验组和对照组的体外受精率、D2胚胎评分及4-细胞期胚胎形成率。
受精率(%)=(≥2-细胞期胚胎数)/(获卵数)×100%
4-细胞期胚胎形成率(%)=(≥4-细胞期胚胎数)/(获卵数)×100%
四、统计学分析
实验组与对照组 D2胚胎评分用(¯x±s)表示,两组间胚胎评分的比较用t检验,实验组与对照组间受精率、4-细胞期胚胎形成率的比较采用 χ2检验,采用 SPSS15.0软件进行统计分析。
结 果
一、各浓度 3型 UU对小鼠 IVF影响
3型UU在培养液中的终浓度分别为 104CCU/ml组(104组)、105CCU/ml组(105组)、106CCU/ml组 (106组)的 D2评分、4-细胞期胚胎形成率与对照组的差异有统计学意义。105组和106组的受精率与对照组比较差异有统计学意义,见表2。

表 2 3型 UU各组 IVF情况比较
二、各浓度 8型 UU对小鼠 IVF影响
8型 UU在培养液中的终浓度为 102CCU/ml组(102组)的受精率、D2评分、4-细胞期胚胎形成率等胚胎发育指标与对照组比较差异均无统计学意义(P>0.05)。UU终浓度分别为 104CCU/ml组(104组)、105CCU/ml组(105组)的受精率、D2评分、4-细胞期胚胎形成率与对照组比较均有统计学差异(P<0.05)。103CCU/ml组(103组)的受精率、4-细胞期胚胎形成率与对照组比较差异均无统计学意义(P>0.05),但其 D2评分与对照组比较有统计学差异(P<0.05),见表2。
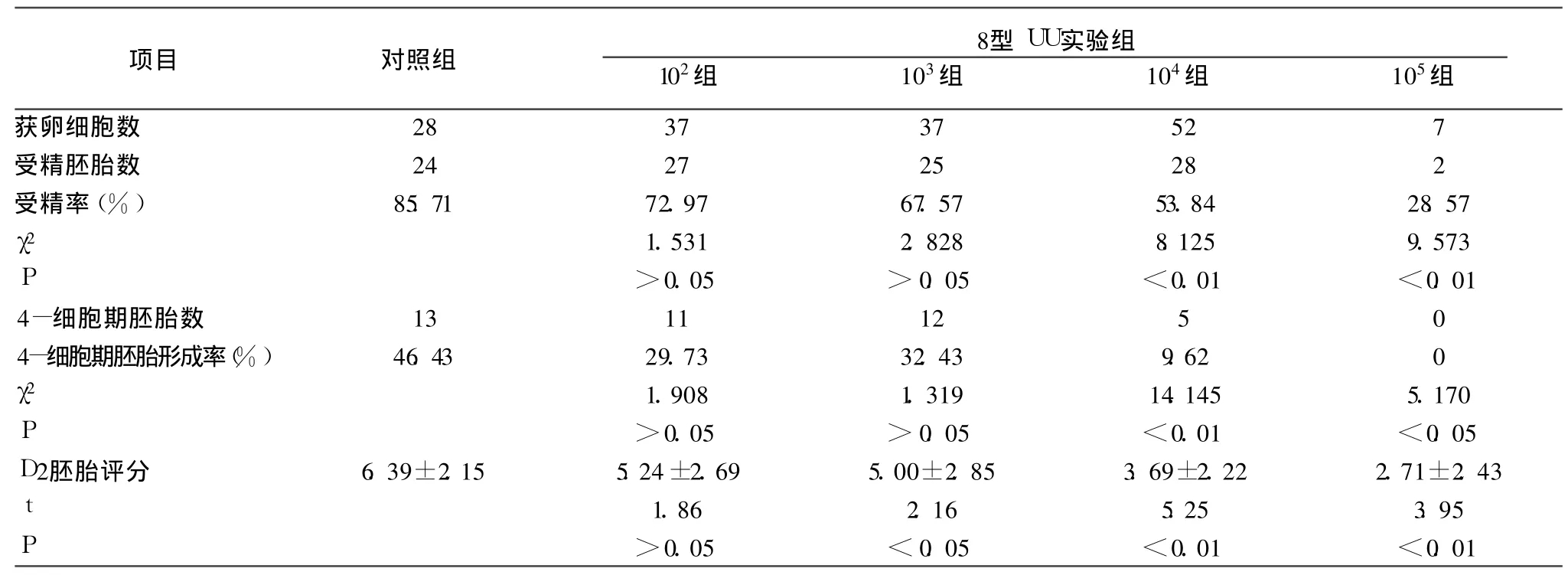
表 3 8型 UU各组 IVF情况比较
讨 论
UU是引起泌尿生殖道炎症的最常见的病原体,也是性传播疾病(STD)的主要病原体。在男性精液中,UU感染约占10%~40%,而在女性生殖道炎症中检出率高达 64.39%~67.40%[3]。已有较多的证据表明UU感染与男性的非淋菌性尿道炎、男性不育、前列腺炎、附睾炎,女性的流产、早产、不孕不育、女性急慢性生殖道炎症,新生儿低体质量等均有较密切的关系。UU感染已引起临床的高度关注,其致病性的相关因素值得探讨。
有学者提出 14个血清型的致病力不尽相同[4],并非所有UU均具有致病性。有的血清型可以作为宿主正常携带的微生物,甚至在没有性生活的幼女阴道内也存在。史同新等[5]发现在 1~3岁健康幼儿泌尿生殖道中 UU的携带率为8.0%,以生物群 1为主,主要血清型是 1型和 6型。国内王荷英等[6]对 172株 UU进行血清学研究发现:4型与非淋菌性尿道炎显著相关,3型在宿主因素和一定的环璄条件下,UU的寄居和致病状态可相互转化。Yoshida等[7,8]认为,UU的T960生物型中2,5,8,9四种血清型与非淋菌性尿道炎有相关性,提出UU的 T960生物型可能是非淋菌性尿道炎的病原体,而Parvo生物型则可能在非淋菌性尿道炎的发生发展中没有意义。朱庆义等[9]发现:性病门诊患者临床标本中 UU阳性率 56.8%,其中 3型最多,占 16.7%,1型占 13%。而权力敏等[10]学者研究表明,血清型 3,4,10,11与感染有关,血清型 6,14则以寄居形式在体内呈携带状态而不致病。因此,探讨 UU不同血清型与致病性关系有重要的理论和实践意义。人精液质量与 UU感染的生物群也有关,T960群感染可引起精子活动力明显下降。2003年 Ren等[11]运用聚合酶链反应(PCR)技术进行 UU基因分型,揭示正常携带状态及感染状态下 UU的基因型。认为Parvo生物型,尤其是 1,3,6的单型别,在正常人群携带的可能性较大,而 T960生物型有可能和Parvo生物型中 1种以上血清型起协同作用或独自导致疾病。
本实验发现:3型UU浓度≤103CCU/ml、8型 UU浓度≤102CCU/ml时,受精率、D2评分、4-细胞期胚胎形成率等胚胎发育指标与对照组比较无差异(P>0.05);3型UU浓度≥105CCU/ml、8型 UU浓度≥ 104CCU/ml时,受精率、D2评分、4-细胞期胚胎形成率与对照组比较均有差异(P﹤0.01);而当 3型 UU浓度为 104CCU/ml、8型 UU浓度为103CCU/ml时,受精率与对照组比较无差异,但 D2评分、4-细胞期胚胎形成率出现了差异,说明这一浓度为UU对小鼠的IVF造成抑制作用的临界浓度,虽然受精率没受到影响,但胚胎发育潜力受到抑制。上述实验结果也表明,随着UU浓度的增高,对小鼠IVF及早期胚胎发育的影响也增大。UU的致病性与其血清型有关,代表含有较大基因的生物群 2(或T960生物型)的血清型 8型UU可能较代表含有较小基因的Parvo生物型的血清型 3型UU具有更强的致病性。这与文献报道 T960生物群可能是致病菌群,而 Parvo生物群可能是定植菌群有些相符[12,13],但 3型 UU并非不具有致病性,这可能与实际的临床病例标本中 Parvo生物型 UU未达到本实验研究中那么高的浓度有关,也与观察的方法和卵细胞的受精及其早期胚胎的发育对外界环境的敏感性高有关。低浓度的UU(3型 UU≤103CCU/ml、8型 UU≤102CCU/ml)对小鼠 IVF及早期胚胎发育未见影响,但其远期效应有待进一步研究。
由于卵子质量对 IVF的结果影响很大,因此在实验中必须选择卵子分级标准为Ⅲ级的成熟卵子进行随机分组,在卵丘 -卵母细胞复合体自动释放后严格去除卵细胞外观颜色发黑的、形状不规则的、卵丘细胞稀少的卵子。解脲支原体的培养基与胚胎培养基成分不同,对精子、卵子、胚胎均有一定的损害,因此一定要用高速离心法浓缩UU,并充分去除残余的支原体培养基,再用经平衡的胚胎培养基洗涤后再加入培养系统,以排除支原体培养基对小鼠 IVF和早期胚胎发育的影响。
综上所述,UU的致病性毒力与其生物群、浓度密切相关,在临床应用上,分子检测方法有望成为病原学诊断的常规方法[14]。但目前UU临床检测手段仍然有限,对UU致病性仍未最终定性,应严格 UU感染的诊断,建立一个简单、实用、可靠的UU分型的临床检测方法,避免过度治疗和耐药株的日益增多。
1 Robertson JA,Stemke GW,Davis JWJr,et al.Proposal of Ureaplasma parvum sp-nov-and emended description of Ureaplasma urealyticum.Int J Syst Evol Microbiol,2006,52(2):587~597.
2 Hogan B,Costantini F,Lacy E.Manipulating the mouse embryo a Laboratory manual.New York Cold Spring Laboratory,1986:89.
3 刘小澄,林晨,黄环珍,等.解脲支原体与不孕、早孕、生殖道炎症关系的探讨.实用妇科学杂志,1997,13(6):306~307.
4 Cao X,Wang Y,Hu X,et al.Real-time TaqMan polymerase chain reaction assays for quantitative detection and differentiation of Ureaplasm urealyticum and Ureaplasma parvum.Diagn Microbiol Infect Dis,2007,57(4):373~ 378.
5 史同新,徐敬星,赵光.解脲脲原体在健康幼儿泌尿生殖道中的分子流行病学研究.中国艾滋病性病,2008,14(4):389~391.
6 王荷英,施美琴,叶顺章,等.172株解脲支原体的血清学分型研究.中华皮肤科杂志,1998,31(4):224~226.
7 Yoshida T,Ishiko H,Yasuda M,et al.Polymerase chain reactionbased subtyping of ureaplasma parvum and ureaplasma urealyticum in first-pass urine samples from men with or without urethritis.Sex Transm Dis,2005,32(7):454~457.
8 Yoshida T,Deguchi T,Meda S,et al.Quantitative detection of Ureaplasma parvum(biovar 1)and Ureaplasma urealyticum(biovar 2)in urine specimens from men with and without urethritis by real-timepolymerase chain reaction.Sex Transm Dis,2007,34(6):416~ 419.
9 朱庆义,胡朝晖,刘峰林,等.解脲脲支原体多带抗原基因分型鉴定及其临床应用研究.中华医院感染学杂志,2005,15(8):856~858.
10 权力敏,叶淑芳,陶秀莲,等.青岛地区解脲支原体及其感染分布的检测.中国皮肤性病学杂志,1997,11(6):343~345.
11 Ren Y,Zhu X.Investigation on biovars and genotypes of Ureaplasma urealyticum in the cervix in a Chinese gynecologic check-up population and sex workers.Acta Derm Venereol,2003,83(3):175~178.
12 Povlsen K,Bjornelius E,Lidbrink P,et al.Relationship of Ureaplasma urealyticum biovar 2 to nongonococcal urethritis.Eur JClin Microbiol Infect Dis,2002,21(2):97~101.
13 Deguchi T,Yoshida T,Miyazawa T,et al.Association of Ureaplasma urealyticum(biovar 2)with nongonococcal urethritis.Sex Transm Dis,2004,31(3):192~195.
14 Cultrera R,Seraceni S,Germani R,et al.Molecular evidence of Ureaplasma urealyticum and Ureaplasma parvum colonization in preterm infants during respiratory distress syndrome.BMC Infect Dis,2006,21(6):166.
