苦瓜茎、叶中皂苷类物质的提取及分离纯化
2010-12-05张玉婵刘金福张平平江英庞红勋
张玉婵 ,刘金福 ,张平平 ,江英 ,庞红勋
(1.石河子大学食品学院,新疆 石河子 832000;2.天津农学院食品科学系,天津 300384)
苦瓜茎、叶中皂苷类物质的提取及分离纯化
张玉婵1,2,刘金福2,*,张平平2,江英1,庞红勋1,2
(1.石河子大学食品学院,新疆 石河子 832000;2.天津农学院食品科学系,天津 300384)
苦瓜茎、叶中含有丰富的皂苷类物质。在浸提温度为70℃,浸提时间3 h,浸提溶剂为60%乙醇溶液,料液比1∶15,对60目的原料浸提两次,测得苦瓜茎、叶总皂苷的含量分别为2.92%和6.90%,提取率分别为5.9%和13.6%,粗提物中总皂苷的含量分别为49.5%和50.1%。粗提物经两次AB-8大孔吸附树脂分离纯化后,苦瓜茎、叶提取物中皂苷纯度分别达到83.4%和86%,经HPLC分析,主要有2种皂苷成分。
苦瓜茎叶;皂苷;提取;纯化
苦瓜(Momordicac harantia L.)别名锦荔枝、凉瓜、癫蛤蟆、红羊、癫葡萄,是葫芦科苦瓜属蔓性草本植物,苦瓜性味苦寒,具有清热解毒、滋养强壮、抗肿瘤[1]以及提高人体免疫力[2-3]等功效。近十年来对苦瓜皂苷的研究比较多,研究表明,苦瓜的醇提物,水提物均含有皂苷类物质,具有降血糖等功效[4-6]。但是大部分的研究都是以苦瓜的果实,果肉或种籽为原料,对苦瓜茎叶中皂苷类物质的提取及功效的研究鲜见报道。植物茎叶中往往含有丰富的次生代谢产物,并具有明显的生物活性,如沙棘黄酮[7-9]、苦荞黄酮[10-11]、银杏茎叶黄酮[12-13]等等。本研究对苦瓜茎叶中的皂苷类物质进行提取、纯化,并测定其含量,为对其生物活性进行研究,对废弃的茎叶进行深度的开发利用提供参考。
1 材料和仪器
1.1 材料
苦瓜茎叶:产于天津西青区大寺设施农业大棚,秋季拉秧后采收,阴干、粉碎过60目筛,装袋后常温贮存;人参皂苷Rg1标准品:上海同田生物技术有限公司;大孔吸附树脂(型号为AB-8):河北沧州远威化工有限公司;乙醇、冰乙酸、高氯酸、氯仿、甲醇、等均为国产分析纯:天津市北方天医化学试剂厂;甲醇(色谱纯)、乙腈(色谱纯):天津市永大化学试剂开发中心。
1.2 仪器
Agilent高效液相色谱仪:安捷伦科技有限公司;FD-1C冷冻干燥机:北京博医康实验仪器有限公司;DL-180A超声波清洗器:上海之信仪器有限公司;SHB-111循环水式真空泵:郑州长城科工贸有限公司;旋转蒸发器RE-50:上海申生科技有限公司;DBS-100自动部分收集器:上海沪西仪器厂;紫外可见分光光度计:上海光谱仪器有限公司;恒温摇床:上海智城分析制造有限公司;FA2004电子天平:上海精科仪器;恒温水浴锅:天津市中环实验电炉有限公司;DHG-9240A型电热恒温鼓风干燥箱:上海精密实验设备有限公司;10μL~100μL,20μL~200 μL,100μL~1000 μL Finnpipette移液枪各1支。
2 方法
2.1 苦瓜茎、叶中皂苷类物质的测定
2.1.1 标准曲线的制作
准确称取香草醛2.5 g于小烧杯中,用冰乙酸多次溶解,定容到50 mL容量瓶中。即为5%的香草醛-冰乙酸溶液。
精密称取干燥至恒重的人参皂苷Rg1对照品5mg,加甲醇溶液定容到5 mL,摇匀,作为对照品溶液,即1 mg/mL的人参皂苷标准溶液。准确称取标准皂苷溶液 0.00、0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16、0.18、0.20 mL于药剂瓶水浴挥干溶剂,加5%的香草醛-冰乙酸溶液0.2 mL和0.8 mL高氯酸,摇匀,60℃水浴加热15 min。取出后立即流水冷却10 min,加入5 mL冰乙酸稀释,静置20 min后,在波长468 nm处测吸光度,甲醇溶液随行空白对照,以吸光度A为纵坐标,人参皂苷取样量(μg)为横坐标,绘制标准曲线(如图1),得曲线方程:y=0.0017x-0.0026
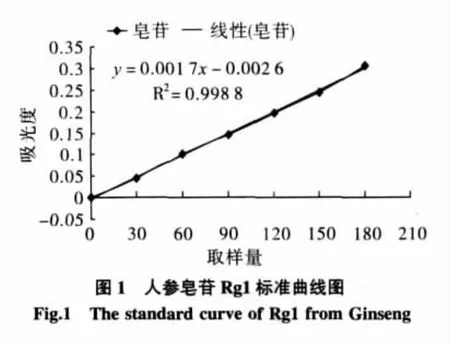
2.1.2 苦瓜皂苷含量的测定
将苦瓜粗提液浓缩除醇后,吸取一定量的浓缩液,同图1绘制标准曲线的方法显色后,在波长468 nm处测定吸光值,根据标准曲线计算其总皂苷的量。
2.1.3 皂苷的HPLC分析
将上述苦瓜皂苷溶于色谱甲醇,配成5 mg/mL的甲醇溶液,以HPLC分析,在203 nm检测,色谱条件:色谱柱:Zorbax SB-C18柱(150 mm×4.6 mm,5 μm);流动相:乙腈:水=30:70,等度洗脱;流速:1 mL/min;柱温:30℃。
2.2 皂苷的提取与纯化
2.2.1 工艺过程
苦瓜茎、叶自然干燥→粉碎→乙醇浸提→过滤→浓缩→调整pH→大孔树脂吸附→洗脱→浓缩→真空干燥
2.2.2 具体操作
2.2.2.1 苦瓜茎中皂苷的提取
称取苦瓜茎1.1 kg,加15 L 60%乙醇于70℃下浸提3 h,过滤,再加10 L 60%乙醇与70℃下浸提3 h,过滤,合并两次滤液得到浸出液13 L,真空浓缩,得到苦瓜茎皂苷粗提液2.6 L。吸取80 μL,按上述绘制标准曲线的方法显色后,在波长468 nm处测定吸光值,3次取平均值,按公式计算总皂苷含量,粗提液干燥后计算提取率。
2.2.2.2 苦瓜叶中皂苷的提取
称取苦瓜叶(干叶)1.2kg,加15L60%乙醇与70℃下浸提3h,过滤,再加12L60%乙醇与70℃下浸提3h,过滤,合并两次滤液得到浸出液19.5 L,真空浓缩,得到苦瓜叶皂苷粗提液4 L。吸取50 μL,按上述绘制标准曲线的方法显色后,在波长468 nm处测定吸光值,3次取平均值,按公式计算总皂苷含量,粗提液干燥后计算提取率。
2.2.2.3 皂苷的柱层析纯化
本试验采用直径为100 mm,高2 m的吸附柱进行纯化,大孔吸附树脂为AB-8型,柱装填体积为8 L。
上样量:苦瓜茎提取物上样量为5.3 L;苦瓜叶提取物上样量为5 L。
上样液pH值:苦瓜茎提取物上样pH6.2;苦瓜叶提取物上样pH7.0。
上样液浓度:根据预试验的结果,苦瓜茎提取物上样浓度为14.2 mg/mL;苦瓜叶提取物上样浓度为16 mg/mL。
上样液速度:苦瓜茎、叶提取物均为20 mL/min。
洗脱剂及其浓度:本试验选择水和乙醇作为苦瓜皂苷的洗脱剂,据预试验结果,选择80%的乙醇溶液作为苦瓜皂苷的洗脱剂。
洗脱剂量:将上述饱和的树脂柱进行水洗除杂至Molish反应为阴性,收集除杂液,再用80%的乙醇以20 mL/min的速度洗脱,用2倍柱床体积的80%的乙醇溶液洗脱皂苷时几乎全部被吸附皂苷都可以洗脱下来。因而确定洗脱剂用量为2倍柱床体积的80%的乙醇溶液。
2.2.3 提取率、含量、纯度及收得率计算
苦瓜茎、叶皂苷的提取率=提取物/苦瓜茎、叶质量×100%
皂苷的含量=粗提物中总皂苷含量/苦瓜茎、叶质量×100%
皂苷的纯度=粗提物中总皂苷含量/粗提物干重×100%
收得率=纯化后总皂苷量/粗提物中总皂苷量×100%
3 结果与分析
3.1 苦瓜茎、叶中皂苷类物质的提取及含量
苦瓜茎、叶中皂苷类物质的提取率及含量见表1。

表1 苦瓜茎、叶中皂苷类物质的提取率及含量Table1 The content and rate of extractive saponins from the stem and leaf of Momordica charatia L.%
由表1可知,在苦瓜茎叶中含有丰富的皂苷类物质,尤其是苦瓜叶中,含量高达6.90%(干叶),茎叶中平均含量也达到了4.90%左右。按照本实验室确定的提取工艺和技术条件,苦瓜茎叶中皂苷粗提物提取率分别为5.90%和13.60%,其中总皂苷的含量都达到了50%左右,可见,被废弃的苦瓜茎叶具有很高的开发利用价值。
3.2 苦瓜茎、叶皂苷纯化结果
从苦瓜茎和叶中提取的皂苷经过两次大孔树脂的纯化后,对其纯度进行了测定,结果见表2。
表2 苦瓜茎、叶提取物柱层析纯化效果Table2 The purification effect of extractive saponins from the stem and leaf of Momordica charatia L.%
经2次AB-8大孔吸附树脂分离纯化,苦瓜茎叶提取物中皂苷的纯度得到了大幅度的提高,苦瓜茎提取物皂苷纯度为83.40%,叶提取物皂苷纯度为86.00%。但收得率仅为11.20%和11.50%,说明AB-8大孔吸附树脂只对苦瓜茎叶中个别的皂苷吸附能力较强,或洗脱时大部分极性较大的皂苷类物质被水洗掉,未被回收。
3.3 HPLC分析结果
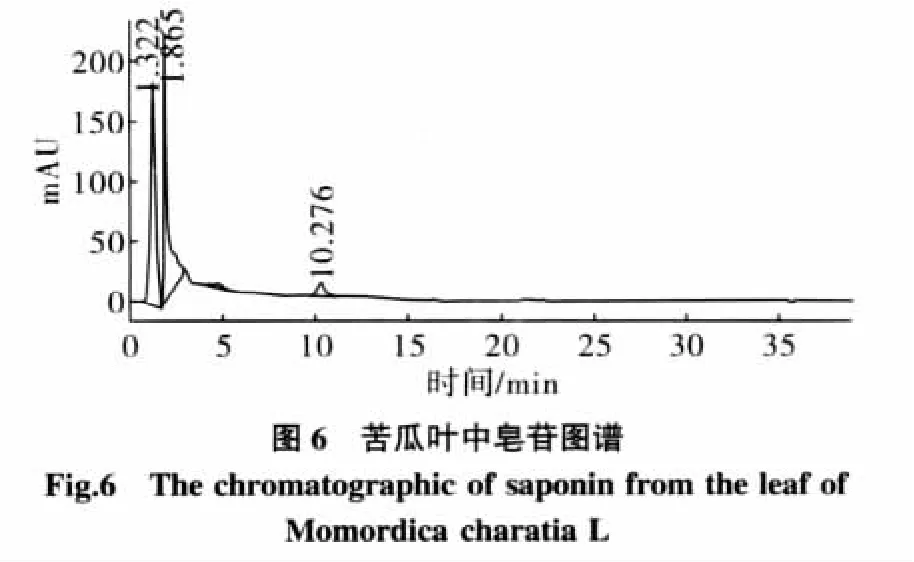
对大孔吸附树脂纯化后的苦瓜茎叶中皂苷的组成,与人参皂苷中的Rg1和Rb1标准样对照,进行了HPLC分析,分别精密吸取两种对照品溶液各20 μL,按照2.1.3色谱条件重复进样3次,测定峰面积,其相对标准偏差RSD小于3%。表明仪器精密度良好。结果见图2~图6。
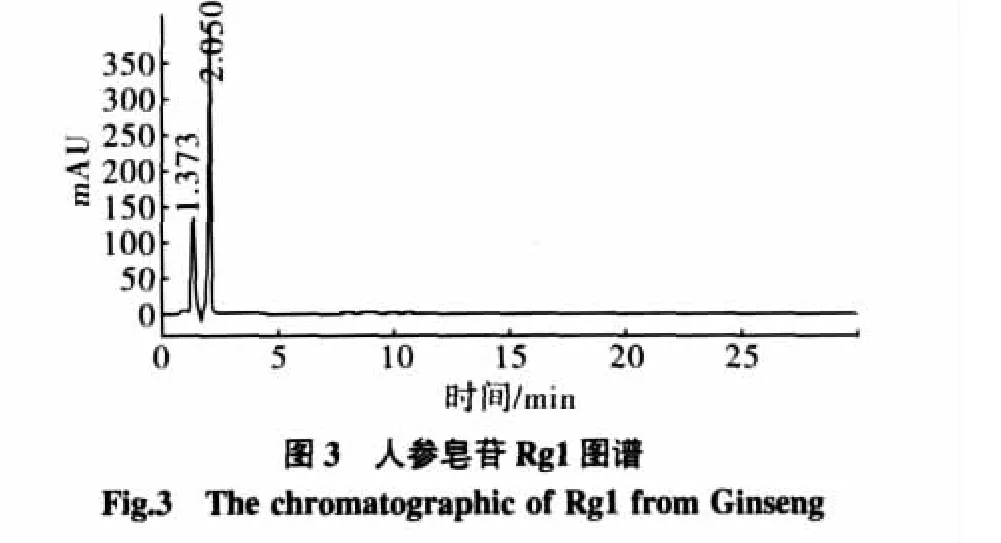
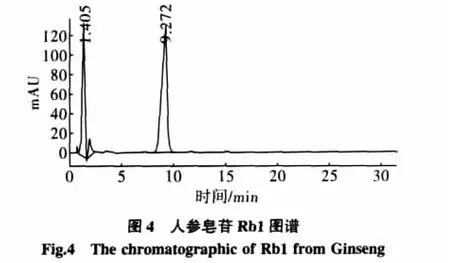
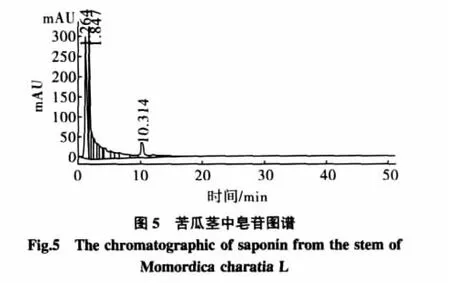
纯化后的苦瓜茎叶中皂苷类物质经泡沫试验和显色试验进行了定性检验。泡沫试验,发现泡沫丰富、持久。Libermann-Buehard反应,加0.5 mL醋酐,充分溶解,沿皿壁加硫酸2滴~3滴,立即显红色,可定性为皂苷类物质。从HPLC图谱中可以看出,经纯化后的苦瓜茎叶中的皂苷类物质主要有2个组分,分别与人参皂苷Rg1和Rb1的极性接近。
4 讨论
苦瓜中皂苷类物质的提取分离有许多报道,都是以苦瓜的果实,果肉为原料,研究提取的方法、皂甙的含量和组成等。崔恒林等采用有机溶液浸提苦瓜肉中总皂苷,含量为0.052%[14]。本实验室2007年曾研究了苦瓜皂苷和多糖的综合提取工艺,以微波、超声波辅助提取,从苦瓜干粉中提取皂苷,含量为0.024%,多糖含量为3.02%[15]。以苦瓜茎叶为原料提取制备皂苷类物质还鲜见报道,从本实验的结果来看,秋季拉秧后的苦瓜茎叶中含有丰富的皂苷类物质,显色法测定茎叶中总皂苷平均含量达到达到了4.9%,废弃的茎叶极具开发利用的价值。
皂苷的分离纯化常用大孔吸附树脂的柱层析法。大孔吸附树脂对化合物的吸附/解吸附能力是由树脂的极性、比表面积、孔径以及化合物本身的性质等综合因素决定的,研究中主要考察大孔吸附树脂对分离物质的吸附率/解吸附率。黎海彬[16]等在此方面的报道。本实验室对不同极性和性质的多种大孔树脂用于苦瓜皂甙的吸附分离、纯化,结果表明AB-8型树脂对于苦瓜中的部分皂苷具有良好的吸附分离性能[17]。在本实验中同样采用AB-8型树脂分离制备苦瓜茎中的皂苷类物质,采用2次吸附纯化后,用2倍柱床体积的80%的乙醇溶液洗脱,皂苷的纯度可达到85%左右,但收得率较低,可能是由于浸提时采用的是60%的酒精溶液,极性较大皂甙在柱层析水洗脱时,溶于水中,而未回收造成的。提示在制备苦瓜茎叶总皂苷时要注意不同极性皂苷的吸附和洗脱条件的摸索。
苦瓜中含有多种皂苷成分,例如,2001年Tosbiyuki[18]等从苦瓜新鲜的果实中分离出苦瓜甙-a,-b,-c,-d,-e,-f,-g,-h等八种皂苷。苦瓜皂苷的生物活性主要体现在调节血糖、降血脂、抗氧化、抗菌等方面[19-21]。本试验表明,从苦瓜茎叶中可以得到大量的皂苷类物质,对其结构和功效研究正在进行中,将在后续报道。
[1]齐文波,徐中平,徐誉泰,等.苦瓜素的分离纯化与抗肿瘤活性的研究[J].离子交换与吸附,1999,15(1):59-63
[2]王先远,蒋与刚,金宏,等.苦瓜皂甙的抗氧化作用初探[J].解放军预防医学杂志,2001,19(5):317-320
[3]Leung S.The immuno suppressive activities of two abortifaccientn proteins isolated from the seeds of bitter melon[J].Immunopharmacology,1987,13:159
[4]盛清凯,姚惠源.苦瓜中植物胰岛素的分离及其降糖作用研究[J].2005,26(1):223-225
[5]Jaspreet Virdi,Sivakami S,Shahani S,et al.Antihyperglycemic effects of three extracts from Momordica charantia[J].Journal of Ethnopharmacology 2003,88:107-111
[6]Haider Raza,Ijaz Ahmed,Annie John.Tissue specific expression and immunohistochemical localization of glutathione S-transferase in streptozotocin induced diabetic rats:Modulation by Momordica charantia(karela)extract.Life Sciences,2004,74:1503-1511
[7]高镜明,李芸生.沙棘果皮渣总黄酮的提取及测定研究[J].沙棘,1997,10(4):39-40
[8]刘锡建.沙棘果渣中总黄酮提取的研究[J].北京化工大学学报,2004,1:1-2
[9]朱万靖.沙棘资源开发与沙棘黄酮提取[J].西部粮油科技,2001,2:30
[10]邹亮,赵钢,周浓,等.苦荞黄酮提取与分离技术的研究进展[J].安徽农业科学,2009,37(27):13235-13237
[11]王敏,高镜明,王军,等.苦荞茎叶粉中总黄酮酶法提取工艺研究[J].中草药,2006,11(37):1645
[12]李大枝,张长花,党艳秋,等.从银杏叶中高效提取分离银杏黄酮的研究[J].科技信息,2008,1
[13]戴余军,江德安.银杏叶总黄酮水浸提法的研究[J].安徽农业科学,2008,36(1):20-21
[14]崔恒林,徐斌,董英.苦瓜皂甙的提取过程研究[J].江苏大学学报L自然科学版,2004,25(5)
[15]张平平,刘金福,韩惠,等.水溶性苦瓜皂甙和苦瓜多糖提取方法的研究[J].食品研究与开发,2007,28(6)
[16]黎海彬,李小梅.大孔吸附树脂及其在天然产物研究中的应用[J].广东化工,2005(3):12
[17]张卫军,刘金福,张平平,等.大孔吸附树脂对苦瓜皂甙吸附特性的研究[J].食品研究与开发,2008,29(2):5
[18]Tosbiyuki Murakami Structures of New Cucurbitane-Type Triterpene Glycosides-a,-b,-c,-d,-e,-f,-g,and-h and New Oleanane-Type triterpene Saponins,Goyasap-oninsⅠ,ⅡandⅢ,from the Fruit of Japanese Momordica charantia L.Chem.pha-rm.bull.2001,49(1):54-63
[19]张平平,刘金福,甄润英.苦瓜皂甙纯品对糖尿病大鼠的降糖功效及急性毒性试验[J].营养学报,2007(3):304-305
[20]杨志刚,史万震,沈宗根,等.苦瓜皂甙对去卵巢和高血脂症大鼠血脂的影响[J].食品科学,2009,30(19):307
[21]张平平,刘金福,王昌禄,等.苦瓜提取物的抑菌活性研究[J].天然产物研究与开发,2008,20:721-724
Extract and Purification Saponins from the Stem and Leaf of Momordica Charantia L.
ZHANG Yu-chan1,2,LIU Jin-fu2,*,ZHANG Ping-ping2,JIANG Ying1,PANG Hong-xun1,2
(1.College of Food science and Engineering,Shihezi University,Shihezi 832000,Xinjiang,China;2.Department of Food science,Tianjin Agriculture University,Tianjin 300384,China)
There were plenty of saponins in the stem and leaf of momordica charantia.Several influential factors in the extraction of saponin from momordica charantia L,including temperature,solid-liquid ratio,time,mass fraction of alcohol.This article extract the material with 60%ethanol at 70 ℃ in 3 h with solid to liquid ratio 1∶15.After extracting the 60 mesh material for twice times,the extraction of saponin got from the stem and leaf of momordica charantia was 2.92%and 6.9%,the extraction ratio was 5.9%and 13.6%,and the saponin in the part of extraction was 49.5%and 50.1%.After purifing the extraction part twice times with AB-8 Macroporous absorption resin,the purity of saponins raised to 83.4%and 86%.By HPLC,the result indicated that there was two types saponins in momordica charantia.
the stem and leaf of momordica charantia;saponins;extraction;purification
张玉婵(1983—),女(汉),在读硕士,研究方向:天然产物的提物与分离。
*通讯作者
2009-12-11
