光照强度和营养液电导率对微型水培菊花苗生长的影响
2010-12-05周庐萍崔永一
周庐萍,崔永一
(浙江农林大学 园林学院,浙江 临安 311300)
菊花Chrysanthemum×morifolium是世界上最受欢迎的切花和盆栽观赏植物之一。目前,菊花普遍采用的是扦插繁殖[1],经过几代后植株容易感染病毒,造成菊花苗品质下降,因此,用组培脱毒苗上的茎段进行扦插是常用的改良手段[2]。但高湿度、高糖分、密闭等组培环境不利于植株瓶外驯化[3],尤其在获得大量脱毒苗之后,如何在较短的时间内诱导出组培苗大量且优质的根系,对于提高菊花组培苗移栽成活率和改善菊花苗品质具有重要意义。新兴的微型水培系统技术(快繁和水培结合)是在溶液中提供了营养物质并且把透明塑料用作新容器的方法[4-5]。本实验研究了不同光照强度和营养液电导率对微型水培菊花苗营养液pH值、光合特性及生长情况的影响,为菊花苗微型水培技术研究提供了理论基础。
1 材料和方法
1.1 试验材料
供试材料为菊花品种‘黄连’Chrysanthemum×morifolium‘Huanglian’。2008年 4月在浙江林学院园艺实验室人工气候培养箱中进行。取健壮组培苗的茎段,用刀斜切为长约5 cm,分别将插穗基部用海绵包好后扦插于微型水培系统(规格为长 ×宽 ×高 =30 cm×25 cm×12 cm)。
1.2 试验处理
试验营养液采用日本园试液配方[6]。营养液电导率(electrical conductivity,EC,表示营养液浓度)设置为0.8,1.6,3.0 mS·cm-1;光照强度用光合作用光子流量(photosynthetic photon flux,PPF)表示,设置为 50,100,250 μmol·m-2·s-1。整个试验在人工气候培养箱中进行,温度控制在(24 ± 1)℃,相对湿度为80%左右,光照时间为14 h·d-1。每个微型水培系统上扦插20个插穗,各处理重复3次。扦插后每隔3 d测定营养液pH值与电导率,叶片光合速率、气孔导度和蒸腾速率分别在第1,4,7,14,21,28天测定。并调整营养液pH值和电导率与原始值一致。营养液的 pH值采用PHB21便携式pH计测定;电导率采用DDS211A型电导仪测定。采用美国(Li-Cor公司)Li-6400光合测定仪测定叶片光合速率、气孔导度和蒸腾速率。培养30 d后调查植株地上部分和地下部分及整株鲜质量、干质量,株高,根长,新叶数量。数据使用SAS统计软件进行分析。
2 结果与分析
2.1 不同光照强度和营养液电导率对微型水培菊花营养液pH值和电导率的影响
从图1中可以看出,不同光照强度下,营养液pH值均有变化。低光照强度下(50 μmol·m-2·s-1),pH 5.8附近小幅波动;中等光照强度下(100 μmol·m-2·s-1),营养液pH值处理第13天后变化幅度较前段时间大;高光照强度下(250 μmol·m-2·s-1),各处理pH值波动幅度最大,其中当营养液电导率为1.6和3.0 mS·cm-1时,营养液pH值降低幅度较大,处理第28天分别下降至3.8和3.9。这表明菊花在高光照强度下,生长代谢旺盛,水分的吸收打破了营养液中离子间的平衡,还可能与植株分泌较多有机酸类物质使得营养液pH值变化幅度较大。
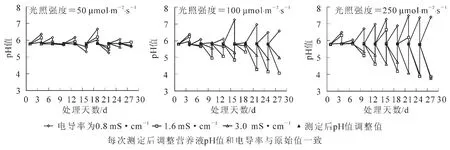
图1 不同光照强度和营养液电导率下微型水培菊花30 d内营养液中pH值变化Figure 1 Change of pH values of nutrient solutions during 30 days of microponic culture at different photosynthetic photon flux and electrical conductivity levels
如图2所示,各光照强度下,当原营养液电导率为3.0 mS·cm-1时,在处理后期营养液电导率都有小幅上升,且在低光照强度下(50 μmol·m-2·s-1),营养液电导率变化较平稳,高光照强度下(250 μmol·m-2·s-1),处理第 28天,营养液电导率上升到3.8 mS·cm-1。当原营养液电导率为0.8 mS·cm-1,则在高光照强度下,处理第16天后电导率有小幅下降。营养液电导率的变化表明了微型水培菊花对水分和营养物质吸收的不一致性。
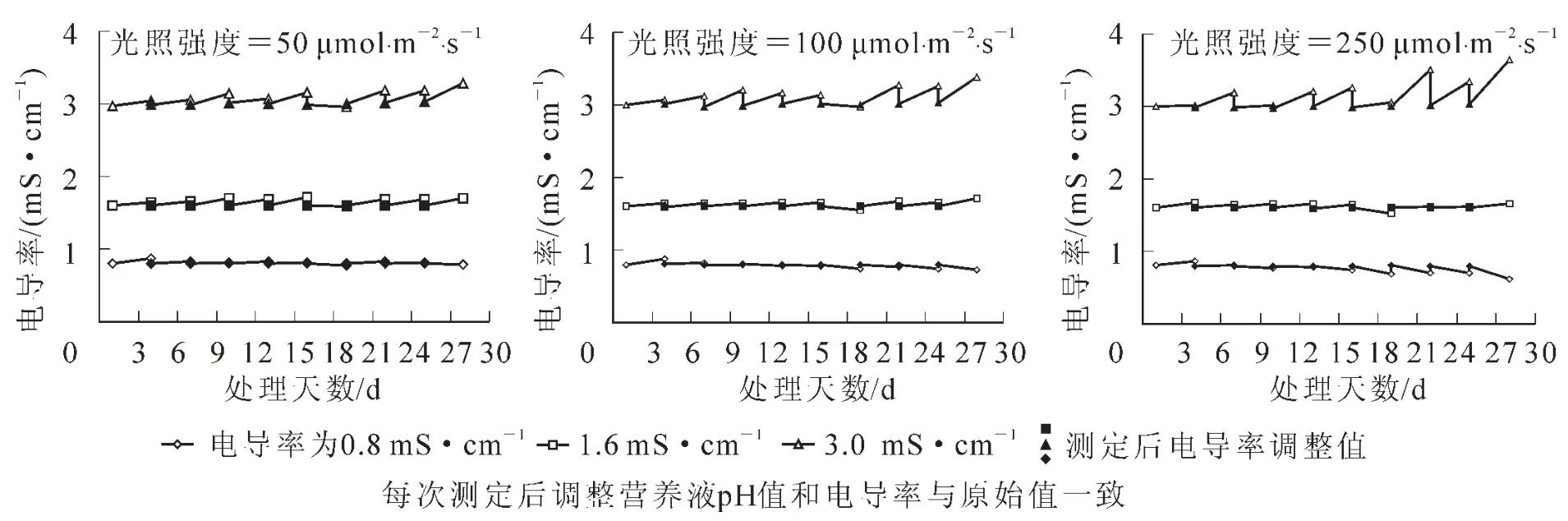
图2 不同光照强度和营养液电导率下微型水培菊花30 d内营养液电导率变化Figure 2 Change of electrical conductivity of nutrient solutions during 30 days of microponic culture at different photosynthetic photon flux and electrical conductivity levels
2.2 不同光照强度和营养液电导率对微型水培菊花生长量影响
由表1 可见,在高光照强度(250 μmol·m-2·s-1)和高营养液电导率(3.0 mS·cm-1)下,植株地上部分和地下部分及整株的鲜质量、干质量显著大于其他处理组,株高、根长、新叶数也显著高于其他处理;高光照强度下,各电导率处理组的生长指标均大于其他光照处理下植株;中等光照强度下,营养液电导率为1.6 mS·cm-1处理下,菊花苗整株的鲜质量、干质量及株高大于同等光照强度下其他营养液电导率值处理;当营养液电导率为0.8 mS·cm-1时,各光照强度下的菊花苗生长量均不具优势。这表明高光照强度和高营养液电导率有利于菊花种苗水分和养分的吸收,促进菊花苗的生长发育,但光照强度降低时高营养液电导率处理对菊花苗生长的促进作用不明显,相同营养液电导率处理下,提高光照强度对于微型水培菊花苗生长的影响较显著。

表1 菊花培养30 d后不同光照强度和营养液电导率对微型水培菊花生长的影响Table 1 Effect of photosynthetic photon flux and electrical conductivity levels on fresh and dry weight of chrysanthemum cuttings after 30 days of microponic culture
2.3 不同光照强度和营养液电导率对微型水培菊花光合速率、气孔导度和蒸腾速率的影响
处理第 7 天,各处理的光合速率都在 2 μmol·m-2·s-1附近(图 3),7 d 后,高光照强度(250 μmol·m-2·s-1)下,高营养液电导率(3.0 mS·cm-1)处理组光合速率上升幅度最大,第 28天达到最大值 8 μmol·m-2·s-1。低光照强度(50 μmol·m-2·s-1)下,各处理的光合速率增速最慢。从表1可看出,菊花在高光照强度和高营养液电导率处理下地下部分根系生长量显著增加,这与光合速率的增强正相关。

图3 不同光照强度和营养液电导率下微型水培系统中菊花30 d内光合速率的变化Figure 3 Change in CO2-uptake of the plantlet during 30 days of microponic culture at different photosynthetic photon flux and electrical conductivity levels
由图4可见,各处理组在处理第7天时,气孔导度有明显增幅。高光照强度(250 μmol·m-2·s-1)下,各处理在第14天均达到峰值,中等光照强度(100 μmol·m-2·s-1)下,气孔导度峰值显著降低,低光照强度(50 μmol·m-2·s-1)下,峰值最低。可以看出,提高光照强度可以使菊花气孔导度增加,气孔导度增加又可提高光合速率。

图4 不同光照强度和营养液电导率下微型水培系统中菊花30 d内气孔导度的变化Figure 4 Change in stomatal conductance of the plantlet during 30 days of microponic culture at different photosynthetic photon flux and electrical conductivity levels
高光照强度(250 μmol·m-2·s-1)下,各处理蒸腾速率第14天均达到最高峰,并且显著高于其他光照强度处理。各处理组蒸腾速率均在处理第7天时明显增加,随后各处理蒸腾速率下降到1.5 mol·m-2·s-1左右。第28天时,高光照强度下各处理的蒸腾速率恢复到较高水平(图5),表现出菊花蒸腾速率与气孔导度的变化呈正相关。提高光照强度可致菊花蒸腾速率增加,从而最终提高光合速率。
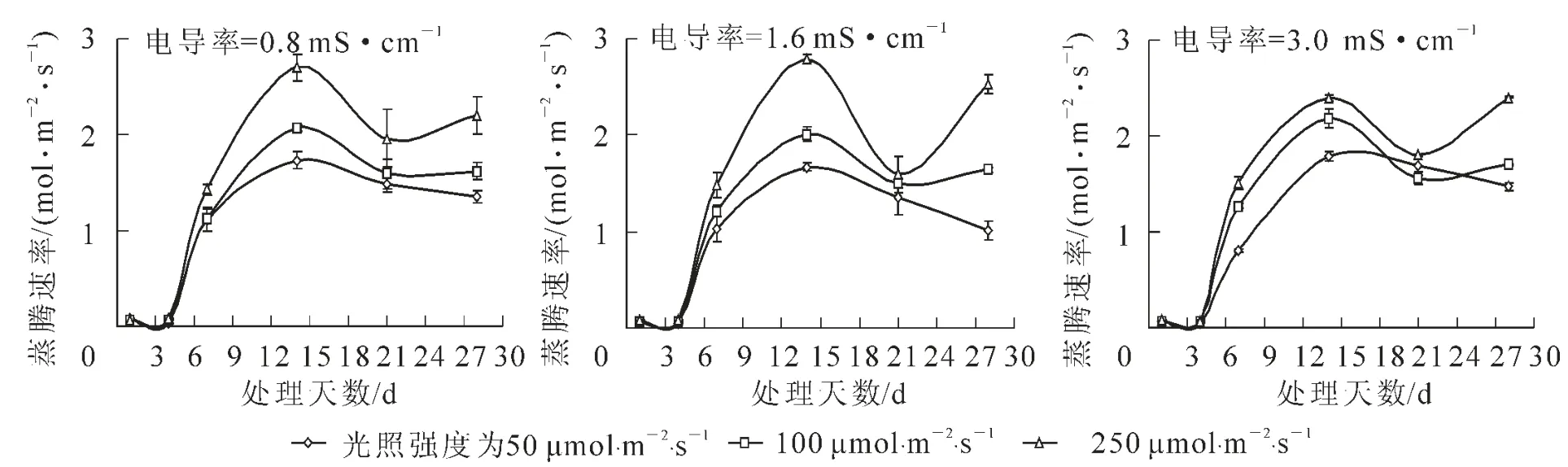
图5 不同光照强度和营养液电导率下微型水培系统中菊花30 d内蒸腾速率变化Figure 5 Change in transpiration of the plantlet during 30 days of microponic culture at different photosynthetic photon flux and electrical conductivity levels
3 结论与讨论
研究发现,营养液电导率值为3.0 mS·cm-1条件下,各处理的营养液pH值均偏低,微培一段时间后植物通过根系在吸收水分和营养的同时也与营养液进行其他物质交换,从而引起营养液酸碱度变化,同时植物根系为适应水培环境分泌氢离子或有机酸也可能造成营养液酸化,其具体机制有待进一步研究。一般认为水培营养液的pH 6.0~6.5最合适,若为pH 5.0~7.0,对生长无影响[7]。有报道含羞草Mimosa pudica在pH值偏酸性营养液中生长最优[8],这可能跟铁、钙、镁等矿质离子在酸性条件下利于植物吸收有关。营养液电导率可间接反映营养液使用前后的浓度变化,也同时表明植株对营养物质吸收的不一致性[9]。研究发现营养液电导率3.0 mS·cm-1条件下,菊花对养分需求提高,营养液电导率均有小幅上升。
本研究中,菊花扦插苗在高光照强度(250 μmol·m-2·s-1)和高营养液电导率(3.0 mS·cm-1)下,菊花地上部分和地下部分的生长量指标均显著优于其他处理,说明高光照强度和高电导率对微培菊花植株的生长发育是有利的,光照强度过低不利于植株进行光合作用进而影响其生长。而且光照强度和营养液电导率的不同,对微型水培菊花光合作用影响也不同。菊花在高光照强度下的光合速率、气孔导度、蒸腾速率增幅都最大,说明在较高光照强度下植株光合作用是增强的。Kozai等[10]报道,高光照强度对提高光合效率非常重要,Lee等[11]研究表明,北美枫香Liquidambar styraciflua组培苗如果在不超过最大光合速率的条件下增加光照强度至300~500 μmol·m-2·s-1能增强光合作用。关于微型水培技术下的组培菊花苗光合特性(光饱和点等)还有待研究。
[1]NISHIO J,FUKUDA M.Influence of temperature and rooting-promoter on the formation of root-primordia and on the rooting of chrysanthemum cuttings under storage[J].Res Bull Aichi-ken Agric Res Cent,1998,30:189-193.
[2]HUONG N T D,NHUT D T.Rapid propagation of Chrysanthemum indicum L.by meristem culture[J].J Biol,2004,26(4):45-48.
[3]KOZAI T.Micropropagation under photoautotrophic conditions[M]//DEBERGH P C,ZIMMERMAN R H.Micropropagation Technology and Application.Dordrecht:Kluwer,1991,447-469.
[4]DEWIR Y H,CHAKRABARTY D,ALI M B,et al.Effects of hydroponic solution EC,substrates,PPF and nutrient scheduling on growth and photosynthetic competence during acclimatization of micropropagated Spathiphyllum plantlets[J].Plant Growth Regul,2005,46:241-251.
[5]WU R Z,CHAKRABARTY D,HAHNE J,et al.Growth of Doritaenopsis in peat-substitute growing media[J].J Kor Soc Hort Sci,2005,46:76-81.
[6]马太和.无土栽培[M].北京:北京出版社,1985:1-5.
[7]徐志豪,张德威,ADAMS P.改善水培作物根际氧气供给的原理和实践[J].浙江农业学报,1994,6(1):44-48.XU Zhihao,ZHANG Dewei,ADAMS P.Improving aeration in hydroponics principle and practice[J].Acta Agric Zhejiang,1994,6(1):44-48.
[8]张仲新,方正,华珞,等.水培条件下营养液pH值对含羞草生长发育的影响[J].首都师范大学学报:自然科学版,2008,29(6):43-45.ZHANG Zhongxin,FANG Zheng,HUA Luo,et al.Effects of different pH on the growth and development of Mimosa pudica in hydroponics[J].J Capital Nor Univ Nat Sci Ed,2008,29(6):43-45.
[9]王华芳.花卉无土栽培[M].北京:金盾出版社,1997:75-111.
[10]KOZAI T,SEKIMOTO K.Effects of the number of air exchanges per hour of the closed vessel and the photosynthetic photon flux on the carbon dioxide concentration inside the vessel and the growth of strawberry plantlets in vitro[J].Environ Control Biol,1988,26:21-29.
[11]LEE N,WETZSTEIN Y,SOMMER H E,et al.Effect of quantum flux density on photosynthesis and chloroplast ultrastructure in tissue-cultured plantlets and seedling of Liquidambar styraciflua L.towards improved acclimatization and field survival[J].Plant Physiol,1985,78:637-641.
