壳聚糖与魔芋胶复合涂膜对杨梅常温贮藏的影响*
2010-11-28叶文斌郭守军杨永利潘显辉王军喜赵庆芳
叶文斌,郭守军,杨永利,潘显辉,王军喜,赵庆芳
1(西北师范大学生命科学学院,甘肃兰州,730070) 2(韩山师范学院生物系,广东潮州,521041)
壳聚糖与魔芋胶复合涂膜对杨梅常温贮藏的影响*
叶文斌1,郭守军2,杨永利2,潘显辉1,王军喜1,赵庆芳1
1(西北师范大学生命科学学院,甘肃兰州,730070) 2(韩山师范学院生物系,广东潮州,521041)
以壳聚糖和壳聚糖与魔芋胶的复配胶为涂膜基质,以大豆分离蛋白、甘油为成膜助剂,配制成复合涂膜保鲜剂,研究了常温(28~32℃),相对湿度68% ~86%下该复合涂膜保鲜剂对杨梅品质及其生理生化变化的影响。结果表明:常温下经壳聚糖及壳聚糖与魔芋胶复合涂膜保鲜剂涂膜保鲜的杨梅与对照组相比,果实裂果率、霉烂率、失重率明显降低,抑制了果实的呼吸率;有机酸、Vc等营养成分转化、流失的速度减慢,有效的降低MDA、花青素含量和相对电导率的升高;使PPO、POD、PAL酶活性处于较低的水平,延缓了果实的衰老,从而延长了其货架期。综合考虑,壳聚糖与魔芋胶复合涂膜保鲜剂的效果优于壳聚糖涂膜保鲜剂。
壳聚糖,魔芋胶,复合涂膜保鲜剂,杨梅,贮藏
杨梅[Myrica rubra(Lour.)Sieb.et Zucc.]属杨梅科杨梅属植物,是我国南方重要的亚热带特产果树,栽培历史悠久,主要分布于长江流域以南各地。近年来,随着我国农业产业结构的调整和山区的综合开发,杨梅的种植面积迅速扩大,已成为山区农民致富的重要经济树种之一[1]。杨梅果实由肉柱聚合而成,柔软多汁,无外果皮保护,易受机械伤、长霉、腐烂,有“一日色变,二日味变,三日色味皆变”的说法[2]。席屿芳[3]等研究指出,杨梅果实在 20 ~22 ℃下只能保存3 d,10~12℃下可保存5~7 d,0~2℃下保存9~12 d。因此开发成本低、无污染、无公害和操作简便的常温保鲜技术,扩大市场销路,显得尤为重要。
本实验以壳聚糖及壳聚糖与魔芋胶复配胶为涂膜基质,添加其他涂膜助剂,配制成复合涂膜保鲜剂,在常温下对杨梅进行涂膜保鲜,通过测定感官指标和有机酸、花青素、Vc、可溶性固形物等品质指标以及呼吸强度、丙二醛(MDA)、过氧化物酶(POD)、多酚氧化酶(PPO)和苯丙氨酸解氨酶(PAL)活性等生理生化指标,研究保鲜剂涂膜对杨梅的保鲜效果;同时通过扫描电镜观察膜的表面形貌,初步探讨壳聚糖与魔芋胶保鲜膜的保鲜机理。
1 材料与方法
1.1 材料与试剂
杨梅,2009年4月下旬采自潮州市磷溪镇的乌酥梅,采后挑选大小均匀成熟度相同,无机械损伤,颜色鲜艳,无病虫害的果实放入用杨梅枝叶垫过的竹篮中运回实验室;壳聚糖、魔芋胶、大豆分离蛋白(均购自食品添加剂公司)。
1.2 仪器与设备
JSM-6360LA扫描电子显微镜,JEOL公司;AUW120岛津天平,SHIMADZU公司;HWF-1型红外二氧化碳分析仪,金坛市现代仪器厂;WYA阿贝折光仪,上海精密科学仪器有限公司物理光学仪器厂;TDL-60B低速台式离心机,上海安亭科学仪器厂;WFJ7200可见光分光光度计、UV-2800型紫外可见光分光光度计,上海尤尼柯仪器有限公司;DDS-320型电导仪,上海大普仪器有限公司;PHS-3C精密酸度计上海红益仪器仪表有限公司。
1.3 实验方法
1.3.1 涂膜保鲜剂的配方
配方1:0.3%(壳聚糖∶魔芋胶∶大豆分离蛋白质量比=1∶1∶1)+体积分数1%甘油,定容至500 mL备用;
配方2:1%壳聚糖+1%甘油,定容至500 mL备用。
按配方1分别称取0.5 g壳聚糖、0.5g魔芋胶、0.5 g大豆分离蛋白,按配方2称取5 g壳聚糖分别加入400 mL蒸馏水,在磁力搅拌器上60℃加热溶解6 h,再加入涂膜助剂5 mL甘油,用蒸馏水加热搅拌均匀定容至500 mL,凉至37℃备用。
1.3.2 涂膜
取新鲜杨梅在新配制的保鲜剂中浸1 min后取出,晾干,放入铺有纱布的筛篮中,根据指标测定分篮编号,每篮100个,重复3次,室内常温贮藏(温度28~32℃,相对湿度68% ~86%),每天随机取样10~12个进行生理生化指标测定分析,以没有涂膜的杨梅为对照组(CK)。
1.3.3 电镜观察
将多糖复合涂膜保鲜剂制成薄膜,真空喷金后用扫描电镜观察膜的表面形貌。
1.4 品质指标的测定
1.4.1 失重率测定采用称重法测定[4]
失重率/%=(失重质量/原质量)×100
1.4.2 好果率、裂果率和霉烂率的测定
好果率=(好果个数/调查总果数),裂果率/%=(裂果个数/调查总果数)×100,裂果判断标准为:裂缝长度长于10 mm,宽度大于3 mm时,视为为裂果;霉烂率/%=(霉烂果个数/调查总果数)×100,霉烂果判断标准为:霉斑大于10 mm时,则认定为果实为霉果,果实有大量汁液渗出、有浓厚异味即视为烂果。
1.4.3 Vc含量和有机酸含量[5]
采用2,6-二氯酚靛酚滴定法测定;用0.1mol/L NaOH滴定法测定(以柠檬酸计)。
1.4.4 可溶性固形物
WYA阿贝折光仪,结果直接由折光仪的读数得出[6]。
1.4.5 花青素含量[7]
取0.5 g果肉,加入0.1mol/L的 HCl 10 mL,研磨至匀浆,密封于32℃水中保温5 h后,过滤,滤液在535 nm处测吸光度,以0.1mol/L的HCl为空白,将吸光度A535=0.1的花青素溶液称为1个色素浓度单位,色价=(实测吸光度×10)/样液质量。
1.5 生理生化指标的测定
1.5.1 呼吸强度的测定
将果实准确称量后装入密闭的容器中,于室温静置30 min后,采用红外线CO2分析仪测定[8]。
1.5.2 相对电导率[8]和丙二醛(MDA)含量测定
取5颗杨梅,精确称重,用蒸馏水和重蒸水各冲洗3s,放入500 mL烧杯,加400 mL重蒸水,浸泡30 min,测电导率,煮沸10 min,用重蒸水补至之前水量,冷却至室温,测电导率,计算出相对电导率/%=[煮沸前电导值/(煮沸后电导值×质量)]×100;MDA含量测定时将果肉匀浆后,提取液以4 000 r/min离心10 min,上清用硫代巴比妥酸法测定[9]。
1.5.3 多酚氧化酶(PPO)、过氧化物酶(POD)和苯丙氨酸解氨酶(PAL)活性
方法见参考文献[10]。
2 结果与分析
2.1 多糖复合涂膜保鲜剂对杨梅外好果率、裂果率和霉烂率的影响
杨梅在成熟前后极易发生裂果,裂果部位易受微生物感染发生霉烂,影响果实外观、品质及商品价值。由图1可知,随着贮藏时间的延长,好果率逐渐降低,但2组涂膜组降低的幅度均明显低于对照组。对照组在第5天时的好果率仅为42%,而经过配方1和配方2涂膜处理的好果率为76%和58%;到第6天时对照组和涂膜处理的好果率分别为36% 、70%和38%,由此可见,经涂膜处理的杨梅好果率均高于对照组,其中配方1的效果优于配方2。
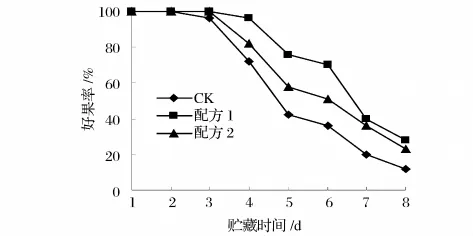
图1 杨梅在贮藏期间好果率的变化
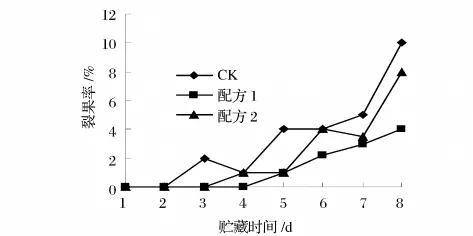
图2 杨梅在贮藏期间裂果率的变化
从图2和图3可知,涂膜组的裂果率和霉烂率均明显低于对照组。主要是由于涂膜处理降低了果实水分的变化幅度和被微生物感染的机率,裂果减少从而抑制霉烂。贮藏第6天时,对照组霉果率已达到18%,而配方2涂膜的为14%,配方1涂膜的仅为9% 。贮藏第8天,配方1和配方2涂膜的霉果率为18%和20%,对照组已达到37%;贮藏第8天时对照组裂果率已达到10%,配方1和配方2涂膜的裂果率为4%和8%。说明2组复合膜都具有保护作用,使杨梅不易受微生物感染,大大减少了霉菌等微生物引起的腐烂,可以延缓杨梅果实的后熟软化和防止霉变的进程。因此经2种多糖复合保鲜剂涂膜处理均可有效的保持果实的外观和生理品质。
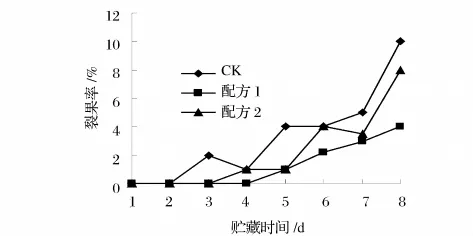
图3 杨梅在贮藏期间霉烂率的变化
2.2 多糖复合涂膜保鲜剂对杨梅失重率和呼吸强度的影响
由图4可知,随着贮藏时间的延长,杨梅果实失重率逐渐增加;2组配方涂膜的失重率均小于对照组,贮藏第8天时对照组的失重率达到37%左右,2组涂膜的失重率都在22%左右。由于杨梅经涂膜处理后,在果实表面形成一层较为致密和均匀的薄膜,降低了透氧和透水性,使得果实的蒸腾作用和呼吸作用受到抑制,水分不易散失,自身有机物消耗量相对减少。

图4 杨梅在贮藏期间的失重率变化
杨梅属于非跃变型果实,但其采后呼吸强度较高。胡西琴等研究表明,在(21±1)℃的贮藏温度下,杨梅出现了呼吸高峰和乙烯释放高峰,表现出某些呼吸跃变型果实的特征[11]。由图5知,在采摘后贮藏过程中会有明显的后熟过程,在2~5 d,对照组伴随着呼吸高峰的出现,果实很快衰老、腐烂。保鲜剂涂膜处理后呼吸速率明显被抑制,呼吸强度始终处于较低水平,变化幅度小,未见明显呼吸高峰,贮藏6~8 d呼吸增强变化幅度较大,这可能与果实贮藏后期的微生物大量繁殖,与腐烂果的增加有关。
2.7 多糖复合涂膜保鲜剂对杨梅Vc和有机酸含量的影响
Vc是果实营养主要成分之一,同时也是果实内清除活性氧的一种重要的抗氧化剂,且在贮藏运输过程中极易受到抗坏血酸氧化酶氧化[13],所以其含量可以作为杨梅在贮藏过程中品质变化的指标。由图6知,贮藏期间,杨梅果实Vc含量总体都呈下降的趋势,但涂膜处理的Vc含量下降趋势较平缓,而对照组则在第4天时Vc含量明显降低,7~8 d趋势变缓。配方1和2涂膜处理Vc的含量从最初52.85 mg/100 g下降到第7天的37.71和33.56 mg/100 g左右,而同期对照组Vc含量减少到23.41 mg/100 g。表明涂膜处理能显著抑制杨梅果实Vc含量的下降,使果实在贮藏后期能保持较高的Vc含量。

图5 杨梅在贮藏期间呼吸强的变化
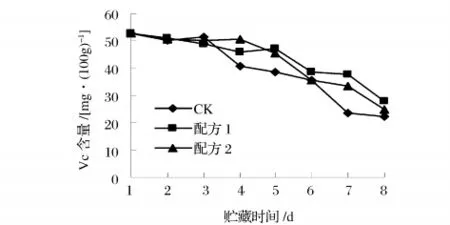
图6 杨梅在贮藏期间Vc含量的变化
由图7知,贮藏前期,对照组果实的有机酸含量呈逐渐增加趋势,第3 d达到最大值1.50%,到第8 d急剧下降到0.32%,配方1和2涂膜处理的有机酸含量为0.68%和0.54%。配方1涂膜处理在第5 d时的有机酸含量低于对照组,可能是杨梅果实取样时个体差异而导致的。但2组涂膜处理的有机酸含量总体趋势在保鲜期间都高于对照。原因可能是在保鲜过程中,后熟果实中有机酸积累,出现呼吸高峰,总酸作为呼吸基质而消耗,呈下降趋势;但涂膜组有机酸含量下降速度明显低于对照组,表明涂膜保鲜剂对杨梅的有机酸含量起到较好的保持作用。
2.4 多糖复合涂膜保鲜剂对杨梅可溶性固形物和花青素含量的的影响
可溶性固形物是水果品质的一项重要指标,随着果实的成熟,果实内的各种有机物和相关酶活性发生变化,可溶性固形物含量增加,淀粉分解转变为糖,果实也随之软化[13]。由图8知,整个成熟过程中,涂膜处理后可溶性固形物含量增加的速率持续低于对照组,说明经保鲜剂涂膜处理能延缓果实贮藏期可溶性固形物含量的升高,减慢了果实后熟的进程。贮藏第7 d配方2涂膜可溶性固形物含量维持在8.38%左右,配方1也接近对照的11%左右,这种延缓不会影响果实风味,有利于果实的贮藏和保鲜。
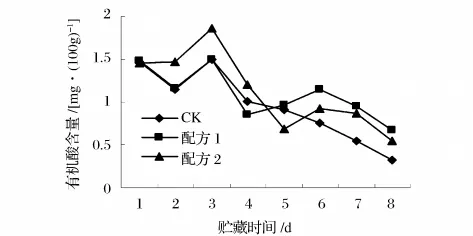
图7 杨梅在贮藏期间有机酸含量的变化

图8 杨梅在贮藏期间可溶性固形物的变化
杨梅果实成熟过程中最明显的变化是外观色泽的变化,花青素含量随着果实成熟度的提高快速积累[12]。可以用花青素含量来判断在保鲜过程中杨梅成熟的程度。由图9可知,保鲜第3天,对照杨梅果实花青素色价从33.54上升到49,配方1涂膜后果实花青素从色价34.52降低到32.8。随着保鲜时间的延长成熟度也在增加,杨梅果实花青素逐渐升高,但对照组整体趋势要高于涂膜处理,说明多糖涂膜对杨梅成熟有抑制作用,而且对果实中花青素合成有一定的抑制作用,但抑制合成作用有限,其机理有待于进一步研究。
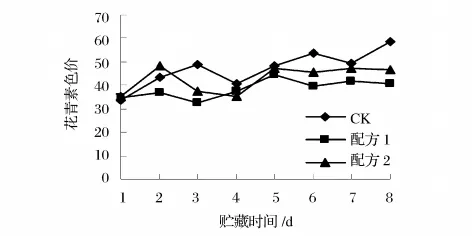
图9 杨梅在贮藏期间花青素含量的变化
2.5 多糖复合涂膜保鲜剂对杨梅相对电导率和MDA含量的影响
由图10可知多糖涂膜处理明显抑制了杨梅果实相对电导率的上升过程,保鲜前3 d对照组果实相对电导率与涂膜组果实无明显差异。此后,对照组果实的相对电导率上升速率明显高于涂膜处理的果实,第6天配方1和2处理的相对电导率分别为15.26和21.13,对照组已经达到42.81。结果表明涂膜处理有助于降低果实膜透性,增强膜的保护作用,提高果实耐贮性。
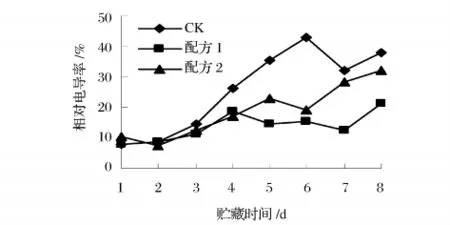
图10 杨梅在贮藏期间相对电导率的变化
MDA是具有细胞毒性的膜脂过氧化产物,反映细胞膜脂过氧化程度,也间接反映细胞损伤的程度。图11可知,随着保鲜时间的延长,3组MDA含量均呈上升趋势,贮藏后期,MDA含量增加的速度加快,说明膜脂过氧化程度加剧,果实逐渐衰老。在相同的时间内,涂膜组MDA含量保持在一个相对较低的水平,直到第7 d才有较大幅度的提高。多糖涂膜处理后MDA含量的增加速率明显低于对照组,因此多糖涂膜保鲜剂对果实中MDA的积累可起到一定的抑制作用,使其维持在较低水平,以此来保护细胞膜系统,延缓果实的衰老。
2.6 多糖复合涂膜保鲜剂对杨梅 PPO、POD和PAL酶活性影响

图11 杨梅在贮藏期间MDA含量的变化
从图12可以看出,对照组杨梅果实在贮藏一周内PPO活性在1~4 d内急剧升高,4~7 d之间PPO活性急剧降低,升至最高时果实颜色严重褐变,果实也失去原来味道。而涂膜处理的果实PPO酶活性在贮藏前期也有升高趋势,但都明显低于对照。说明涂膜处理在一定程度上可抑制PPO酶的活性,减缓杨梅褐变的速度,延长杨梅的贮藏时间。
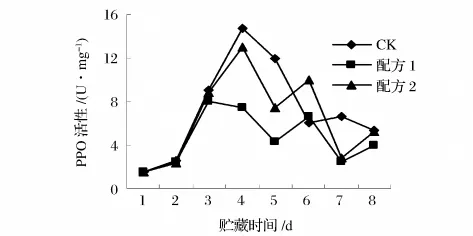
图12 杨梅在贮藏期间的PPO变化
POD是植物细胞内的保护酶,可以清除植物体内氧自由基。从图13可以得知,在贮藏期间对照组杨梅的POD活性在第2天就达到了最高活性,这样就会导致果实活性氧增多,启动膜质过氧化,从而破坏果肉细胞膜的结构;多糖涂膜处理的POD活性一直比对照组低,说明多糖涂膜有效的抑制了POD的活性,减缓衰老,起到了耐贮藏的作用。

图13 杨梅在贮藏期间的POD变化
PAL酶活性可作为植物抗逆境能力的一个生理指标。由图14可知,在保鲜期间PAL酶活性在第3天达到最高,然后逐渐降低,但在多糖涂膜处理下的PAL酶活性均比对照组低说明多糖涂膜对PAL酶活性有一定的抑制作用,使PAL酶活性保持在较低的水平,减少了次级代谢产物的产生,延缓杨梅果实的衰老。

图14 杨梅在贮藏期间的PAL变化
2.7 多糖复合涂膜保鲜剂成膜电镜观察

图15 复合膜的扫描电镜图
壳聚糖保鲜剂成膜其形貌扫描电镜结果如图15-a所示。由无数“絮状线团”形结构紧密的排列在一起,整体交联呈网状,表面不光滑。“絮状线团”形结构平均直径2~3 μm,“絮状线团”形结构之间平均间距约为1 μm。壳聚糖与魔芋胶及大豆分离蛋白复配,所成保鲜剂成膜其形貌扫描电镜结果如图15-b所示,2种来源不同的多糖分子间发生相互作用,形成稳定、光滑、致密的三维网状结构,处于协效凝胶状态,成膜表面光滑完整、结构致密没有间隙,说明此复合膜的弹性和刚性较好。
3 讨论和结论
3.1 多糖复合涂膜保鲜剂对杨梅外观品质与生理指标的影响
杨梅经配方1和配方2两种配方多糖复合保鲜剂涂膜后对杨梅都起到了很好的保鲜效果。多糖复合涂膜保鲜剂在果实表面形成一层致密、较为均匀的可食性半透膜,封闭了肉柱果实上的气孔,一定程度上抑制了果内、外气体交换,使果实内部形成一种低O2分压、高CO2分压的小环境,起到气调作用,从而抑制了果实的呼吸强度[8];果实水分散失减少,贮果的失重率降低;裂果、霉变的发生减少,软熟、腐烂的时间推后;果实内可溶性固形物的增加速度减缓,有机酸、Vc等营养成分转化、流失的速度降低;MDA的积累受限,相对电导率维持在相对较低的水平。有效地延缓了果实的成熟衰老,使杨梅贮藏期延长了3~4 d。
3.2 多糖复合涂膜保鲜剂对杨梅生化指标的影响
PPO是果蔬引起酶促褐变的主要酶类,在O2存在的条件下,催化果蔬原料中的内源性多酚物质氧化聚合生成黑色素,会导致出现组织的褐变和果实的色变,严重影响果实的营养,风味及外观品质。杨梅经2种配方多糖复合保鲜剂涂膜后杨梅果实PPO活性与对照相比明显低于对照,说明多糖涂膜处理在一定程度上可抑制PPO的活性,减缓杨梅褐变的速度,延长杨梅的贮藏时间;多糖涂膜处理的POD活性一直维持在相对较低的水平,说明多糖涂膜有效的抑制了杨梅果实启动膜脂过氧化而破坏膜系统的能力,促进杨梅自身有效清除体内产生的自由基,减缓衰老,起到了耐贮藏的作用;PAL活性在多糖涂膜处理下活性均比对照组低,这可能与保护系统产生的次级代谢产物积累有关,说明多糖涂膜对PAL活性有一定的抑制作用,使PAL活性保持在较低的水平,减少次级代谢产物,延缓杨梅果实的成熟与霉变。通过多糖复合涂膜保鲜剂对杨梅的处理有效地维持保护酶PPO、POD和PAL酶的活性处于较低的水平,进而达到防止杨梅果实腐烂、延缓果实的衰老、保持品质的效果,起到了较好的保鲜与贮藏作用。
3.3 多糖复合涂膜的保鲜机理的初步探讨
通过扫描电子显微镜的观察发现,配方1和配方2的复合膜在结构上有一定的差异,后者的结构更致密,其配方1的贮藏效果优于配方2。其机理可能是壳聚糖保鲜剂所形成膜的“絮状线团”形结构之间界限分明,彼此之间存有间隙,使其易于气体交换和水分的透过;而壳聚糖与魔芋胶复配的复合膜保鲜剂,由于两者不同来源多糖的精细结构不同,多糖分子间发生相互作用,形成稳定、光滑、致密的三维网状结构,从而使复合多糖呈现出独特的保水性质和抑制呼吸的功能,更好的增强了果实内部水分的扩散,阻碍气体分子的透过。同时起到减少果实内物质转化和呼吸基质的消耗、隔离致病微生物的侵染、延缓衰老和防止腐烂变质,达到保鲜和耐储藏的目的。
利用可食用多糖研制保鲜剂进行果蔬保鲜与贮藏,实用、方便而且保鲜效果好,操作工艺简单、成本低、易降解、对环境无污染,绿色环保,是果蔬和其他食品保鲜贮藏中具有广泛应用前景的一条新的途径。
[1] 高雪.杨梅果实采后贮运影响因素与保鲜技术研究进展[J].现代农业科技,2009,37(7):9-10.
[2] 郑勇平.生态经济林丛书-杨梅[M].北京:中国林业出版社,2002.
[3] 席屿芳,郑永华,钱冬梅,等.温度对杨梅果实采后营养物质变化和腐烂的影响[J].科技通报,1993,9(4):254-256.
[4] 刘志芳,张玮,武治昌,等.薄膜包装冷藏对鸡腿蘑采后生理变化的影响[J].食品与发酵工业,2009,35(3):195-198.
[5] 徐莉,王庆国.切割牛蒡保鲜技术的研究[J].食品与发酵工业,2006,32(6):147 -151.
[6] 张绵松,王海鸥.几种蛋白酶对文蛤肉的水解效果[J].食品与发酵工业,2008,34(2):83 -86.
[7] 王昕,李建桥,任露泉.果蔬可食涂膜保鲜的应用和发展[J].农业工程学报,2004,20(2):284-287.
[8] 李素清,索文,樊高琼,等.鲜切富贵等采用生理特性的研究[J].食品与发酵工业,2007,33(7):157 -161.
[9] 孔秋莲.青花菜采后保鲜技术研究[J].保鲜与加工,2001(6):11-13.
[10] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:34-36.
[11] 李家庆.果蔬保鲜手册[M].北京:中国轻工业出版社,2003:115-117.
[12] 谢培荣,马小华,欧阳菊英.采收成熟度对木洞杨梅贮藏品质的影响[J].湖南农业科学,2009,36(3):89-91.
[13] Lahoz J M,Gutierrez M,Delmarsola M,et al.Ethylene in cherimoya fruit(Annono cherimola Mill.)under different storage conditions[J].Journal of Agricultural and Food Chemistry,1993,41(5):721 -723.
Study on Preservation of Myrica rubra with Compound Coating Antistaling Agent of Chitosan and Konjac Gum at Room Temperature
Ye Wen-bin1,Guo Shou-jun2,Yang Yong-li2,Pan Xian-hui1,Wang Jun-xi1,Zhao Qing-fang1
1(College of Life Science,Northwest Normal University,Lanzhou 730070,China)2(Department of Biology,Hanshan Normal University,Chaozhou 521041,China)
In this study,the preservation effects of compound coating antistaling agent of polysaccharide on Myrica rubra at room temperature(28~32℃)and relative humidity(68% ~86%)were investigated.The antistaling agent was composed of Chitosan with konjac gum for the coating matrix,glycerin and the protein isolated from soy as film-forming additives.The results showed that compared with the control group at room temperature,the rotten fruit rate and cracking fruit rate and weightloss rates of the Myrica rubra preserved by the compound coating antistaling agent of edible polysaccharide are lowed obviously,inhibited the respiration rate and the content of total Vc and organic acids and other nutrients conversion,and the MDA,anthocyanin content and the increase of relative conductivity effectively reduced.so that PPO,POD,PAL enzyme activity at a relatively low level,and the senescence process is restrained during storage and the shelf life was extended.In this study the compound coating antistaling agent of chitosan with konjac gum treatment for Myrica rubra storage effect is superiored chitosan.
chitosan,konjac gum,compound coating antistaling agent,Myrica rubra,preservation
硕士研究生(赵庆芳教授为通讯作者)。
*国家星火计划“新型可食性复合涂膜保鲜剂的研制及在番荔枝保鲜中的应用研究”(2006EA780088);广东省科技厅计划项目“可食性复合中草药涂膜保鲜剂的研制及其在杨梅保鲜中的应用研究”(2007B080701046)。
2010-01-22,改回日期:2010-06-09
