钯/Dabco体系催化芳基膦酸酯的合成
2010-11-26朱茂根沈栋国徐广宇
朱茂根,沈栋国,叶 柳,徐广宇
(湖南师范大学化学化工学院, 中国 长沙 410081)
芳基膦酸酯是一类重要的具有生理活性的医药有机中间体[1],很多生物活性物质含有芳基膦酸酯结构[2].工业上,它可用作阻燃剂,聚合物添加剂.农药方面的研究表明其具有较强的杀虫活性[3].目前已应用于芳基膦酸酯合成方法主要包括:(1)碘代芳烃与亚磷酸二烷基酯的Na或K盐发生光引发反应[4];(2)电化学氧化法合成芳基膦酸酯[5];(3) 阴离子磷-Fries重排法[6];(4) 芳基自由基与亚磷酸三烷基酯反应[7];(5)过渡金属催化碳-磷键的交叉偶联反应.其中以过渡金属催化的交叉偶联反应研究最多,研究成果也最显著,包括铜催化[8]、Mn(Ⅱ)/Co(Ⅱ)/O2催化[9]、Ni催化[10]以及钯催化[11].但这中间存在不少需要改进的地方,如使用了价格昂贵,高污染的含膦配体,或者是使用了毒性较大的有机溶剂,以及部分芳基杂原子化合物的产率较低等[12].近年来的研究表明[13],胺类化合物可以作为高效的配体应用于偶联反应中,其中Dabco(1,4-二氮双环[2,2,2]辛烷,俗称:三亚乙基二胺)已经作为一种既便宜又高效的配体成功地应用于钯催化的碳-碳键的交叉偶联反应中[14-15],它具有毒性小,容易操作且催化效果较好等特点. 作者对Pd(OAc)2/Dabco作为催化体系优化芳基膦酸酯的偶联合成条件进行了研究.
1 实验部分
1.1 试剂与仪器
所有试剂和催化剂均为分析纯.熔点由YRT-3熔点仪测定.所有1H NMR 和13C NMR 谱由500 MHz超导傅立叶变换核磁共振仪测定(德国Bruker 公司),内标为TMS,溶剂为CDCl3.质谱由GC-MS QP2010(Shimadzu)测定.
1.2 制备的一般方法
在Schlenk管中加入4.6 mg (0.02 mmol) Pd(OAc)2,4.6 mg (0.04 mmol)Dabco和1 mL 溶剂,在室温下搅拌10 min,待Pd(OAc)2与Dabco形成稳定的黄色络合物后,加入1 mmol 对卤代芳烃1和152 mg (1.1 mmol) 亚磷酸二乙酯2和2 mmol 的碱,加入4 mL 溶剂,抽成真空,充氩气保护,110~115 ℃油浴加热搅拌反应.TLC监测反应进展,待反应完全后冷却,抽滤,旋转蒸发仪抽除溶剂后,残余物用EtOAc溶解,水洗(3×10 mL), 水洗液用EtOAc萃取3次,合并有机相,无水Na2SO4干燥,减压浓缩.最后用硅胶层析柱分离(干法上柱,梯度洗脱,洗脱剂的极性由PE∶EtOAc=1∶2到1∶6),得产物3.
1.3 典型产物结构分析
4-甲氧基苯基膦酸二乙酯(3a):淡黄色液体,1H NMR (CDCl3) δ:1.32 (t,J=8.0 Hz, 6 H), 3.05 (s, 3H), 3.84~4.12 (m, 4H), 6.94~6.97 (m, 2H), 7.71~7.76 (m, 2H);13C NMR(125 MHz, CDCl3) δ:14.1 (d,J= 6.5 Hz), 53.4, 68.2 (d,J= 5.1 Hz), 126.4, 128.8, 130.8, 132.4, 137.8, 167.7;31P NMR (202 MHz, CDCl3) δ:17.60; MS (EI, 70 eV):m/z (%) = 244 (M+,42).
4-甲基苯基膦酸二乙酯(3b):淡黄色液体,1H NMR(CDCl3) δ:1.26 (t,J= 7.0 Hz, 6H), 2.33 (s, 3H), 3.96~4.08 (m, 4H), 7.19~7.21 (m, 2H), 7.60 (dd,J=8.0, 13.5 Hz, 2H);13C NMR(125 MHz, CDCl3) δ:16.3(d,J= 6.5 Hz), 21.6, 62.0(d,J= 5.1 Hz), 125.8(d,J= 63.9 Hz), 129.1, 129.3, 131.8, 131.9,143.0 (d,J= 2.9 Hz);31P NMR(202 MHz, CDCl3):δ=19.53; MS(EI,70 eV):m/z (%) = 228 (M+,32.7), 91(100).
4-乙酰基苯基膦酸二乙酯(3d):淡黄色液体,1H NMR (CDCl3) δ:1.35 (t,J= 8.0 Hz, 6H), 2.64 (s, 3H), 4.06~4.22 (m, 4H), 7.88~7.96 (m, 2H), 8.01~8.05 (m, 2H).
噻吩-2-膦酸二乙酯(3f):棕黄色液体,1H NMR (CDCl3) δ:1.37 (t,J= 6.0 Hz, 6H), 4.06~4.22 (m, 4H), 7.16~7.20 (m, 1H), 7.65~7.72 (m, 2H);13C NMR (100 MHz, CDCl3) δ:16.2, 63.6, 128.2, 133.3, 136.6;31P NMR (202 MHz, CDCl3):δ:11.98; MS(EI, 70 eV):m/z (%) = 220 (M+, 25), 84(100).
噻吩-2-膦酸二异丙酯(3g):红棕色液体,1H NMR(CDCl3) δ:1.27(d,J= 6.0 Hz, 6H), 1.38 (d,J= 6.0 Hz, 6H), 4.69~4.71 (m, 2H), 7.15~7.16 (d,J= 5.2 Hz, 1H), 7.64~7.67 (m, 2H);13C NMR (100 MHz, CDCl3) δ:23.7, 23.8, 23.9, 24.0, 73.2, 71.4, 127.7, 128.0, 133.0, 136.3; MS(EI, 70 eV):m/z(%) = 248(M+, 19), 206 (31), 191(21), 165(100), 147(57).
吲哚-6-膦酸二乙酯(3h):深黄色黏稠液体,1H NMR (CDCl3) δ:1.29~1.33 (t, 6H), 4.01~4.17 (m, 4H), 6.58~6.60 (m, 1H), 7.39~7.47 (m, 1H), 7.70~7.74 (m, 1H), 8.16~8.22(m, 1H), 9.67(s, 1H).
喹啉-3-膦酸二乙酯(3i):无色液体,1H NMR(CDCl3) δ:1.39 (dt,J= 0.4, 9.6 Hz, 6H), 4.10~4.31 (m, 4H), 7.62~7.68 (m, 1H), 7.84~7.94 (m, 1H), 8.19 (dd,J= 0.8, 11.2 Hz, 1H), 8.69~8.70 (m, 1H), 8.74~8.75 (m, 1H), 9.17 (dd,J= 2.4, 6.0 Hz, 1H);13C NMR (100 MHz, CDCl3) δ:16.4 (d,J= 6.0 Hz), 62.8 (d,J= 5.3 Hz), 119.3, 125.1, 126.9, 128.1, 129.4, 130.7, 136.4, 147.7, 151.7;31P NMR (202 MHz, CDCl3) δ:19.51; MS (EI, 70 eV):m/z (%) = 265 (M+, 73), 265 (24), 236 (46), 209 (91), 193 (63), 156 (100), 129 (75), 101 (51).
6-甲氧基吡啶-3-膦酸二乙酯(3j):淡黄色液体;1H NMR (CDCl3) δ:1.35 (t,J= 9.0 Hz, 6H), 4.00 (s, 3H), 4.06~4.19 (m, 4H), 6.80 (dd, J =3.0, 10.5 Hz, 1H), 7.90~7.96 (m, 1H), 8.59 (dd,J= 2.5, 9.0 Hz, 1H);13C NMR (125 MHz, CDCl3) δ:16.3 (d,J= 6.9 Hz), 53.8, 62.2 (d,J= 5.3 Hz), 111.1 (d,J= 3.0 Hz), 117.7, 141.4 (d,J= 9.9 Hz), 151.5 (d,J= 14.5 Hz), 166.4;31P NMR (202 MHz, CDCl3) δ:17.60; MS (EI, 70 eV):m/z (%) = 245 (M++1, 87), 216(100), 172(91).
吡啶-3-膦酸二乙酯(3k):褐色液体;1H NMR (CDCl3) δ:1.38 (t,J= 10.0 Hz, 6H), 4.09~4.24 (m, 4H), 7.27~7.44 (m, 1H), 8.08~8.15 (m, 1H), 8.76~8.79 (m, 1H), 8.80~8.99 (m, 1H).
6-氨基吡啶-3-膦酸二乙酯(3m):褐色固体; mp 108℃;1H NMR (CDCl3) δ:1.34 (t,J= 7.0 Hz, 6H), 4.04~4.15 (m, 4H), 4.98 (brs, 2H), 6.54 (dd,J= 2.5, 8.5 Hz, 1H), 7.78 (td,J= 2.0, 8.5 Hz, 1H), 8.45 (d,J= 6.5 Hz, 1H);13C NMR (125 MHz, CDCl3) δ:14.3 (d,J= 6.4 Hz), 61.5 (d,J= 5.7 Hz), 119.0 (d,J= 13.7Hz), 129.4 (d,J= 28.1 Hz), 138.4 (d,J= 236.0 Hz), 139.4, 145.3(d,J= 3.1Hz);31P NMR (202 MHz, CDCl3):δ:18.80; MS (EI, 70 eV):m/z (%) = 230 (M++1, 46), 202 (55), 185 (14), 174 (100), 158 (80), 157 (65), 121 (30), 94 (90).
2 结果与讨论
2.1 不同条件下钯催化芳基膦酸酯的合成研究
首先选取对甲氧基溴苯(1 mmol)和亚磷酸二乙酯(1.1 mmol)为底物的反应模型,寻找C-P偶联反应的最佳条件,实验结果见表1.
选取Pd(OAc)2为Pd源,在不加入Dabco配体时,使用K2CO3为碱丙酮为溶剂,虽然也能得到目标产物,但产率很低(13%、表1序号1);但是在相同条件下,加入4 mmol%的Dabco后,产率升高到88%(表1序号7),这说明Dabco可以作为高效配体促进钯催化溴代芳烃与亚磷酸二乙酯的偶联反应.溶剂的选择被认为是该反应进行的关键,分别以碱性较弱的无机碱K2CO3来考察不同溶剂的效应.选用乙醇溶剂时,发现产率不高只有38%(表1序号2),接着考察常用的有机溶剂,乙腈(41%、表1序号3)、甲苯(59%、表1序号4)、二氧六环(38%、表1序号5)、DMF(19%、表1序号6)的产率都不高,均没有超过60%.
丙酮作溶剂时的产率普遍高于其他几类溶剂,因此以丙酮为溶剂,考察不同碱对反应的影响.在无机碱中,价格较贵的Cs2CO3,其产率并不高(46%、表1序号8).Pd源为PdCl2时收率下降到30%(表1序号9).KHCO3和K3PO4为碱时产率中等,只有68%和32%(表1序号10,11).使用有机碱,如三乙胺或N-甲基吗啉,产率很低,都只有13%(表1序号12,13),表明该类反应更适用于无机碱作为碱试剂.
实验结果表明:在110~115 ℃下,以Pd(OAc)2为催化剂,Dabco 为配体,K2CO3为碱, 丙酮为溶剂的反应体系下,生成芳基膦酸酯的产率最高.
表1不同条件下钯催化芳基膦酸酯的合成a


序号催化剂配体碱溶剂时间/h产率b/%1Pd(OAc)2—K2CO3Acetone40132Pd(OAc)2DabcoK2CO3EtOH36383Pd(OAc)2DabcoK2CO3CH3CN48414Pd(OAc)2DabcoK2CO3Toluene50595Pd(OAc)2DabcoK2CO3Dioxane33386Pd(OAc)2DabcoK2CO3DMF30197Pd(OAc)2DabcoK2CO3Acetone40888Pd(OAc)2DabcoCs2CO3Acetone22469PdCl2DabcoK2CO3Acetone243010Pd(OAc)2DabcoKHCO3Acetone246811Pd(OAc)2DabcoK3PO4Acetone243212Pd(OAc)2DabcoEt3NAcetone241313Pd(OAc)2DabcoN-MethylmorpholineAcetone2413
a条件:1.0 mmol对甲氧基溴苯,1.1 mmol亚磷酸二乙酯,2 mmol碱,2 mol% Pd(OAc)2, 4 mol%Dabco, 5 mL溶剂,110 ℃, 氩气保护下;b分离收率.
2.2 钯/Dabco体系催化芳基膦酸酯的合成
通过上述实验,得到价廉且有效的催化体系后,继续探讨了该催化体系对于芳基膦酸酯偶联反应的适用性,结果见表2.实验结果表明,该方法适用的范围很广,产物的产率取决于底物自身的特性.在相同的取代基的条件下,卤代芳烃的活性顺序为碘代芳烃优于溴代芳烃,溴代芳烃优于氯代芳烃 (表2序号1~3,6), 氯代芳烃的活性很低,基本上反应不进行.同时底物1的反应位点受到对位取代基上电子效应的影响,对位上含推电子基团的化合物产率好于拉电子基团化合物(表2序号3,4,11~14).另外用亚磷酸二异丙酯代替反应底物2,也同样具有活性(表2序号7,8).作者发现,该催化体系对过去文献报道中比较难合成且产率较低的芳杂环膦酸酯化合物有较高的收率 (表2序号7~14).并且该体系对杂环类的底物适用性很广,无论是五元环还是六元环,无论是含N还是含S,都有活性.电子效应也影响到杂环类底物的反应活性.含氨基的化合物N上有孤对电子也有可以作为一元胺配体参与反应,产率较高(表2序号14).
综上所述,Pd(OAc)2/Dabco/碳酸钾/丙酮的催化体系能高效催化溴代芳烃与亚磷酸二乙酯合成芳基膦酸酯,尤其对芳杂环膦酸酯的合成产率较高.Dabco作为叔胺配体用在C-P偶联反应中,尚属首次.与传统的膦配体的比较,Dabco毒性微小、价格便宜.该体系所使用的碱与溶剂均具有低毒,便宜的特点.
表2不同底物在钯/Dabco体系中的反应情况a
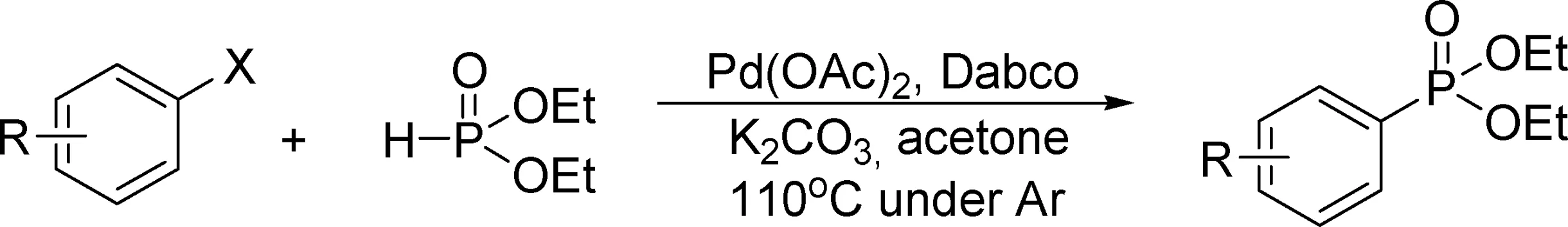

a反应条件:卤代芳烃(1 mmol),亚磷酸二乙酯(1.1当量),K2CO3(2当量),Pd(OAc)2(2 mol%),Dabco(4 mol%),在4 mL丙酮、氨气保护下,110 ℃回流;b分离产率;c亚磷酸二异丙酯.

图 1 3步催化循环过程
2.3 钯催化芳基膦酸酯合成的反应机理
通常认为传统的Pd(OAc)2及配体催化偶联芳基膦酸酯的反应机理为3步催化循环过程[8](见图1),首先活性零价钯与卤代芳烃进行氧化加成生成中间体ArPd(Ⅱ)X,然后HP(O)(OR)2在碱辅助下与中间体ArPd(Ⅱ)X发生置换生成ArPd(Ⅱ)P(O)(OR)2,最后,中间体ArPd(Ⅱ)P(O)(OR)2发生还原消除,生成目标物ArP(O)(OR)2和活性零价钯,从而开始新的催化循环.在这一循环过程中,Dabco起到了稳定过渡金属钯的作用,使其形成络合物均匀分布在反应体系中,并使其保持较高催化活性,防止形成钯黑沉淀导致催化体系失去活性.
参考文献:
[1] SWAMINATHAN S, NARAYANAN K V. Rupe and Meyer-Schuster rearrangements [J]. Chem Rev, 1971, 71:429-438.
[2] OISHI S, KANG S U, LIU H,etal. Synthesis ofα,α-disubstituted 4-phosphonophenylalanine analogues as conformationally-constrained phosphotyrosyl mimetics [J]. Tetrahedron, 2004, 60(3):2 971-2 977.
[3] RONALD K, DAVID C P. Active site generated analogs of reactive intermediates in enzymic reactions. Potent inhibition of pyruvate dehydrogenase by a phosphonate analog of pyruvate [J]. J Am Chem Soc, 1977, 99:4 504-4 507.
[4] BOUMEKOUEZ A, JAUDET E, Collignon N,etal. A remarkable accelerating effect of iodide ions in the photostimulated phosphonylation of bromoaromatic compounds [J]. J Organomet Chem, 1992, 440(3):297-301.
[5] NIKITIN E V, ROMAKHIN A S, PARAKIN O V,etal. Electro-chemical synthesis of aryl phosphonates [J]. Russian Chemical Bulletin, 1983, 32(3):566-568.
[6] JAYASUNDERA K P, WATSON A J, TAYLOR C M. Synthesis of a tetrasubstituted arylphosphonate via the anionic phospho-Fries rearrangement [J]. Tetrahedron Lett, 2005, 46(25):4 311-4 313.
[7] JIAO X Y, BENTRUDE W G. A facile route to vinyl-and arylphosphonates by vinyl and aryl radical trapping with (MeO)3P [J]. J Org Chem, 2003, 68(8):3 303-3 306.
[8] HUANG C, TANG X, FU H,etal. Proline/Pipecolinic acid-promoted copper-catalyzed P-arylation [J]. J Org Chem, 2006, 71(13):5 020-5 022.
[9] KAGAYAMA T, NAKANO A, SAKAGUCHI S,etal. Phosphonation of arenes with dialkyl phosphites catalyzed by Mn(Ⅱ)/Co(Ⅱ)/O2redox couple [J]. Org lett, 2006, 8(3):407-409.
[10] AGER D J, LANEMAN S A. Convenient and direct preparation of tertiary phosphines via nickel-catalysed cross-coupling [J]. Chem Commun. 1997:2 359-2 360.
[11] TUNNEY S E, STILLE J K. Palladium-catalyzed coupling of aryl halides with (trimethylstannyl) diphenylphosphine and (trimethylsilyl) diphenylphosphine [J]. J Org Chem, 1987, 52(5):748-753.
[12] LUKAS J G, MOHAMMAD K D. Practical protocol for the palladium-catalyzed synthesis of arylphosphonates from bromoarenes and diethyl phosphite [J]. Synlett, 2005, 3:445-448.
[13] XIE Y X, LI J H, YIN D L. Amines as the ligands for palladium-catalyzed coupling reactions [J]. Chin J Org Chem, 2006, 26(8):1 155-1 163.
[14] LI J H, LIU W J. Dabco as an inexpensive and highly efficient ligand for palladium-catalyzed suzuki-miyaura cross-coupling reaction [J].Org lett, 2004, 6(16):2 809-2 811.
[15] LI J H, LIANG Y, WANG D P,etal. Efficient Stille cross-coupling reaction catalyzed by the Pd(OAc)2/Dabco catalytic system[J]. J Org Chem, 2005, 70:2 832-2 834.
