MEH-PPV型单体[2,5-双(4′-溴-2′,5′-二甲氧基苯基乙烯基)-1-甲氧基-4-(2′-乙基己基氧基)苯]的合成及其发光性能
2010-11-26张晓云康寿兴
吴 伟, 张晓云, 康寿兴
[中国石油大学(华东) 化学化工学院,山东 青岛 266555)
自1990年J H Burronghes等用共轭高分子{PPV[poly(p-phenylene vinylene)]}制成聚合物发光二极管(PLED)以来,在通过改变生色团结构、引入不同的取代基对PPV进行化学修饰等手段以改进发光聚合物的发射波长、提高量子产率、改善成膜性能等方面已有大量的报道[1],其中,MEH-PPV[poly(2-methoxy-5-(2-ethylhexyloxy)-1,4-phenylenevinylene]因支化结构侧基的引入而具有优良的溶解性和加工性能,是目前研究和应用较多的聚合物发光材料之一[2]。另一方面,通过共聚的方式将具有不同电子/空穴传输及发光功能的结构单元结合在共聚物主链或侧链上也是目前制备PLED的重要方法。其中常用的是通过二溴代芳烃和芳基二硼酸酯的Suzuki偶联反应以及二溴代芳烃之间的Stille偶联反应[3]。


Scheme1
本文以对苯二甲醚为原料,经甲酰化和溴代反应合成2,5-二甲氧基-4-溴苯甲醛(2)。以对甲氧基苯酚为原料,经烷基化、氯甲基化和Michaelis-Arbuzov反应合成1-甲氧基-4-(2-乙基)己氧基-2,5-二苯亚甲基亚磷酸二乙酯(5); 2和5经Horner-Wittig-Emmons反应合成了二溴化MEH-PPV型单体——2,5-双(4′-溴-2′,5′-二甲氧基苯基乙烯基)-1-甲氧基-4-(2′-乙基己基氧基)苯(6, Scheme 1),总收率44.7%(以对甲氧基苯酚计),其结构经1H NMR,13C NMR和元素分析表征。用UV-Vis和荧光光谱(FL)研究了6的发光性能。
6为已知化合物,但合成方法未见文献报道。
1 实验部分
1.1 仪器与试剂
Hitachi U-3010 UV-Vis型紫外-可见光谱仪;Hitachi F-4500型荧光谱仪;Varian Unity 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Perkin Elmer 2400型元素分析仪。
对苯二甲醚、对甲氧基苯酚、3-溴甲基庚烷,分析纯,Aldrich-sigma公司;1,1-二氯甲醚,自制;其余所用试剂均购自国药集团上海化学试剂公司或天津化学试剂公司。
1.2 中间体的合成
(1) 2,5-二甲氧基苯甲醛(1)的合成
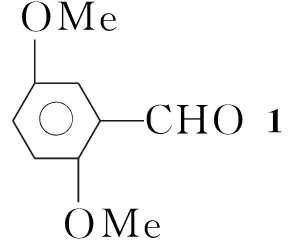
在反应瓶中加入对苯二甲醚6.9 g(50 mmol)的二氯甲烷(80 mL)溶液,冰盐浴冷却,搅拌下滴加四氯化钛13 mL,滴毕,反应30 min后再缓慢滴加1,1-二氯甲醚6.4 g(55 mmol)的二氯甲烷(30 mL)溶液(约2 h)。于室温反应1 h后倒入碎冰中,用15%HCl调至pH1~2,搅拌2 h后分液;水层用二氯甲烷(2×10 mL)萃取,合并有机层,用饱和食盐水(10 mL)洗涤,无水硫酸镁干燥。旋除溶剂得白色固体1 7.9 g,产率95.2%, m.p.49 ℃~51 ℃(48 ℃~50 ℃[4]);1H NMRδ: 10.35(s, 1H), 7.24(d,J=3.3 Hz, 1H), 7.04(m, 1H), 6.86(d,J=9.0 Hz, 1H), 3.81(s, 3H), 3.72(s, 3H);13C NMRδ: 189.4, 156.8, 153.7, 125.0, 123.3, 113.4, 110.6, 56.2, 55.7。
(2)2的合成
在反应瓶中加入1 4.98 g(30 mmol)的冰乙酸(20 mL)溶液,搅拌下于室温滴加溴素5.28 g(33 mmol)(约30 min);反应12 h后加水100 mL,用二氯甲烷(3×10 mL)萃取,合并有机层,依次用5%Na2CO3溶液(2×10 mL)和饱和食盐水洗涤,无水硫酸钠干燥,除去溶剂得淡黄色固体,经硅胶柱层析[洗脱剂:A=V(正己烷) ∶V(乙酸乙酯)=4 ∶1]纯化得淡黄色固体2 3.05 g,产率41%, m.p.130 ℃~132 ℃(130 ℃~132 ℃[5]);1H NMRδ: 10.36(s, 1H), 7.30(s, 1H), 7.21(s, 1H), 3.88(s, 3H), 3.87(s, 3H);13C NMRδ: 188.5, 155.9, 150.1, 123.9, 120.1, 117.4, 109.3, 56.6, 56.2。
(3) 1-甲氧基-4-(2-乙基)己氧基苯(3)的合成
在反应瓶中加入叔丁醇钾12.8 g(115 mmol)的THF(70 mL)溶液,搅拌下滴加对甲氧基苯酚12.4 g(100 mmol)的THF(50 mL)溶液,滴毕,回流反应30 min。冷却至室温,滴加3-溴甲基庚烷21.2 g(110 mmol)的THF(50 mL)溶液,滴毕,回流反应过夜。蒸除溶剂,残余物用乙醚100 mL溶解,依次用10%NaOH和水洗涤,无水Na2SO4干燥。旋除乙醚后减压蒸馏,收集(102~105) ℃/133.3 Pa的馏份得淡黄色液体3 20.1 g,收率85%, b.p.(102~105) ℃/133.3 Pa[(148~149) ℃/266.6 Pa[6]];1H NMRδ: 6.90(s, 4H), 4.01(m, 2H), 3.80(s, 3H), 0.95~1.50(m, 15H);13C NMRδ: 151.7, 150.8, 115.6, 115.3, 71.5, 56.3, 40.9, 30.7, 29.5, 24.1, 23.0, 14.1, 11.5。
(4) 1,4-二氯甲基-2-甲氧基-5-(2-乙基)己氧基苯(4)的合成
在反应瓶中加入3 4.72 g(20 mmol)的1,4-二氧六环(50 mL)溶液,搅拌下于0 ℃~5 ℃加入浓盐酸9 mL和37%甲醛5 mL,通HCl气体30 min后于室温反应 2 h。重复补充甲醛、通HCl步骤两次后反应过夜;回流反应 4 h。蒸除溶剂,残余物用少量己烷溶解,加入甲醇,低温下析晶,过滤,滤饼干燥得白色固体4 4.1 g,产率61.6%, m.p.52 ℃~54 ℃;1H NMRδ: 6.93(s, 1H), 6.92(s, 1H), 4.64(s, 4H), 3.90(s, 3H), 3.86~3.81(m, 2H), 1.75~1.32(m, 9H), 0.87~0.97(m, 6H);13C NMRδ: 150.9, 150.8, 127.0, 126.8, 114.0, 113.3, 71.1, 56.3, 41.4, 39.6, 30.6, 29.1, 24.0, 23.1, 14.1, 11.2。
(5) 5的合成
在反应瓶中加入4 3.33 g(20 mmol)和亚磷酸三乙酯10 mL,搅拌下回流反应15 h。蒸除过量的亚磷酸三乙酯,残余物冷却得蜡状固体5 5.32 g,产率99.3%;1H NMRδ: 6.95(s, 1H), 6.91(s, 1H), 4.11~4.01(m, 8H), 3.86~3.79(m, 5H), 3.26~3.15(m, 4H), 1.74~1.68(m, 1H), 1.53~1.30(m, 8H), 1.26~1.20(m, 12H), 0.96~0.90(m, 6H);13C NMR δ: 150.5, 150.4, 119.3, 119.2, 114.5, 113.6, 70.78, 61.6, 55.8, 39.4, 30.2, 28.8, 26.4, 25.1, 23.6, 22.7, 16.0, 13.6, 10.8。
1.3 目标化合物6的合成
在反应瓶中加入5 3.21 g(6 mmol), 2 2.94 g(12 mmol)和THF 30 mL,搅拌使其溶解;加入叔丁醇钾1.2 g(10.7 mmol),室温反应12 h。过滤,滤液浓缩后经硅胶柱层析(洗脱剂:A=10 ∶1)纯化得亮黄色针状晶体6 3.08 g,产率86%;1H NMRδ: 7.53~7.34(m, 4H), 7.18(s, 2H), 7.17(s, 2H), 7.10(s, 2H), 3.99(m, 2H), 3.93(s, 3H), 3.92(s, 3H), 3.91(s, 3H), 3.86(s, 6H), 1.80~1.40(m, 9H), 0.98(t,J=7.4 Hz, 3H), 0.89(t,J=7.2 Hz, 3H);13C NMRδ: 151.4, 150.9, 150.8, 146.7, 130.1, 127.0, 119.3, 116.6, 115.6, 114.9, 114.3, 113.7, 112.3, 111.6, 71.1, 57.0, 56.5, 55.2, 41.4, 39.8, 30.6, 29.1, 24.0, 23.1, 14.1, 11.4; Anal.calcd for C35H42O6Br2: C 58.51, H 5.89; found C 58.80, H 5.62。
2 结果与讨论
1, 4和5的纯度较高,无须纯化直接进行下步反应。合成1可通过传统的Reimer-Tiemann反应由对苯二甲醚与DMF反应制备,但产率较低[7]。而采用1,1-二氯甲醚反应进行彻底,收率较高[4]。 1在冰乙酸中利用液溴直接进行溴代合成2。
3的合成文献[8]方法用对甲氧基碘苯与2-乙基己醇反应,产率只有72%。本文采用对甲氧基苯酚与溴代烃的成醚反应,以叔丁醇钾作为碱,可进一步促进反应的进行。3经氯甲基化反应生成4,实验发现多次重复添加甲醛和HCl可以提高反应的收率至60%以上。
图1是6在氯仿溶液中的UV-Vis和FL谱图。文献[9]报道的MEH-PPV的UV-Vis的λmax在515 nm, 而FL的λmax在580 nm。从图1中可以看出,6的λmax(UV-Vis)在410 nm,而其λmax(FL)位于479 nm和497 nm,整个发射峰在450 nm~550 nm绿色范围内,是一种绿光的单体,6可用于发绿光聚合物材料的制备。
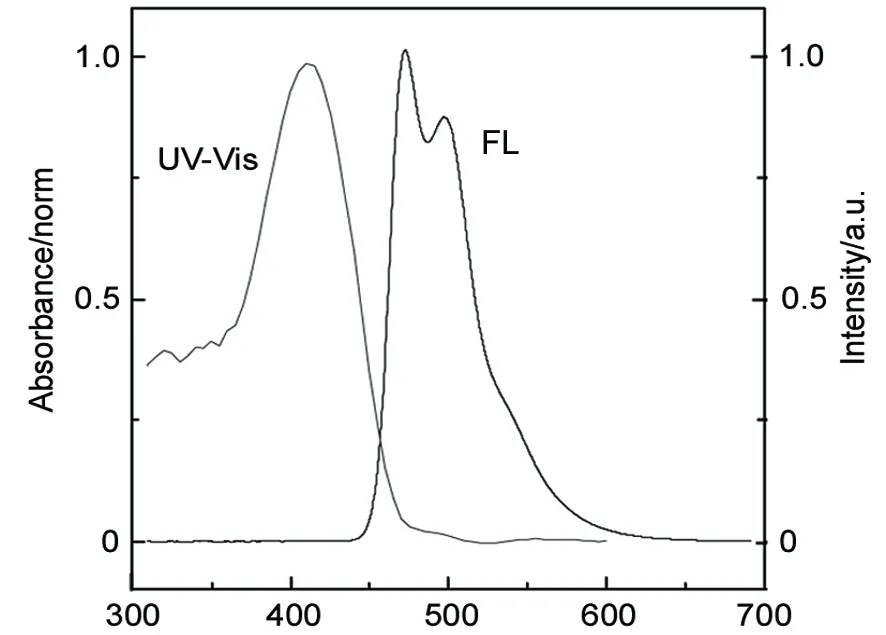
λmax/nm图1 6在氯仿中的UV-Vis和FL谱图Figure 1 UV-Vis and PL spectra of 6 in CHCl3
[1] Burroughes J H, Bradley D D, Brown A R,etal. Light-emitting diodes based on conjugated polymers[J].Nature,1990,347:539-541.
[2] Amrutha S R, Jayakannan M. Structure control of conjugated polymers for enhanced solid-state luminescence[J].Macromolecules,2007,40:2380-2391.
[3] Mueller C D, Falcou A, Reckefuss N,etal. Multicolor organic light-emitting displays by solution processing
[J].Nature,2003,421:8293-829.
[4] Piggott Matthew, Wege D. Synthesis of 5,8-dimethoxynaphtho[2,3]furan-4(9H)-one[J].Tetrahedron,2006,62:3550-3556.
[5] Downie I M, Earle M J, Harry Heaney H. Vilsmeier formylation and glyoxylation reactions of nucleophilic aromatic compounds using pyrophosphoryl chloride[J].This article is not included in your organization′s subscription.However,you may be able to access this article under your organization′s agreement with elsevier[J].Tetrahedron,1993,49(19):4015-4034.
[6] Eric J T, David A K, Emmanuel A T. Total synthesis of atroviridin[J].Tetrahedron Letters,2003,44(16):3281-3284.
[7] Sardessai M S, Abramson H N. The bromination of 2,5-dimethoxybenzaldehyde structural proof of the 6-bromo isomer[J].Org Prep Proced Int,1991,23(4):419-424.
[8] Naidu A B, Sekar G. An efficient intermolecular BINAM-copper(Ⅰ) catalyzed Ullmanntype coupling of aryl iodides/bromides with aliphatic alcohols[J].Tetrahedron Letters,2008,49(19):3147-3151.
[9] 吴俊,钟国伦,孙建中,等. 卟啉掺杂MEH-PPV的发光性能[J].发光学报,2008,29(2):259-263.
