1,4-萘醌的合成研究进展
2010-11-26许全杰贾丽霞
许全杰,贾丽霞,刘 涛
(新疆大学 艺术设计学院,新疆 乌鲁木齐 830046)
研究表明,天然1,4-萘醌以其优异的紫外吸收和可见—近红外反射功能[1]愈来愈引起人们的兴趣,这在纺织品功能整理方面具有重要意义.天然萘醌类染料广泛存在于植物中,但是仅从植物中提取和分离萘醌类化合物远远不能满足纺织染料方面的研究和应用需求,人工合成或仿生合成已成为重要途径之一.本文综述了近年来关于1,4-萘醌化合物合成方法的研究进展,特别介绍了萘系氧化法和环化合成法,以期对萘醌类化合物在纺织中的应用进行更深入的研究.
1 萘系氧化法
根据1,4-萘醌类化合物的母体结构,传统方法多以具有对应取代基的萘或萘酚为原料进行氧化制备.氧化法的优点是低温反应、易于控制、操作简单、方法成熟、选择性高,尤其是对于许多产量小、价值高的精细化工产品来说,采用化学氧化法居多.
1.1 化学氧化法
在1,4-萘醌制备方法方面,Bhatt用Ce(SO4)2·2(NH4)2SO4·2H2O在乙腈和硫酸的混合液中氧化萘,粗品1,4-萘醌的产率达到90%~95%[2];韩世清等改用HOAc作溶剂,产物用石油醚抽提纯化,使1,4-萘醌收率达到75%[3].
2-羟基-1,4-萘醌是指甲花醌的主要成分,是重要的天然醌类染料,D.S.Deorha等人利用高碘酸钠降解2-羟基-1,4-二甲氧基萘,制得2-羟基-1,4萘醌,反应过程如图1所示.Yan Yan等研究了α-萘酚和β-萘酚在金属催化剂、低温、强碱、甲醇或乙醇为溶剂条件下,合成高纯度2-羟基-1,4萘醌的方法[4].

图1 高碘酸钠降解2-羟基-1,4-二甲氧基萘制备2-羟基-1,4萘醌Fig.1 Sadium perindate degraded 2-hydrory-1,4-dimathey naphthalene to 1,4-naphthoquinone
与2-羟基-1,4-萘醌类似,5-羟基-1,4-萘醌(胡桃醌)同样带有一个羟基,但是,通过1,5-萘二酚的氧化合成胡桃醌的方法多数存在试剂难得、催化剂难以制备、产物难以分离、产率低等问题.1998年,刘全忠等用较易制备的CrO3·2C5H5N作为氧化剂代替Jesartis采用的重铬酸钾氧化1,5-萘二酚,以二氯乙烷代替水作溶剂,按照图2所示的合成路线合成了该化合物,产率由10%提高至27.8%[5].Wakamatsu Takesi曾用Salcomine作催化剂由1,5-萘二酚氧化制得了该化合物,产率71%[6],也有使用CF3(CF2)5I(O2CCF3)2作催化剂[7],虽然产率较高,但催化剂的合成困难影响了工业化生产;张继振等人采用图3所示的新合成方法[8],但合成路线较长,产率较低;张明晓等采用如图4所示的一锅法合成胡桃醌[9],此法合成不用硫酸,无需真空蒸馏纯化过氧乙酸,是合成胡桃醌的简便方法.

图2 CrO3·2C5H5N氧化萘制备萘醌Fig.2 CrO3·2CC5H5N oxidized naphthalene to prepare 1,4 maphthoquimone
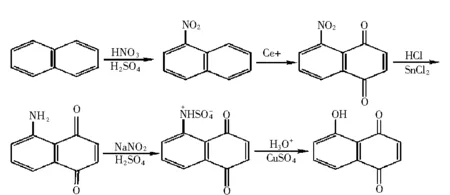
图3 张继振的合成路线Fig.3 Zhang Jizhen’s systhetic approach
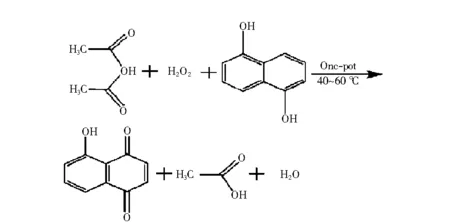
图4 一锅法合成胡桃醌Fig.4 One-pot systhesis of juglone
5,8-二羟基-1,4-萘醌(萘茜)为紫草素的母体结构.Nicolaou等人报导由氢酮和粘氯酸经傅-克反应得到2,3-二氯萘茜,经还原去氯得到萘茜.此外,Couladouros等报道了图5中化合物a可以氧化成化合物b,这个方法和Terada的方法可以结合使用,再用AgO/HNO3脱去甲氧基的保护就可以得到萘茜[10].
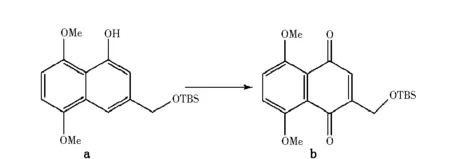
试剂和条件:(CF3CO2)2IC6H5, CH3CN-H2O, 2∶1, 0 ℃图5 制备萘醌衍生物Fig.5 Preparing naphthoquinone derivent
1.2 绿色氧化法
工业生产中萘系氧化法的主要缺点是要产生大量的含铬废水,处理繁杂困难,对环境污染十分严重;反应以冰醋酸作介质,腐蚀性强,对设备材质要求高;产品收率低.从20世纪70年代开始,国外研究改进铬化物氧化法,虽然在产率和减少污染方面不同程度地取得了成效,但始终无法解决含铬废水的问题.为了开发收率高、绿色环保和安全性好的合成方法与工艺,研究的重点是氧化剂和催化剂以及氧化方法等.虽然臭氧、硫酸锰、铬酐、过氧乙酸等氧化剂均见诸文献,但以过氧化物为氧化剂的氧化体系最具吸引力,通过对催化剂的研究,形成了一系列的催化新方法[11].
Yamaguchi[12]、Sankarasubbier[13],吕君[14]等人报道了在冰醋酸介质中用过氧化氢氧化β-甲基萘生成β-甲基萘醌的新方法.此方法在均相条件下氧化,无须使用铬盐等对环境有污染的原料和催化剂,也不需要其他固体催化剂,更为经济环保;同样,陈文祥以三氯甲烷为溶剂和有机金属钼作为均相催化剂,用叔丁基过氧化氢将β-甲基萘氧化为β-甲基萘醌,产率可达61%,选择性为70%~85%[15].但这两种方法都存在产物分离过程十分复杂,催化剂的成本太高,未能回收循环利用等问题.
除了使用过氧化物为氧化剂外,还可使用Ce(IV)盐氧化剂氧化法制备β-甲基萘醌[16].由于Ce(IV)盐作氧化剂制备醌类有很好的选择性,电解再生过程有良好的电流效率,其研究的重点转向电解氧化法.另外,康士刚、赵飞雪利用相转移催化剂溴酸钾氧化β-甲基萘制备β-甲基萘醌,β-甲基萘的转化率可达81.46%,选择性达到60%以上[17,18];鞍山热能院经过研究发明了间歇氧化法制取β-甲基萘醌,在此过程中使用电解再生氧化液和相转移催化氧化法,以铬酸酐和硫酸为氧化剂,烷基苯基聚乙基醚(OP系列乳化剂)为相转移催化剂来制β-甲基萘醌,无废液废水排出,利于环保,而且氧化的温度低,时间短;阎雁、魏仲航等以金属卟啉为催化剂,在甲醇的碱性溶液中加入过氧化氢水溶液,可将1-萘酚和2-萘酚高选择性制取2-羟基-l,4-萘醌,其最高产率可达57%[19].
Oscar,Anunziata等人[20]报道了以含铁和钛的化合物为活性成分、具有选择性氧化作用的沸石作为载体,丙酮作为溶剂介质,过氧化氢为氧化剂进行催化氧化,选择性可达83%,原料的转化率为45%;2004年又报道了在极性溶液乙腈中,采用Ti-MCM-41型沸石为载体,过氧化氢为氧化剂制取β-甲基萘醌,原料的选择性可达90%,产率可达60%[21].由于将原来均相催化剂改成固体的负载型催化剂,不仅使得催化剂与反应混合物的分离大大简化,而且催化剂可以循环使用.此后,Zalomaeva采用磺酸铁酞菁(FePcS)负载型催化剂合成β-甲基萘醌,对FePcS-SiO2体系,环氧化剂叔丁基过氧化氢(tBuOOH)等不同反应参数对氧化反应的效率进行了研究,并优化催化体系,反应的选择率为59%,转化率为96%,而催化剂的用量仅为0.5%(mol)[22].
Oliver Suchard等人将1,5-二羟基萘溶于甲醇、乙醇、丙酮等溶剂,加入亚甲基蓝等敏化剂,在氧气或空气中采用光照的方式制备5-羟基-1,4萘醌.文献中尝试了多种溶剂和敏化剂,确定以丙酮为溶剂的产率最高(71%).以此为依据,将1,5-二羟基萘的一个-OH用-H、-OAc、-NHAc代替进行反应也获得了很好的结果[23],反应如图6所示.
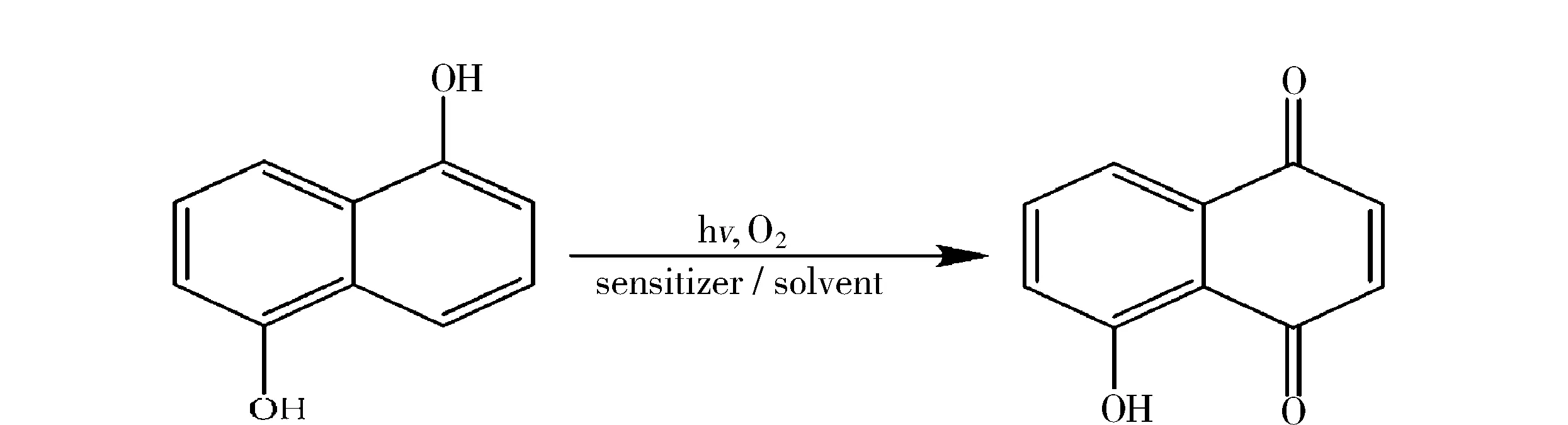
图6 1,5-二羟基萘的光致生氧Fig.6 Photooxidation of 1,5-dihydroxy-naphthalene
值得注意的是微波和超声波技术在萘醌合成中的应用.张前军等采用微波辐射技术,以环己烷为溶剂,在常压下用30%过氧化氢氧化α-萘酚的方法合成1,4-萘醌,避免使用复配金属催化剂,操作简便[24].此后,凌绍明采用超声波辐射技术,同样以环己烷为溶剂,过氧化氢氧化α-萘酚,产品收率较微波法高出20%以上,产率达72.7%[25].
1.3 气相催化氧化法
将空气和有机物的蒸气以适当比例混合,在较高的温度下(300~500 ℃),通过固态催化剂(或称触媒),使有机物发生适度氧化而生成所希望的产物,这类反应称为气相催化氧化.催化剂的催化活性和选择性直接影响合成产率,所以气相催化氧化法的研究的热点和关键在于催化剂的制备.
以萘为原料,采用复配金属催化剂,高温气相催化氧化1,4-萘醌已有大规模工业化生产.日本触媒化学公司以氧化钾16.7%、五氧化二钒28.4%、二氧化硅26.5%组成催化剂,进料气中萘的浓度为55%,反应温度为380 ℃,常压下用固定床(有固定床和沸腾床两种)空气氧化,产品收率为42%左右[26].基于此方法,俄罗斯学者以钒-钛为催化剂,在360~390 ℃下,对β-甲基萘进行气相氧化,产率为29%,但同时有副产物邻苯二甲酸酐、顺丁烯二酸酐、一氧化碳和二氧化碳生成[27].
1.4 液相空气氧化法
液相空气氧化法与化学氧化法相比,不消耗价格较高的化学氧化剂;与气相氧化法相比,其反应温度比较低(100~250 ℃),反应的选择性较好.因此,液相空气氧化法在中间体生产中具有广泛的应用.在实际的生产中,为了提高自动氧化的速度,使得氧化反应具有经济性,常常需要加入引发剂和催化剂,并适当提高反应温度,使得反应速度达到生产上的实际要求.
典型的反应是在含体积分数为50%~90%的乙酸和0.2~0.8 mol/L的硫酸水溶液中,使用含钒催化剂进行氧化,得到β-甲基萘转化率为78%,β-甲基萘醌的选择性为82%.但液相空气氧化法后处理比气相接触氧化麻烦,设备腐蚀较严重,应用也受到一定的限制.
1.5 电解氧化法
电解氧化法是在电流的作用下使有机物氧化,具有专一的选择性、收率高、几乎无三废排出的特点,日益受到人们的重视并得以较迅速地发展,在萘醌类化合物的合成研究已有较成功的应用.
曹晓群等用萘为原料,以硫酸铈为氧化剂,在硫酸存在下氧化合成1,4-萘醌.该方法反应条件缓和,易控制,产品选择性好,精制过程简单;基本无三废,属清洁生产工艺,氧化剂硫酸铈用电解法再生,可循环使用;产品1,4-萘醌的收率达81.5%.产品纯度超过99%[28].1999年,波兰学者Kowaski J等报道了在以冰醋酸为介质对β-甲基萘进行电化学氧化时,产率可达99%[29].但此方法中,采用了有机酸作为反应介质,它对设备具有一定的腐蚀性,比较适合小吨位的生产.2002年,徐海升等人采用自行设计的电解装置和间接电解氧化工艺把β-甲基萘、铬酐和硫酸按比例投入氧化釜,反应结束后,经固液分离得β-甲基萘醌,把氧化的废铬液经处理,送电解工序,把Cr(III)电解氧化为Cr(VI),再循环到氧化工序使用.长期运行证明,该工艺不仅显著降低β-甲基萘醌的生产成本,而且也解决了传统化学氧化法工艺中的含铬废液对环境的污染问题[30].
2 苯系氧化法
2.1 脂环氧化法
除了以萘为原料,还可对其他结构的物质进行氧化合成1,4-萘醌.Bailie和R. H. Thomson在金属钾的叔丁醇溶液中,以α-四氢萘酮和β-四氢萘酮及其多种甲氧基衍生物为反应物,通过图7所示的自氧化反应,合成出2-羟基-1,4萘醌以及其衍生物[31].

图7 α-和β-四氢萘酮的自氧化反应Fig.7 Autpxidation of α-tetrahydronaphthoquinone and β-tetrahydronaphthoquinone
1971年,日本的Miyamori Hiroshi将2,3-环氧-2,3-二氢-1,4-萘醌,以醇钠和相应的醇溶液处理而得到产率为49.3%的2-羟基-1,4萘醌(纯度为98.5%)[32].前苏联的N. L. Lysenko等用1,4-萘醌-2,3-环氧化物和2-甲基-1,4-萘醌-2,3-环氧化物分别进行Gringard反应时,分别得到50%~70%的2-羟基-1,4-萘醌和20%~40%的3-羟基-2-甲基-1,4-萘醌.法国的V-R Daniele用超氧化钾氧化法,氧化1,2-二羟基萘和1,3-二羟基萘以及α-四氢萘酮和β-四氢萘酮,得到2-羟基-1,4萘醌,反应体系为冠醚—四氢呋喃溶液,产率在75%~80%之间[33].
2.2 环化合成
利用苯环和烯烃,杂环的反应也可以生成1,4-萘醌类化合物.
Suteera Witayakran等利用Diels-Alder反应研究了对苯二酚和烯烃一锅法反应生成1,4-萘醌的方法[34],为1,4-萘醌的合成增加了一条新的合成途径,反应过程如图8所示.
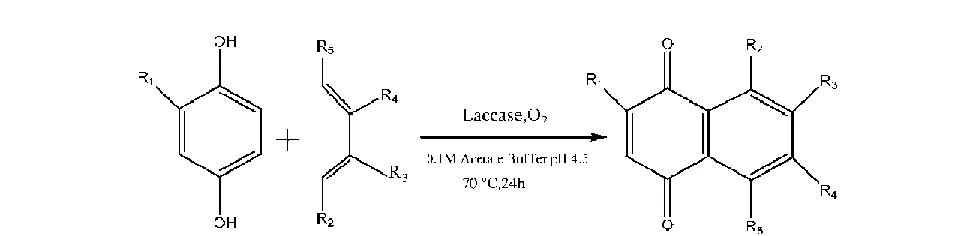
图8 一锅法生成1,4-萘醌Fig.8 One pot systhesis of 1,4-naphthoquinone
Margaret A. Brimble以图9中化合物a为原料,构造化合物b,采用单锂引发剂(sBuLi),在四氢呋喃溶液中使化合物b与丙烯酸乙酯进行反应,产物c再经Ag2O氧化反应生成1,4-萘醌衍生物.值得注意的是,改变化合物a甲氧基位置依然可以用同样路线完成反应[35].

图9 丙烯酸乙酯参与环化制备1,4-萘醌衍生物Fig.9 Cycliazation of ethyl acrylate prepared naphthoquine derivant
Muthian等人在多种溶剂中尝试以聚合物固载Fischer型卡宾络合物和炔烃为原料,微波辅助制备多种2,3-取代-1,4-萘醌[36],反应如图10所示.此固相有机合成方法的反应条件温和,产率和选择性都很高.

图10 Muthian微波辅助法制备1,4-萘醌衍生物Fig.10 Muthian’s preparation of 1,4-naphthoquine derivant
Steve在合成虫红酸的前期准备工作中研究了萘醌的合成,应用了Giovanni Sartori高选择性合成羟基萘醌的方法,完成3-甲酯基-6-卤代-2,5,8-三羟基-1,4萘醌的合成[37].反应的关键合环反应如图11所示.

试剂与条件:(COCl)2, MeNO2, AlCl3, 0~80 ℃, 3 h图11 合成3-甲酯基-6-卤代-2,5,8-三羟基-1,4萘醌Fig.11 Systhsis of 3-carbomethoxy-6-halogenating-2,5,8-trihydroxy-1,4-nophthoquinone
1,4-萘醌类化合物还可由环丁烯酮的环化反应制得.采用芳基锂试剂作用于3-环丁烯-1,2-二酮衍生物可得图12中化合物a,后者在二甲苯中加热回流,则能经由中间体烯酮再经分子内转位反应而生成相应的萘醌.由此,各种3,4-二取代-3-环丁烯-1,2-二酮系从二异丙基方形酸开始,与烷(芳)基锂试剂反应后再水解,重复处理,即可高收率地被制得.此方法被广泛应用于多取代醌的合成中[38].

图12 由环丁烯酮的环化反应Fig.12 Cyclized reaction of cyclobutene cicrotoic ketone
Mahapatra为研究胡桃醌的活性,以苯酚及其卤代物和顺丁烯二酸酐为原料进行反应,制备5-羟基-7-甲基-1,4萘醌及其卤代产物.文献中列举了基于此合成法的20余种1,4-萘醌类化合物,其产率都在60%以上,最高达98%[39].
胡茂林等人[40]参照Fieser L.F.报道的方法,以对苯二酚与顺丁烯二酸酐为原料在无水三氯化铝和氯化钠的催化作用下,合成得到萘茜,并对该方法中的工艺条件进行了优化和改进,使产品收率由21.1%提高到36.8%.反应方程式见图13.

图13 苯二酚与顺丁烯二酸酐合成萘茜Fig.13 Using dihydroxy-bezene and cix-butenedioic to prepare naphthazarine
值得一提的是,冷丰收等人参照5,8-二羟基-l,4-萘醌的合成方法,以对甲基苯酚为起始原料,与马来酸酐缩合,合成了5-羟基-8-甲基-l,4-萘醌[41].根据文献调查,目前只有该作者采用这种方法合成此种化合物.但是该方法产率只有2.3%,如何提高该化合物产率有待于进一步研究.
3 展 望
l,4-萘醌类化合物作为重要的精细化工合成中间体,其合成技术研究开发必将愈来愈受到重视.综合从萘及其他物质为原料的各种氧化法制备1,4-萘醌类化合物生产技术及各种合成路线的发展,应在以下几方面进行深入研究:
(1)氧化剂的选择方面.应尽量避免使用价格昂贵和(或)环境污染较大的物质,尽量使用过氧化氢和氧气等氧化剂,其还原产物对环境几乎无污染.
(2)合成技术研究方面.应重视当前已具工业化前景的气相氧化法,重点是高效催化剂的开发及相应工艺条件的研究,还应注重反应体系以及氧化剂/催化剂体系的综合研究.
(3)应重视对已有的实验室合成方法进行改良,使其达到工业化的标准.
(4)应积极研究开发工艺简单、操作平稳、条件温和、选择性高、后处理简单、产品质量好、无污染、成本低的合成新技术,研究改进产品的后处理方法,研究副产物回收及综合利用,降低生产成本.
参考文献:
[1] 冯新星,陈建勇,陈子毫,等.天然染料紫草染色织物的迷彩伪装防护性能[J].纺织学报,2005,26(5):72-76.
[2] PERIASAMY M, BHATT M V.A convenient method for the oxidation of polycyclic aromatic hydrocarbons to quinones [J]. Synthesis, 1977, (5): 330-332.
[3] 韩世清,杨振云,郑禄彬.铈(Ⅳ)盐氧化萘制备萘醌的方法改进[J].化学试剂,1998,20(3):189.
[4] YAN Y. Selective catalytic oxidation of naphthol to 2-hydroxyl-1,4-naphthoquinone by hydrogen peroxide over metalloporphyrin catalysts[J].Journal of Molecular Catalysis A: Chemical,2000,157(1-2):65-72.
[5] 刘全忠,蒋晓慧,秦大斌,等.5-羟基-1,4-萘二醌合成研究[J].四川师范学院学报(自然科学版),1998,19(4):382-384.
[6] TAKESHI W, TAKAHIDE N, TAKESHI O,et al.A convenient synthesis of juglone via neutral salcomine oxidation [J]. Synth.Commun, 1984, 14(12):1 167-1 173.
[7] BARRET R,DAUDON M.An efficient synthesis of juglone [J]. Synth.Commun, 1990 ,20(18):2 907-2 912.
[8] 张继振,王雅珍.胡桃醌合成的新方法[J].江苏技术师范学院学报,2005,11(2):7-9.
[9] 张明晓,李学刚.乙酸酐、H2O2和1,5-二羟基萘酚一锅合成胡桃醌[J].应用化学,2007,24(12):1 470-1 472.
[10] COULADOUROS E A, ALEXANDROS T S. Regioselective oxidation of 3-monosubstituted juglone derivatives [J]. Tetrahedron Letters, 2000, 41(4): 535-538.
[11] 诸爱士,孙 军.维生素K3合成工艺研究[J].科技通报,2001,17(3):37-41.
[12] SATORU Y. Oxidation of 2-methyl-1,4-naphthalene to 2-methyl- naphthoquinone with hydrogen peroxide in the presence of palladium (Ⅱ)- polystyrene sulfonec acid resin[J]. Chem Lett, 1985,14(6): 827-828.
[13] SANKARASUBBIER N, MURTHY K V. Anovel and environmenta lly benign selective route for Vitamin K3 synthesis [J].Applied Catalysis A: General, 2002, (288):161-165.
[14] 吕 君,赵雪飞. 环境友好方法合成2-甲基-1,4-萘醌的研究[J].化工中间体,2005,3(7):18-19,23.
[15] 陈文祥. 有机金属钼催化下的甲基萘氧化反应[J].有机化学,1986,24(6):432-434.
[16] 化工百科全书(第10卷)[M].北京:化学工业出版社,1996.159-162.
[17] 康士刚,赵雪飞.相转移催化氧化法制备2-甲基萘醌的研究[J].燃料与化工,2007,38(1):35-37.
[18] 康士刚,赵雪飞.液相氧化法制备纤维素K中间体β-甲基萘醌的研究[J].应用化工,2006,35(9):666-668.
[19] 阎 雁,郑国栋. 铁卟啉催化氧化萘酚合成2-羟基-1,4-萘醌 [J]. 应用化学, 2001, 18(1): 29-31.
[20] OSCAR A,ANUNZIATA. Synthesis of menadione over selectiveox idationz eo Iites[J]. Mot. Catal. A:Chem, 1999,(14):255-261.
[21] OSCAR A, ANUNZIATA. Studies of Vitamin K3 synthesis over Ti-containing mesoporous material [J].Applied Catalysis A: General, 2004, 270(1-2): 77-85.
[22] ZALOMAEVA O V.Preparation of 2-methyl-1,4-naphthoquinone (vitamin K3) by catalytic oxidation of 2-methyl-1-naphthol in the presence of iron phthalocyanine supported catalyst[J].Comptes Rendus Chimie,2007, 10(7): 598-603.
[23] OLIVER S. Photooxygenations of 1-naphthols: an environmentally friendly access to 1,4-naphthoquinones[J]. Tetrahedron, 2006, 62(7): 1 467-1 473.
[24] 张前军,杨小生,赵 超,等.微波快速合成1,4-萘醌[J].化学试剂,2006,28(3):183-184.
[25] 凌绍明.超声辐射催化合成1,4-萘醌[J].广东化工,2007,34(9):68,92-93.
[26] 徐克勋.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1998.221-222.
[27] SHAPOVALOV A A. Synthesis of 2-methyl-1, 4-naphtha quinone by vapor-phase oxidation of 2-methylnaphthalene[J]. Izv.Akad.Naukkaz. SSR, Ser,Khim. 1989,(4): 17-21.
[28] 曹晓群.1,4-萘醌的合成研究[J].精细与专用化学品,2006,14(12):18-20.
[29] KOWALSKI J, PLOSZYNSKA J, SOBLOWIAK A.Electroche mical oxidation if 2-methyl naphthalene-1,4-diacetate[J].J.Appl.Electrochem, 1998,28 (11):1 261-1 264.
[30] 徐海升,赵建宏.维生素K3合成的工业化研究[J]. 化学反应工程与工艺,2002,18(4):334-338.
[31] BAILLIE A C,THOMSON R. New routes to 2-hydroxy-1,4-naphthaquinones[J].Chem.Soc.C,1966,(6):2 184-2 186.
[32] Miyamori Hiroshi, Japan.7102, 978 (CI. C 07bc.B01),25 Jan 1971, Appl.12 Feb 1968.
[33] DANIELE V R, THERESE M M, Esthelf O, et al.[J].Tetrahedron Lett, 1984, 25 (5):529-532.
[34] SUTEERA W, ARTHUR J.Ragauskas one-pot synthesis of 1,4-naphthoquino nes and related structures with laccase[J].Green Chem,2007,(9):475-480.
[35] MARGARET A B, SCOTT I H, PAUL D. Woodgate synthesis of a regioisomeric analogue of the 3C-protease inhibitor thysanone via a hauser annulation strategy[J].Tetrahedron,2007,63(4):880-887.
[36] MUTHIAN S. Microwave-assisted solid-phase Dötz benzannulation reaction: a facile synthesis of 2,3-disubstituted- 1,4-naphthoquinones[J].Tetrahedron Letters,2005, 46(44):7 545-7 548.
[37] STEVE J B,JOHN H P.Tyman the synthesis of kermesic acid by acetylation- aided tautomerism of 6-chloro-2, 5, 8-trihydroxynaphtho-1,4-quinone[J].Tetrahedron, 2008, 64(16):3 471-3 476.
[38] 日本化学会.有机合成醛·酮·醌[M]. 上海:科学技术文献出版社,1997.451-452.
[39] MAHAPATRA A. Activity of 7-methyljuglone derivatives against Mycobacterium tuberculosis and as subversive substrates for mycothiol disulfide reductase [J]. Bioorganic & Medicinal Chemistry, 2007, 15(24): 7 638-7 646.
[40] 胡茂林,程德平.5,8-二羟基萘醌的合成[J].化学试剂,2000,22(3):187-188.
[41] 冷丰收,孟繁艳,张继振,等.胡桃醌衍生物的合成[J].延边大学学报(自然科学版),2003,29(3):199-202.
