Enterobacter cloacaeZ0206细菌胞外多糖的体外抗氧化活性研究
2010-11-24徐春兰钦传光牛卫宁尚晓娅
徐春兰,钦传光,牛卫宁,尚晓娅
西北工业大学生命科学院,西安 710072
Enterobacter cloacaeZ0206细菌胞外多糖的体外抗氧化活性研究
徐春兰,钦传光*,牛卫宁,尚晓娅
西北工业大学生命科学院,西安 710072
本实验旨在对 Enterobacter cloacaeZ0206菌进行发酵培养,以制备胞外多糖,并对其体外抗氧化活性进行初步研究。通过产多糖菌 E.cloacaeZ0206的深层发酵制备细菌胞外多糖,在此基础上对其清除DPPH自由基、超氧阴离子、抑制羟自由基的能力以及还原力等四个方面进行实验,评价其抗氧化活性。结果表明,深层发酵制备的 E.cloacaeZ0206胞外多糖产量为 6.62 g/L,其在 5 mg/mL时对DPPH自由基和羟自由基的清除率分别达到 61.57%和 40.08%。提示 E.cloacaeZ0206细菌胞外多糖具有显著的抗氧化能力,具有开发为抗氧化类食品或药品的潜力。
Enterobacter cloacae;胞外多糖;自由基;抗氧化
随着自由基生物学和医学研究的日趋深入和发展,活性氧自由基的致病作用机制研究正引起人们的巨大关注[1-3]。大量的研究表明,抗氧化剂可以通过自由基清除作用机制来降低或缓解细胞损伤甚至凋亡[4,5],降低疾病的发生率。然而,化学合成类抗氧化剂大多有毒副作用,因此,寻找低毒或无毒的天然抗氧化剂具有十分重要意义。
多糖是自然界中含量最丰富的物质之一,也是与人类生活紧密相关的一类生物高分子。多糖具有免疫调节、抗肿瘤、抗氧化、降血糖、降血脂等多种重要的生物学功能,因此,对多糖的研究已成为功能食品界的热门领域。国内外近年来对于多糖的抗氧化作用进行了广泛的研究[6,7],并有人据此解释了多糖抗衰老功效的药理机理,多糖的抗氧化作用已经成为最为活跃的研究课题之一。通常植物和藻类来源的多糖较为普遍,但近些年来,微生物来源的多糖也引起人们的广泛关注,尤其是细菌和真菌来源的胞外多糖,因其易于分离纯化而且产量高等优点在工业生产中颇受人们青睐[8,9]。
本研究首次对从肉灵芝上分离的阴沟肠杆菌Enterobacter cloacaeZ0206进行发酵培养,并对其所分泌的胞外多糖 (Exopolysaccharide,EPS)的体外抗氧化活性进行研究,以期为 E.cloacaeZ0206胞外多糖药物及功能性食品研究开发提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株
阴沟肠杆菌 Enterobacter cloacaeZ0206,由浙江大学汪以真教授馈赠。
1.1.2 培养基
改良 PDA培养基:20%的马铃薯浸汁,蛋白胨3 g,酵母提取物 3 g,蔗糖20 g,琼脂16 g,蒸馏水定容至 1000 mL,自然 pH值;基础发酵培养基:改良的PDY培养基 (不加琼脂的改良 PDA培养基);20%的马铃薯浸汁的制备:将马铃薯 200 g洗净去皮切片,加蒸馏水煮沸半个小时,4层纱布过滤,滤液于 4℃下冷藏 24 h,5000 r/min离心,弃沉淀得到的上清液即20%的马铃薯浸汁。
1.1.3 主要试剂和仪器
葡萄糖、无水乙醇、丙酮、正丁醇、硫酸亚铁、盐酸、乙醚、氯仿、Vc均为国产分析纯;1,1-二苯基苦味酰基苯肼(DPPH)购自 Sigma公司;邻苯三酚购自中国医药集团上海化学试剂公司;其他试剂均为国产分析纯。752型紫外可见分光光度计,由上海第三分析仪器厂生产;DK-8D数显电热恒温水槽,由上海森信实验仪器有限公司生产;EYELA N-1000旋转蒸发仪,由日本东京理化器械株式会社生产;D-78532 Tuttlingen、Universal R台式冷冻离心机,德国;冷冻干燥机(ChristALPHA 1-2),德国。
1.2 方法
1.2.1 E.cloacaeZ0206胞外多糖(EPS)的制备
取出冷藏的 E.cloacaeZ0206菌种,室温放置 1h后,在 PDA培养基上 2次活化后,接种到基础发酵培养基中进行试管发酵培养,30℃往复振荡培养,培养时间 10 h,得到摇瓶发酵种子液。2000 mL摇瓶内装入 500 mL基础发酵培养基,121℃蒸汽灭菌20 min,接种种子液,发酵时间 48 h,得到含有 E.cloacaeZ0206的发酵液。发酵液于 50℃浓缩为原体积的 1/10,90℃水浴 1 h,5000 rpm离心 15 min,收集上清液,加入 3~5倍体积预冷的 95%乙醇,4℃静置 24 h后,5000 rpm离心 15 min,沉淀真空干燥,即得到粗多糖粉末。将其溶于适量蒸馏水,Sevag法除蛋白,反复进行多次至无蛋白层,然后用自来水透析和蒸馏水各透析 24 h,透析液中加无水乙醇,置 4℃冰箱中醇沉过夜,再离心分离,沉淀依次用无水乙醇、丙酮、乙醚各洗涤 2次,真空干燥,即得到 E.cloacaeZ0206胞外多糖精品 (EPS)。其中多糖的测定采用苯酚-硫酸法,蛋白质含量的测定用考马斯亮蓝法。
1.2.2 清除DPPH自由基试验
准确地将 EPS配成 5.0 mg/mL,用超纯水将该溶液稀释成 6种浓度:0.16、0.31、0.625、1.25、2.5、5.0 mg/mL。以维生素 C(Vc)为对照品。称取 20 mg的DPPH用无水乙醇溶解定容至 500 mL。试验分为样品组和空白对照组:取 2 mL 40 mg/L的DPPH溶液加入 10 mL具塞的试管中,再加入 2 mL样品溶液,空白对照组以超纯水代替样品溶液,充分混匀,室温下避光反应 30 min后,在 517 nm处测定吸光度。EPS清除 DPPH自由基的能力由下式计算: DPPH自由基清除率(%)=(A0– A1)/A0×100%,式中A0为空白对照的平均吸光度值,A1为试样的平均吸光度值。
1.2.3 清除羟自由基试验
将 EPS用双蒸水配制成质量浓度为 5 mg/mL的多糖溶液,并稀释成 6个不同浓度:0.16、0.31、0.625、1.25、2.5、5 mg/mL。各取 2 mL上述浓度的多糖溶液,依次加入 6 mmol/L的 FeSO4溶液 2 mL,混匀,6 mmol/L的 H2O2溶液 2 mL,混匀,静置 30 min后于 510 nm处测其吸光度值。空白对照组以双蒸水代替多糖溶液,以维生素 C(Vc)做对照,临用前以双蒸水配制。羟自由基的清除率以下式计算:羟自由基清除率 (%)=(A0– A1)/A0×100%,式中A0为空白对照的平均吸光度值,A1为试样的平均吸光度值。
1.2.4 清除超氧阴离子自由基试验
将 EPS用双蒸水配制成质量浓度为 5 mg/mL的多糖溶液,并稀释成 6个不同浓度:0.16、0.31、0.625、1.25、2.5、5 mg/mL。取 0.05 mol/L Tris-HCl缓冲溶液(pH=8.2)4.5 mL,置于 25℃水浴中预热25 min,分别加入 1 mL不同浓度的多糖溶液和 0.4 mL 25 mmol/L邻苯三酚溶液,空白对照组以双蒸水代替多糖溶液,混匀后在 25℃水浴中反应 5 min,加入 1 mL 8 mol/L的 HCl终止反应,于 299 nm处测吸光度。超氧阴离子的清除率以下式计算:超氧阴离子的清除率(%)=(A0-A1)/A0×100%,式中 A0为空白对照的平均吸光度值,A1为试样的平均吸光度值。
1.2.5 还原能力的测定
将 EPS用双蒸水配制成质量浓度为 5 mg/mL的多糖溶液,并稀释成 6个不同浓度:0.16、0.31、0.625、1.25、2.5、5 mg/mL,各取 1 mL上述浓度的多糖溶液,加入 pH=6.6的磷酸盐缓冲液 2.5 mL、1%铁氰化钾 2.5 mL,混合均匀后于 50℃水浴中保温 20 min,再加入10%的三氯乙酸 2.5 mL,混匀,以3000 rpm离心 10 min,移取上清液 2.5 mL于试管中,加蒸馏水2.5 mL和 0.1%FeCl30.5 mL,常温反应 5 min后于 700 nm处测定吸光度值。用Vc做对照,临用前用双蒸水配制。
2 结果与讨论
2.1 E.cloacaeZ0206胞外多糖的制备及其多糖和蛋白质含量的测定
将产多糖菌 E.cloacaeZ0206进行深层发酵后,发酵液经浓缩、水煮醇沉、离心,冷冻干燥等过程,得到白色粉末为胞外多糖粗品,产率为 6.62 g/L;进一步经 Sevag法脱蛋白,丙酮、乙醚洗涤,真空冷冻干燥,得到白色胞外多糖精品 (EPS)。用葡萄糖为对照品,用苯酚-硫酸法测得粗多糖中多糖的含量为67.5%,精制多糖中多糖含量为 97.86%,糖含量测定的标准曲线见下图 1。用牛血清白蛋白为对照品,用考马斯亮蓝法测得粗多糖中蛋白含量为20.8%,精制多糖中蛋白含量为 2.14%,蛋白质标准曲线见下图 2。


2.2 E.cloacaeZ0206胞外多糖对 DPPH自由基的清除活性
EPS对 DPPH自由基的清除能力以清除率表示,清除率越高,说明该多糖抗氧化作用越强。EPS与Vc对DPPH自由基清除作用的试验结果如图 3所示。DPPH自由基是一种很稳定的以氮为中心的自由基,若受试物能清除它,则提示受试物具有降低羟自由基、烷自由基和过氧自由基的有效浓度和打断脂质过氧化链反应的作用。DPPH自由基有个单电子,在 517 nm有强吸收,其乙醇溶液呈深紫色,加入受试物后,在 517 nm可以监测其对DPPH自由基清除效果。由图3可见,EPS和Vc对DPPH自由基均有不同程度抑制作用,随着浓度的增大 EPS和Vc清除能力接近,浓度 1.25 mg/mL时清除率已达54.49%,浓度为 5 mg/mL时,清除率达到 61.57%,这些结果说明EPS在一定浓度范围内对DPPH自由基具有一定得清除活性。
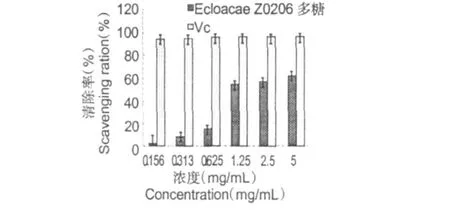
图 3 E.cloacaeZ0206胞外多糖和 Vc对 DPPH自由基的清除能力(±s,n=5)Fig.3 Scavenging effects of EPS and Vc on DPPH radicals (±s,n=5)
2.3 E.cloacaeZ0206胞外多糖对羟自由基的清除活性
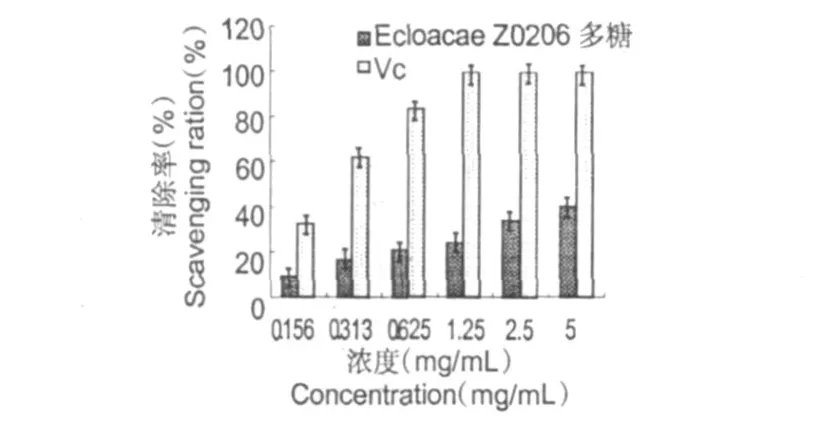
图 4 E.cloacaeZ0206胞外多糖和 Vc对·OH的清除能力(±s,n=5)Fig.4 Scavenging effects of EPS and Vc on hydroxyl free radicals(±s,n=5)
羟自由基清除率是反映药物抗氧化作用的重要指标。在反应体系中 H2O2和 Fe2+混合发生 Fenton反应,生产具有很高反应活性的·OH,其能被水杨酸有效的捕捉,并生成有色物质;但若加入具有清除作用的物质,便会与水杨酸竞争,从而使有色产物生成量减少。因而可用吸光值的变化来反映该多糖对·OH的清除能力。从图 4可见,在 0.156~5 mg/ mL的有效浓度范围内,随着 EPS浓度的增加,其清除·OH的作用逐渐增强,在 5 mg/mL时对·OH的清除率达 40.08%。
2.4 E.cloacaeZ0206胞外多糖对超氧阴离子自由基的清除活性
超氧阴离子自由基是基态氧接受一个电子后形成的第一个氧自由基,可以经过一序列反应生成其它的氧自由基。多糖分子上均有还原性的半缩醛羟基,能与超氧阴离子自由基发生氧化还原反应,从而终止自由基链式反应。·清除率是反映药物抗氧化作用的重要指标之一。EPS与 Vc对·自由基清除作用的试验结果如图 5所示,由图 5可见, EPS对超氧阴离子自由基的清除能力相对较弱,在浓度为 5 mg/mL时,清除率仅为 13.68%。

图 5 E.cloacaeZ0206胞外多糖和 Vc对 ·的清除能力 (±s,n=5)Fig.5 Scavenging effects of EPS and Vc on superoxide anion free radicals(±s,n=5)
2.5 E.cloacaeZ0206胞外多糖的还原能力
抗氧化剂是通过自身的还原作用给出电子而清除自由基的,还原力越强,抗氧化性越强。药物还原力的大小在一定程度上反映了其预防性抗氧化功能的强弱。因此,可通过测定还原力来说明抗氧化活性的大小。EPS与 Vc的还原力的试验结果如图 6所示。从图 6可见,在 0.156 mg/mL~5 mg/mL的有效浓度范围内,随着 EPS浓度的增加,还原力逐渐增强。当质量浓度为 0.156 mg/mL时,多糖的吸光值为 0.029;当质量浓度为 5 mg/mL时,多糖的吸光值为 0.535,提示 EPS浓度具有一定的还原能力。
已知自由基对 DNA、蛋白质、酶和脂质等生物分子具有氧化损伤作用,从而导致机体的衰老和多种病变[1]。抗氧化多糖的发现,与其他外源性抗氧化剂相比,抗氧化多糖具有低毒、安全来源广等特点。作为外源性抗氧化剂,多糖在生物体内发挥作用更为复杂,它可直接参与催灭自由基的途径外,还可能与通过调节机体内内源性抗氧化剂的活性相关[10,11]。多糖可以作为一种天然的生物抗氧化剂进行复配,增强人体健康的保护作用。但为最终获得抗氧化活性高的目标化合物,为新药或保健品的开发研究奠定理论基础,还需要进一步开展体内生物功效以及抗氧化作用与其构效关系的研究[12]。目前对多糖的抗氧化活性研究一般采用体外模型,即以清除自由基的效率以及还原能力的大小等为检测指标,从离体或整体水平上衡量多糖抗氧化作用的大小[13]。Wang等报道 1株成团泛菌 (Pantoea agglom erans)多糖对羟自由具有显著的清除能力[14]。
EPS具有清除 DPPH自由基和羟自由基的作用,并且随着糖浓度的增加,对DPPH和羟自由基的清除力增强,呈明显的量效关系;对邻苯三酚体系产生的·具有一定的清除作用,但清除率低于 Vc对超氧阴离子自由基的抑制作用。从其对几种自由基的清除作用来看,EPS对DPPH自由基的清除作用最强,其对活性氧自由基的清除作用可能存在一定得选择性。本实验结果提示 EPS在体外对活性氧自由基均有清除作用,从而能够清除体内产生的过多氧自由基,阻断体内自由基反应链的作用,并在抗氧化剂抗衰老方面具有一定的作用,是一种很有开发潜力的抗氧化、防衰老的食品或药物。当然,在后期的试验中,将在结构表征的基础上,通过细胞模型和动物模型对 EPS的体内外抗氧化活性做深入研究,以探究其构效关系,以为其开发利用奠定一定的基础。
1 Finkel T,Holbrook NJ.Oxidants,oxidative stress and the biology of aging.Nature,2000,408:239-247.
2 Guzy RD,HoyosB,Robin E,et al.Mitochondrial complex III is required for hypoxia-induced ROS production and cellular oxygen sensing.CellM etab,2005,1:401– 408.
3 Fu JJ,Huang HQ,Liu JJ,et al.Tanshinone I IA protects cardiac myocytes against oxidative stress-triggered damage and apoptosis.Eur J Phar m acol,2007,568:213– 221.
4 Angeloni C,Spencer JPE,Leoncini E,et al.Role of quercetin and its in vivo metabolites in protecting H9c2 cells against oxidative stress.B iochim ie,2007,89:73– 82.
5 Bognar Z,Kalai T,Palfi A,et al.A novel SOD– mimetic per meability transition inhibitor agent protects ischemic heart by inhibiting both apoptotic and necrotic cell death.Free RadicalB iolM ed,2006,41:835– 848.
6 Sun C,Shan CY,Gao XD,et al.Protection of PC12 cells from hydrogen peroxide-induced injury by EPS2,an exopolysaccharide from a marine filamentous fungusKeissleriellasp. YS4108.J B iotechnol,2005,115:137-144.
7 Chen H,Yan X,Zhu P,et al.Antioxidant activity and hepatoprotective potential of agaro-oligosaccharides in vitro and in vivo.Nutr J,2006,5:31-41.
8 Looijestenijn PJ,Boels IC,Kleerebezem M,et al.Regulation of exopolysaccharide production byLactococcus lactissubsp. cremorisby the sugar source.Appl Environ M icrobiol,1999, 65:5003-5008.
9 Levander F,Radstrom P.Requirement for phosphoglucomutase in exopolysaccharide biosynthesis in glucose and lactose utilizingStreptococcus ther m ophilus.Appl Environ M icrobiol,2001,67:2734– 2738.
10 Zeng KH(曾凯宏),Ming J(明建),Zeng KF(曾凯芳). Structure and Function of Fungi Polysaccharides.Food Sci Technol(食品科技),2001,37:66-68
11 Yang ZN,Huttunen E,StaafM,et al.Separation,purification and characterization of extracellular polysaccharides produced by sl ime-for ming,actococcuslactisssp.cremoris strains.IntDairy J,1999,9:631-638.
12 He S Y(何书英),Zhan T(詹彤),Wang S R(王淑如). Study on Chemistry and Antioxidant Activity ofWater Soluble PolysaccharidesofRhizom a D ioscoreaeOppositae.J China Phar maceut Univ(中国药科大学学报),1994,25:369-371.
13 Ran L(冉靓),Yang XS(杨小生),Wang BC(王伯初),et al.Progress in Studies of Antioxidant Polysaccharides.Lishizhen M ed M atM ed Res(李时珍国医国药),2006,17:494-496.
14 Wang HY,Jiang XL,Mu HJ.Structure and protective effect of exopolysaccharide fromP.Agglom eransstrain KFS-9 againstUV radiation.M icrobiol Res,2007,162:124-129.
Antioxidative Activity of Exopolysaccharide Produced byEnterobacter cloacaeZ0206
XU Chun-lan,Q IN Chuan-guang*,N IU Wei-ning,SHANG Xiao-ya
Faculty of Life Sciences,Northwestern Polytechnical University,Xi’an 710072,China
The experiment was conducted to prepare exopolysaccharide(EPS)fromEnterobacter cloacaeZ0206 strain through fermentation and to evaluate its antioxidant activity.By determining the reducing capability,the scavenging effects of EPS on 1,1-diphenyl-2-picrylhy-drazyl(DPPH)radicals,superoxide anion free radicals,and hydroxyl radicals,the antioxidant activity of EPSwere evaluated.The results showed that the yield of EPSwas 6.62 g/L and the scavenging effects of EPSon theDPPH free radical and the hydroxyl radicals reached 61.57%and 40.08%at concentration of 5 mg/mL,respectively.The EPS exhibited obvious antioxidant activity and wasworthy of exploitation in future.
Enterobacter cloacae;exopolysaccharide;free radicals;antioxidant
1001-6880(2010)06-1098-05
2009-06-30 接受日期:2009-08-24
中国博士后科学基金 (20080440195)和西北工业大学科技创新基金(2008KJ02040)。
*通讯作者 Tel:86-29-88491840,E-mail:lx304319@163.com
TS201.2
A
