丹酚酸B对高脂日粮小鼠抗氧化与淋巴细胞亚群免疫功能调节的研究
2010-11-24施用晖1乐国伟11江南大学食品科学与技术国家重点实验室江南大学食品学院食品营养与安全研究所无锡141
王 斌,崔 珏,肖 瀛,施用晖1,,乐国伟1,*1江南大学食品科学与技术国家重点实验室;江南大学食品学院食品营养与安全研究所,无锡 141
丹酚酸B对高脂日粮小鼠抗氧化与淋巴细胞亚群免疫功能调节的研究
王 斌2,崔 珏2,肖 瀛2,施用晖1,2,乐国伟1,2*1江南大学食品科学与技术国家重点实验室;2江南大学食品学院食品营养与安全研究所,无锡 214122
本文研究了丹酚酸B(Salvianolic acid B,SalB)对饲喂高脂日粮小鼠抗氧化及淋巴细胞亚群免疫功能调节的影响。选取 4 w龄雄性 C57BL/6小鼠 40只,随机平均分成 4组:即正常对照组 (正常日粮),高脂日粮组(高脂日粮),SalB低剂量组(高脂日粮 +0.002%SalB)和 SalB高剂量组 (高脂日粮 +0.004%SalB)。八周后测定血脂、全血和脾脏活性氧(reactive oxygen species,ROS)水平、抗氧化酶活性及MDA含量;采用 FACSAria流式细胞仪分析小鼠外周血及脾脏淋巴细胞亚群。结果表明:SalB可显著降低高脂日粮小鼠血脂水平,全血及脾脏 ROS水平,提高抗氧化能力,提高 CD4+/CD8+T细胞比例及 CD19+细胞百分率(P<0.05)。低剂量 SalB组抗氧化与免疫调节功能好于高剂量 SalB组。
高脂日粮;丹酚酸B;血脂;活性氧;抗氧化酶;淋巴细胞亚群
长期高脂的摄入可导致机体抗氧化能力的显著降低,引起机体氧化应激[1],机体抗氧化能力的显著降低预示着体内自由基的产生和清除的动态平衡已被打破,大量自由基导致的氧化应激可以引起脂质过氧化、DNA和蛋白质的氧化损伤[2,3],破坏免疫细胞的膜结构和功能,影响免疫调节功能[4]。丹酚酸B(Salvianolic acid B)是丹参中重要的水溶性有效活性成分之一,其主要在降低血脂、抗氧化、减轻炎症损伤及调节血管内皮功能等方面发挥重要作用[5,6]。但 SalB对机体氧化应激和免疫功能紊乱的调节作用目前尚不清楚。
本实验以高脂日粮长期饲喂小鼠,建立氧化应激模型,研究 Sal B对长期摄食高脂日粮小鼠清除过量 ROS的抗氧化作用与淋巴细胞亚群免疫功能调节的影响。探讨 SalB抗氧化活性与淋巴细胞亚群免疫调节功能之间的关系,从而为营养性氧化应激引发机体免疫功能损伤疾病提供新的解决方案。
1 材料与方法
1.1 材料
1.1.1 试剂
鲁米诺(Luminol,生物级,苏州亚科化学试剂有限公司);辣根过氧化物酶 (Horseradish peroxidase, HRP,250 U/mg,北京拜尔迪生物技术有限公司);丹酚酸 B(纯度 78%,西安鸿生生物技术有限公司);单抗试剂:FITC anti-mouse CD4(L3T4)(克隆号:GK 1.5);PE anti-mouse CD8a(Ly-2)(克隆号: 53-6.7);PE-Cy5 anti-mouse CD3e(克隆号:145-2C11);PE anti-mouse CD19(克隆号:MB 19-1)(美国 eBioscience公司);流式细胞检测剂 (深圳晶美生物工程有限公司);EZ-SepμMouse 1X淋巴细胞分离液(深圳市达科为生物技术有限公司)。
1.1.2 仪器
MPI-B型多参数化学发光分析测试系统 (西安瑞迈分析仪器有限公司);UV1100型紫外可见分光光度计 (北京瑞利科学仪器有限公司);Multiskan Mk3酶标仪 (美国 Ther mo公司);FACSCalibur流式细胞仪(美国BD公司)。
1.1.3 动物
4周龄雄性 C57BL/6小鼠,清洁级,体重 10~14 g,由中国科学院上海实验动物中心提供。
1.2 方法
1.2.1 实验设计
选用 4周龄雄性健康 C57BL/6小鼠 40只,一周预饲后,按体重随机分成 4组:即正常对照组 (正常日粮),高脂模型组 (高脂日粮),低剂量 Sal B组(高脂日粮 +0.002%SalB)和高剂量 SalB组(高脂日粮 +0.004%Sal B),其中 Sal B混合于高脂日粮中,自由采食。日粮配方见表 1。饲养 8周后,各组小鼠隔夜禁食 12 h,摘眼球取血,肝素抗凝,取一部分全血测完 ROS和淋巴细胞亚群后,剩余全血低速离心(3000 r/min离心 15 min),取上层抗凝血浆用于血脂、抗氧化酶活性和MDA含量检测。断颈椎处死小鼠,无菌取出脾脏,一部分用于脾脏淋巴细胞亚群的检测,剩余部分制成 10%组织匀浆,取一部分脾脏组织匀浆检测 ROS,剩余脾脏匀浆液 4000 r/ min离心 10 min,取脾脏匀浆上清液用于抗氧化酶活性和MDA含量的检测。

表 1 实验日粮配方及营养组成(%)Table 1 Formula and nutrients content of the diet(%)
1.2.2 血脂代谢指标的检测
血浆总胆固醇(TC)、甘油三酯 (TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白(LDL-C)含量的测定均按中生北控生物科技股份有限公司试剂盒进行测定。
1.2.3 全血及脾脏中 ROS水平的测定
参照 luminol化学发光法[7-9]测定,新鲜抗凝血15μL稀释于 865μL Hepes(pH 7.4)缓冲液中 (或10%脾脏组织匀浆 50μL稀释于 830μL HEPES缓冲液),加入 20μL HRP(12.4 U/mL)作为催化剂,混匀反应体系,ROS水平使用MPI-B型多参数化学发光检测仪进行检测,启动发光后注射 100μL luminol(5 mmol/mL)于反应瓶中,以发光强度表示ROS水平的高低。
1.2.4 抗氧化酶活性及MDA含量检测
超氧化物岐化酶(SOD)采用邻苯三酚自氧化法测定[10];过氧化氢酶 (CAT)、总抗氧化能力 (TAOC)和丙二醛(MDA)按南京建成生物工程研究所试剂盒进行测定。
1.2.5 外周血淋巴细胞亚群的检测
小鼠眼球取血后,每个样本取 200μL抗凝全血平均加入到 2个上样管中,避光分别标记 CD单抗(按试剂说明书加量),混匀,室温避光孵育 30 min后每管加入 1*流式细胞检测剂 2 mL充分混匀,室温避光孵育 10 min,1000 r/min,5 min离心去上清, PBS洗 2次细胞,0.5 mL PBS重悬细胞,振荡混匀后上机检测外周血淋巴细胞 CD3+,CD3+CD4+, CD3+CD8+和 CD19+的细胞百分含量。
1.2.6 脾脏淋巴细胞亚群的检测
无菌取小鼠新鲜脾脏于不锈钢网上剪碎,加入4 mL淋巴细胞分离液,用注射器活塞研磨,制备脾细胞悬液后,加入 1 mL RPM I1640培养基,3000 r/ min离心 30 min,吸出淋巴细胞层,加入 10 mL 1640培养基洗涤一次,2500 r/min离心 10 min,去上清, PBS重悬,细胞计数。每个样本取 200μL单细胞悬液平均加入到 2个上样管中,避光分别标记 CD单抗 (按试剂说明书加量),振荡混匀,室温避光孵育30 min,PBS洗 2次,加入 0.5 mL PBS重悬细胞,振荡混匀后上机检测脾脏淋巴细胞 CD3+,CD3+CD4+,CD3+CD8+和 CD19+的细胞百分含量。
1.3 数据处理与统计方法
利用 CELLQuest软件分析流式细胞仪上获取的数据。采用 SPSS 13.0统计软件进行方差分析、相关分析和 t检验。
2 结果
2.1 SalB对高脂日粮小鼠血脂代谢的影响
表 2 SalB对高脂日粮小鼠血脂代谢的影响(mmol/L,±s,n=10)Table 2 Effects of SalB on the plasma lipid status in high-fat diet fed mice(mmol/L,±s,n=10)
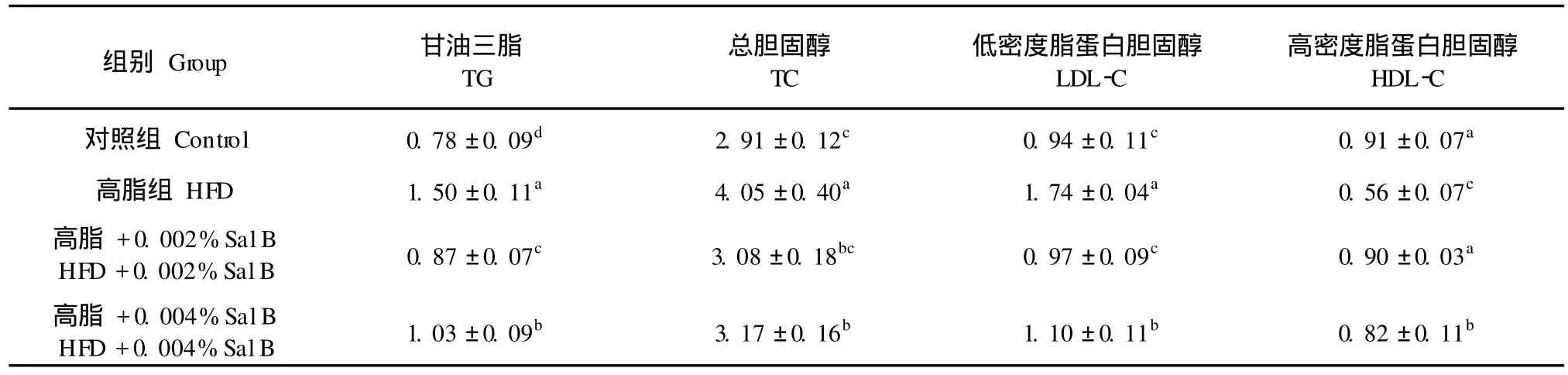
表 2 SalB对高脂日粮小鼠血脂代谢的影响(mmol/L,±s,n=10)Table 2 Effects of SalB on the plasma lipid status in high-fat diet fed mice(mmol/L,±s,n=10)
注:同列不同字母表示差异显著(P<0.05),下表同。Note:Valueswith different superscript letterswith in a row are significantly different(P<0.05).The same as below.
组别Group 甘油三脂TG总胆固醇TC低密度脂蛋白胆固醇LDL-C高密度脂蛋白胆固醇HDL-C对照组Control 0.78±0.09d 2.91±0.12c 0.94±0.11c 0.91±0.07a高脂组HFD 1.50±0.11a 4.05±0.40a 1.74±0.04a 0.56±0.07c高脂 +0.002%SalB HFD+0.002%SalB 0.87±0.07c 3.08±0.18bc 0.97±0.09c 0.90±0.03a高脂 +0.004%SalB HFD+0.004%SalB 1.03±0.09b 3.17±0.16b 1.10±0.11b 0.82±0.11b
由表 2可见,与正常日粮组相比,高脂日粮组小鼠血浆 TG、TC、LDL-C含量显著增高,HDL-C含量显著降低 (P<0.05)。添加低剂量的 Sal B (0.002%)可显著降低高脂日粮小鼠血浆 TG、TC、LDL-C含量,显著升高 HDL-C含量 (P<0.05),且低剂量 SalB(0.002%)组小鼠 TC、LDL-C和HDL-C含量与正常日粮组无显著性差异(P>0.05)。高剂量 SalB(0.004%)组小鼠 TG、TC、LDL-C含量较高脂日粮组有所降低,HDL-C较高脂日粮组有所升高,但其 TG和 LDL-C含量显著高于低剂量 Sal B (0.002%)组 (P<0.05),HDL-C含量显著低于低剂量 SalB(0.002%)组(P<0.05)。
2.2 SalB对高脂日粮小鼠全血与脾脏 ROS水平的影响
由图 1可见,与正常日粮组相比,高脂日粮组小鼠全血 ROS水平显著增高 (P<0.05)。添加低剂量的 SalB(0.002%)可显著降低高脂日粮小鼠全血ROS水平(P<0.05),高剂量 Sal B(0.004%)组与高脂日粮组水平无明显差异(P>0.05)。
高脂日粮使小鼠脾脏 ROS水平显著提高 (P< 0.05)。SalB的添加可显著降低高脂日粮小鼠脾脏ROS水平(P<0.05),低剂量 Sal B(0.002%)组脾脏 ROS水平低于高剂量 Sal B(0.004%)组 (P> 0.05)。

图 1 SalB对高脂日粮小鼠全血、脾脏 ROS水平的影响(mmol/L,±s,n=10)Fig.1 Effects of SalB on the ROS of blood and spleen in high-fat diet fed mice(mmol/L,±s,n=10)
2.3 SalB对高脂日粮小鼠血浆抗氧化酶活性及MDA含量的影响
表 3 SalB对高脂日粮小鼠血浆抗氧化酶活性及MDA含量的影响(±s,n=10)Table 3 Effects of SalB on the antioxidase activity and the content ofMDA in blood plasma of high-fat diet fed mice(±s,n=10)

表 3 SalB对高脂日粮小鼠血浆抗氧化酶活性及MDA含量的影响(±s,n=10)Table 3 Effects of SalB on the antioxidase activity and the content ofMDA in blood plasma of high-fat diet fed mice(±s,n=10)
组别Group T-AOC(U/mL) CAT(U/mL) SOD(U/mL) MDA(nmol/mL)对照组Control 5.27±0.44a 27.21±3.43a 2.48±0.18a 25.20±2.25c高脂组HFD 4.32±0.22b 17.80±3.14b 1.45±0.21c 37.61±3.16a高脂 +0.002%SalB HFD+0.002%SalB 5.04±0.40a 24.67±3.32a 2.19±0.22b 26.85±2.63c高脂 +0.004%SalB HFD+0.004%SalB 4.58±0.34b 19.33±2.25b 1.62±0.15c 29.82±2.32b
由表 3可知,与正常日粮组相比,高脂日粮组小鼠血浆 CAT、SOD及总抗氧化能力显著降低,MDA含量显著升高(P<0.05)。在高脂日粮基础上添加低剂量 Sal B(0.002%)显著提高小鼠血浆 CAT、SOD及总抗氧化能力 (P<0.05),高剂量 Sal B (0.004%)组与高脂日粮组相比,血浆 CAT、SOD及总抗氧化能力水平无明显差异 (P>0.05)。高、低剂量 SalB组均可显著降低高脂日粮小鼠血浆MDA含量(P<0.05),且低剂量 Sal B(0.002%)组MDA水平低于高剂量 SalB(0.004%)组 (P<0.05)。
2.4 SalB对高脂日粮小鼠脾脏抗氧化酶活性及MDA含量的影响
表 4 SalB对高脂日粮小鼠脾脏抗氧化酶活性及MDA含量的影响(±s,n=10)Table 4 Effects of SalB on the actioxidase activity and the content ofMDA in spleen of high-fat diet fed mice(±s,n=10)

表 4 SalB对高脂日粮小鼠脾脏抗氧化酶活性及MDA含量的影响(±s,n=10)Table 4 Effects of SalB on the actioxidase activity and the content ofMDA in spleen of high-fat diet fed mice(±s,n=10)
组别Group T-AOC(U/mg prot) CAT(U/mg prot) SOD(U/mg prot) MDA(nmol/mg prot)对照组Control 0.29±0.04a 5.34±0.36a 30.39.±4.25a 2.61±0.28c高脂组HFD 0.15±0.03c 4.34.±0.33b 22.79.±5.92b 3.55±0.36a高脂 +0.002%SalB HFD+0.002%SalB 0.27±0.04a 5.12±0.63a 29.44.±4.73a 2.83±0.42bc高脂 +0.004%SalB HFD+0.004%SalB 0.20±0.04b 4.58±0.58b 27.86±5.53ab 3.16±0.46ab
与正常日粮组相比,高脂日粮组小鼠脾脏CAT、SOD及总抗氧化能力显著降低,MDA含量显著升高(P<0.05)。在高脂日粮基础上添加低剂量SalB(0.002%)显著提高小鼠脾脏 CAT、SOD及总抗氧化能力,降低MDA含量(P<0.05)。添加高剂量 SalB(0.004%)可显著提高高脂日粮小鼠总抗氧化能力(P<0.05),而 CAT、SOD及MDA水平与高脂日粮组相比无明显差异(P>0.05),见表 4。
2.5 SalB对高脂日粮小鼠外周血淋巴细胞亚群的影响
高脂日粮组与正常日粮组比较,小鼠外周血中CD3+CD4+细胞百分率降低,而 CD3+CD8+细胞百分率显著升高 (P<0.05),CD3+CD4+与 CD3+CD8+比值显著低于正常日粮组 (P<0.05)(表 5)。在高脂日粮基础上添加高、低剂量 Sal B均能显著提高高脂日粮小鼠 CD3+CD4+细胞百分率 (P< 0.05),低剂量 Sal B(0.002%)组 CD3+CD4+与CD3+CD8+比值和正常日粮组无明显差异 (P> 0.05)。高脂日粮使 CD19+细胞百分率显著降低(P <0.05),高、低剂量 Sal B均能显著提高高脂日粮小鼠 CD19+细胞百分率 (P<0.05),低剂量 Sal B (0.002%)组 CD19+细胞百分率与正常日粮组无明显差异(P>0.05)。
表 5 SalB对高脂日粮小鼠外周血淋巴细胞亚群的影响(±s,n=10)Table 5 Effects of SalB on the lymphocyte subsets of peripheral blood in high-fat diet fed mice(±s,n=10)

表 5 SalB对高脂日粮小鼠外周血淋巴细胞亚群的影响(±s,n=10)Table 5 Effects of SalB on the lymphocyte subsets of peripheral blood in high-fat diet fed mice(±s,n=10)
组别Group CD3+CD4+(%) CD3+CD8+(%) CD4+/CD8+ CD19+(%)对照组Control 14.65±1.34a 9.87±1.04b 1.49±0.17a 49.26±2.78a高脂组HFD 10.41±0.82c 11.46±0.89a 0.91±0.10b 34.59±3.38c高脂 +0.002%SalB HFD+0.002%SalB 15.72±1.29a 10.16±0.99b 1.56±0.20a 48.92±4.10a高脂 +0.004%SalB HFD+0.004%SalB 12.55±2.51b 12.16±1.10a 1.02±0.12b 44.99±3.54b
2.6 SalB对高脂日粮小鼠脾脏淋巴细胞亚群的影响
高脂日粮组与正常日粮组相比,小鼠脾脏中CD3+CD4+细胞百分率降低,而 CD3+CD8+细胞百分率显著升高 (P<0.05)。CD3+CD4+与 CD3+CD8+比值显著低于正常日粮组 (P<0.05)(见表6)。低剂量 SalB(0.002%)组能够显著降低 CD3+CD8+细胞百分率,提高 CD3+CD4+与 CD3+CD8+比值(P<0.05),高剂量 Sal B(0.004%)组 CD3+CD4+与 CD3+CD8+比值与高脂日粮组无明显差异(P>0.05)。高脂日粮使小鼠脾脏 CD19+细胞百分率显著降低(P<0.05),在高脂日粮中添加高、低剂量 SalB均能显著提高小鼠脾脏中 CD19+细胞百分率 (P<0.05),低剂量 Sal B(0.002%)组 CD19+细胞百分率高于高剂量 Sal B(0.004%)组 (P< 0.05)。
表 6 SalB对高脂日粮小鼠脾脏淋巴细胞亚群的影响 (±s,n=10)Table 6 Effects of SalB on the lymphocyte subsets of spleen in high-fat diet fed mice(±s,n=10)
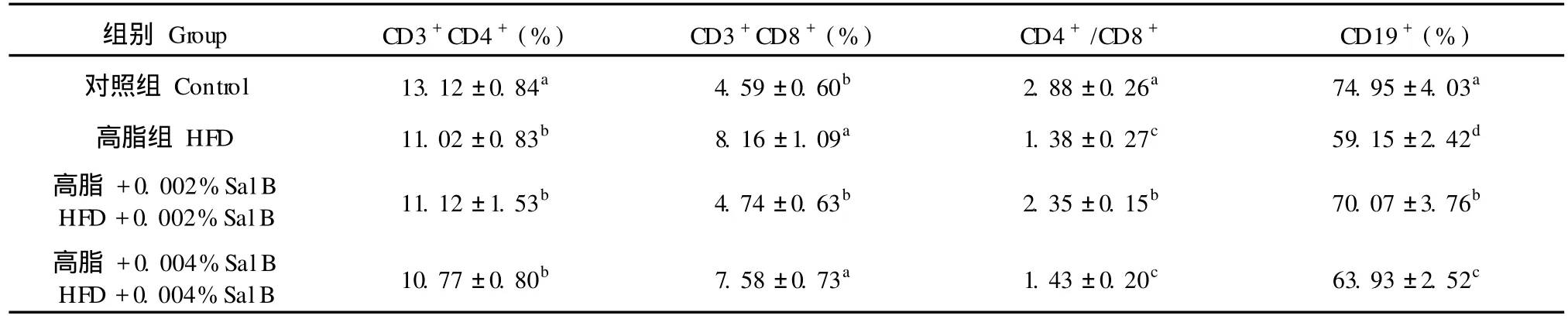
表 6 SalB对高脂日粮小鼠脾脏淋巴细胞亚群的影响 (±s,n=10)Table 6 Effects of SalB on the lymphocyte subsets of spleen in high-fat diet fed mice(±s,n=10)
组别Group CD3+CD4+(%) CD3+CD8+(%) CD4+/CD8+ CD19+(%)对照组Control 13.12±0.84a 4.59±0.60b 2.88±0.26a 74.95±4.03a高脂组HFD 11.02±0.83b 8.16±1.09a 1.38±0.27c 59.15±2.42d高脂 +0.002%SalB HFD+0.002%SalB 11.12±1.53b 4.74±0.63b 2.35±0.15b 70.07±3.76b高脂 +0.004%SalB HFD+0.004%SalB 10.77±0.80b 7.58±0.73a 1.43±0.20c 63.93±2.52c
2.7 相关性分析
对小鼠血浆、脾脏抗氧化能力与淋巴细胞亚群做相关性分析显示:小鼠血浆、脾脏淋巴细胞 CD3+CD4+与 CD3+CD8+比值、CD19+细胞百分率与活性氧自由基水平成显著负相关 (P<0.01),与抗氧化能力成显著正相关(P<0.01),见表 7。
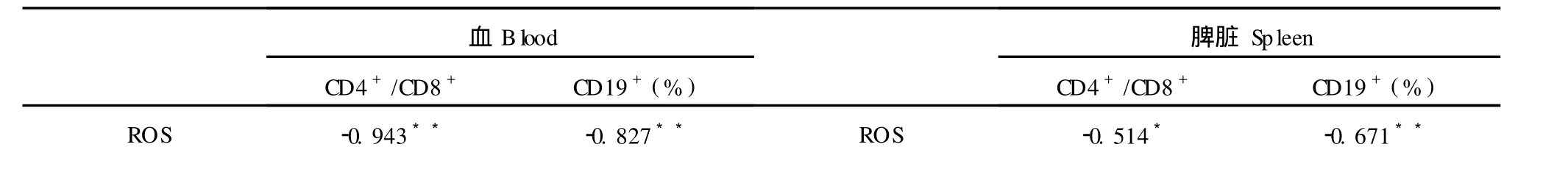
表 7 小鼠血浆、脾脏抗氧化酶活性及MDA含量与淋巴细胞亚群相关性分析Table 7 The correlation between the antioxidase activity,the content ofMDA and lymphocyte subsets in blood and spleen ofmice

注:*表示相关性显著 (P<0.05),**表示相关性极显著(P<0.01)。Note:*Correlation is at the 0.05 level(2-tailed),**Correlation is at the 0.01 level.
3 讨论
3.1 丹酚酸B对高脂日粮小鼠血脂代谢的影响
长期高脂膳食引起机体血脂代谢异常,血液中胆固醇或甘油三酯的含量过高,造成高脂血症,导致机体LDL-C含量升高,同时降低HDL-C的含量。而高水平的LDL-C和低水平的 HDL-C是引起动脉粥样硬化 (atherosclerosis,AS)的重要诱因[11],其可引起机体氧化与抗氧化状态失衡。本实验高脂日粮组小鼠血浆 TG、TC、LDL-C的含量显著升高,HDL-C含量显著降低,造成小鼠高血脂和氧化应激。Sal B的添加可显著降低高脂日粮小鼠血浆 TG、TC、LDLC含量,显著升高 HDL-C含量,低剂量 Sal B (0.002%)组小鼠 TG和LDL-C含量显著低于高剂量 SalB(0.004%)组,HDL-C含量显著高于高剂量SalB(0.004%)组。说明 Sal B的添加可以改善高脂日粮小鼠的血脂代谢紊乱,并且低剂量 Sal B (0.002%)的添加对高脂日粮小鼠降血脂效果好于高剂量 SalB(0.004%)。
3.2 丹酚酸B对高脂日粮小鼠全血和脾脏 ROS水平的影响
长期高脂膳食可引起自由基代谢紊乱,当血脂升高时,过多脂质沉积于血管内皮,使内皮产生的抗氧化酶含量下降,机体清除自由基的能力下降,产生大量自由基。在生物体系中,自由基及其诱发的脂质过氧化反应均可对机体产生一系列有害影响,损害细胞,导致多种病理过程[1,2]。抗氧化剂通过及时地清除体内过量的自由基,抵抗脂质过氧化,从而缓解自由基导致的氧化损伤。高脂日粮组小鼠全血、脾脏中 ROS水平较正常日粮组显著升高 (P< 0.05)。SalB的添加可降低高脂日粮小鼠全血及脾脏 ROS水平,且低剂量 SalB(0.002%)组与正常日粮组无明显差异(P>0.05),表明 SalB可以有效清除高脂日粮中大量产生的 ROS,并且低剂量 Sal B (0.002%)组清除 ROS作用好于高剂量 Sal B (0.004%)组。
3.3 丹酚酸B对高脂日粮小鼠血浆和脾脏抗氧化酶活性及MDA含量的影响
生物体本身有一系列清除自由基的抗氧化酶,如 CAT、SOD可以清除过多的 H2O2、O2-,有效降低·OH,从而减轻自由基的氧化损伤,总抗氧化能力是对机体非酶性抗氧化能力的综合评价指标。由本实验可知,高脂日粮组小鼠血浆和脾脏中 SOD、CAT抗氧化酶活性显著下降,总抗氧化能力显著降低。氧自由基不仅通过生物膜中多不饱和脂肪酸的过氧化引起细胞损伤,而且还通过脂质过氧化物的分解产物引起细胞损伤,因而MDA的量反映了机体内脂质过氧化程度,从而间接反映出细胞受自由基攻击的严重程度。本实验中高脂日粮组小鼠血浆和脾脏中MDA含量显著高于对照组,血浆与脾脏受到ROS的氧化损伤。
体内外实验研究表明,SalB通过恢复损伤细胞的抗氧化酶活力,保护 H2O2所致内皮细胞的氧化性损伤,并对脂质过氧化有很强的抑制作用[12]。本实验可知,高脂日粮使小鼠血浆和脾脏抗氧化酶活力和总抗氧化能力降低,MDA含量升高,这与高脂日粮使小鼠血脂水平升高相对应,进一步证实氧化应激/脂质过氧化确实参与了高脂膳食诱发的血脂代谢紊乱的发生、发展。在高脂日粮中添加低剂量SalB(0.002%)可有效恢复高脂日粮小鼠血浆和脾脏抗氧化酶活力,提高总抗氧化能力,降低高脂日粮小鼠血浆和脾脏 MDA含量。高剂量 Sal B (0.004%)的添加不能有效恢复高脂日粮小鼠的抗氧化能力。实验结果表明一定剂量的 Sal B可通过提高抗氧化酶活力,减少脂质过氧化,从而缓解高脂日粮造成的氧化损伤,并且低剂量 Sal B(0.002%)的添加对高脂日粮小鼠氧化应激的调节作用好于高剂量 SalB(0.004%)。
3.4 丹酚酸B对高脂日粮小鼠外周血和脾脏淋巴细胞亚群免疫功能的影响
机体生命代谢过程中产生大量有害的 ROS,这些 ROS在体内的累积可以诱导炎症反应,大大损害机体的免疫系统[13,14]。研究显示,氧化应激状态下,大量 ROS可以下行性调节树突状细胞和内皮细胞的抗原递呈作用,抑制 T淋巴细胞的活性[15]。
参与适应性免疫应答的淋巴细胞主要有两类,即 T淋巴细胞和B淋巴细胞。T细胞是体内发挥细胞免疫的重要细胞成分,并对B淋巴细胞分泌免疫球蛋白的过程进行调控。T细胞按其 CD4和 CD8表面标志可区分为 CD4+T细胞和 CD8+T细胞两个亚群。T细胞亚群的数目和 CD4+/CD8+T细胞的比例,是判断机体免疫功能状态的一项重要指标。CD19+分布于除浆细胞外的 B细胞谱系发育的各个阶段,是B细胞的重要标记,反映体液免疫的水平。
本文研究发现,高脂日粮使小鼠外周血和脾脏CD4+/CD8+T细胞的比值偏离正常日粮水平,提示高脂日粮小鼠 T淋巴细胞免疫功能异常。低剂量的 SalB(0.002%)的添加能通过增加CD4+T细胞、降低 CD8+T细胞,从而提高高脂日粮小鼠 CD4+/ CD8+T细胞的比值,协调免疫细胞间的相互作用。高剂量的 Sal B(0.004%)组小鼠 CD4+/CD8+T细胞的比值与高脂日粮组无显著性差异,不能有效地改善高脂日粮小鼠 T淋巴细胞免疫功能异常。Sal B的添加能有效提高小鼠外周血和脾脏 CD19+细胞比例,说明它对高脂日粮小鼠体液免疫功能低下有较好的改善作用。低剂量 Sal B(0.002%)组CD19+细胞水平高于高剂量 Sal B(0.004%)组,说明低剂量 SalB(0.002%)的添加对高脂日粮小鼠体液免疫功能低下的调节作用好于高剂量 Sal B (0.004%)。综上所述,高脂日粮造成小鼠淋巴细胞亚群免疫功能失调,低剂量 Sal B(0.002%)的添加可以改善高脂日粮诱导的小鼠免疫功能损伤,并且其作用效果好于高剂量的 SalB(0.004%)。
3.5 丹酚酸B改善高脂日粮小鼠氧化应激与免疫功能损伤的最适添加剂量
高脂膳食可引起机体血脂代谢紊乱,诱发糖尿病、动脉粥样硬化、冠心病、高血压、心脑血管疾病、肾病综合症和癌症等一系列疾病的发生,而高脂血症和动脉粥样硬化等疾病的形成是具有慢性炎症反应特征的病理过程,从而造成机体的免疫功能损伤。因此预防高脂膳食引起的免疫损伤是维持机体平衡、调节免疫功能紊乱的重要措施。由本实验结果可知,高脂日粮造成小鼠机体 ROS水平升高,诱发机体氧化应激,导致外周血和脾脏淋巴细胞亚群数量异常和平衡失调,机体免疫功能受损。相关性分析显示,抗氧化能力与淋巴细胞亚群密切相关,Sal B作为一种天然抗氧化剂能够缓解高脂日粮对小鼠免疫功能的损伤,其影响趋势与其抗氧化活性一致,其原因可能是 Sal B通过清除 ROS,提高机体抗氧化酶活力,缓解高脂日粮对免疫细胞的氧化损伤,调节淋巴细胞亚群分布,从而改善机体免疫功能。同时这也为营养性氧化应激引发机体免疫功能损伤疾病提供新的解决方案。
本实验中,低剂量 Sal B(0.002%)的降低血脂作用好于高剂量 SalB(0.004%)组,并且低剂量 Sal B的添加使高脂日粮小鼠 ROS水平、抗氧化酶活力、MDA含量和外周血淋巴细胞亚群分布恢复到正常日粮小鼠水平,而高剂量 SalB(0.004%)的添加,不能有效地改善高脂日粮小鼠的氧化应激和免疫功能损伤。在肝细胞培养中,添加适量的硫辛酸能够降低自由基水平,而高剂量时 ROS水平增高,如同脂溶性维生素VE一样,水溶性的丹酚酸 B过量使用也会导致自由基增加,影响机体抗氧化能力。0.002%SalB是抗氧化与免疫调节作用的适宜添加剂量。另外,SalB对高脂日粮小鼠免疫功能调节的作用机理有待于进一步研究。
1 Chen X,Zhong HY,Zeng JH,et al.The pharmacological effect of polysaccharides from Lentinus edodes on the oxidative status and expression ofVCAM-1mRNA of thoracic aorta endothelial cell in high-fat-diet rats.Carbohydr Polym,2008, 74:445-450.
2 Chan SHH,Tai MH,Li CY,et al.Reduction in molecular synthesis or enzyme activity of superoxide dis mutases and catalase contributes to oxidative stress and neurogenic hypertension in spontaneously hypertensive rats.Free Radical B iol M ed,2006,40:2028-2039.
3 Kohen R,Nyska A.Oxidation of biological systems:oxidative stress phenomena,antioxidants,redox reactions,and methods for their quantification.Toxicol Pathol,2002,30:620-650.
4 Guo ZG(郭志刚),Chen Y(陈瑗),Lu ZG(陆振刚),et al. The injury of lipid hydroperoxide and lipoperoxidativelymodified LDL to immunologic function ofmacrophage.Chin J M icrobiol Imm unol(中华微生物学和免疫学杂志),1991,11: 226-229.
5 Du GH(杜冠华),Zhang JT(张均田).Water soluble active ingredients ofDanshen--review on the Salvianolic acids.BasicM ed Sci Clinics(基础医学与临床),2000,20:394-395.
6 Du R(杜嵘),Zhang BL(张伯礼),Gao XM(高秀梅),et al.Effects of salveanolic acid B on expression of intercellular adhesion molecule-1 on cardiac microvascular endothelial cells of hypoxia.Chin J New D rugs Clin Rem(中国新药与临床杂志),2004,23:616-618.
7 Navid E,Sharma RK,Saleh RA,et al.Utility of the nitroblue tetrazolium reduction test for assessment of reactive oxygen species production by seminal leukocytes and sper matozoa.J Androl,2003,24:862-870.
8 AndrasN,JuditJ,Tamas K,et al.Physico chemicalmodeling of the role of free radicals in photodynamic therapy.Biochem.B iophys Res Comm un.1999,255:360-366.
9 Li YB,Zhu H,Trush MA.Detection of mitochondria-derived reactive oxygen species production by the chemilumigenic probes lucigenin and luminol.B iochim B iophys Acta,1999, 1428:1-12.
10 Xu YJ(许雅娟),Zhao YJ(赵艳景),Hu H(胡虹).Research on the measurement of the SOD activity via pyrogallol auto-oxidation.J Southwest Univ Nat,Nat Sci(西南民族大学,自科版),2006,32:1207-1209.
11 Harada S M,KinoshitaM,Kamido H,et al.Oxidised low density lipoprotein induces apoptosis in cultured human umbilical vein endothelial cells by common and unique mechanisms.B iol Chem,1998,273:9681-9687.
12 Wang XB(王晓斌),Yu F(于锋),Liu F(刘飞).Protective effect of salvianolicacid B on oxidative injury in HUVECs and its possible mechanism.J SoutheastUniv,M ed Sci(东南大学学报,医学版),2008,27:42-46.
13 Dandona P,Aljada A,Chaudhuri A,et al.Metabolic syndrome:a comprehensive perspective based on interactions between obesity,diabetes,and inflammation.Circulation,2005, 111:1448-1454.
14 Suematsu M,Suzuki H,Delano FA,et al.The inflammatory aspect of the microcirculation in hypertension:oxidative stress,leukocytes/endothelial interaction,apoptosis.M icrocirculation,2002,9:259-276.
15 RacanelliV,Reher mannB.The liver as an immunologicalorgan.Hepatology,2006,43:S54-S62.
Antioxidation and Immunomodulatory function on Lymphocyte Subsets of Salvianolic Acid B in High-fatD iet FedM ouse
WANG Bin2,CU IJue2,XIAO Ying2,SH I Yong-hui1,2,LE Guo-wei1,2*1State key Laboratory of Food Science and Technology,Jiangnan University,W uxi 214122,China;2Institute of Nutrition and Food Safety,School of Food Science and Technology,Jiangnan University,W uxi 214122,China
This article illustrates the effects of Salvianolic acid B(Sal B)on the antioxidation and immunomodulatory function of lymphocyte subsets in high-fat diet fed mouse.Forty male C57BL/6 mice were randomly assigned to four groups.The control group consumed an ordinary diet.The other three experimental groupswere fed with a high-fat diet, a high-fat diet plus 0.002%SalB,and a high-fat diet plus 0.004%SalB,respectively.After 8 weeks,the plasma lipid status,reactive oxygen species(ROS)level,actioxidase activity and the contentofMDA in blood and spleenwere examined.The proportion of lymphocyte subsets were deter mined by FACSAria Flow Cytometer.The results indicated that supplementation of SalB could decrease the levels of plasma lipid and ROS and increase the antioxidation index of highfat dietmice.It could increase the ratio of CD4+and CD8+T cell as well as the ratio of CD19+cell in experimental groups.The antioxidation and immunoregulation effects of low dose of SalB were better than those of the high dose.
high-fat diet;Salvianolic acid B;plas ma lipid;reactive oxygen species;antioxidase;lymphocyte subsets
1001-6880(2010)06-0965-08
2009-02-25 接受日期:2009-05-06
国家自然基金(30571347);科技部十一五支撑计划项目(2006BAD27B06)
*通讯作者 Tel:86-510-85917789;E-mail:lgw@jiangnan.edu.cn
R285.5;Q946.91
A
