蕲蛇蛇毒中一种新型金属蛋白酶AA-MP-I的纯化和表征
2010-11-24潘剑茹何火聪饶平凡
潘剑茹,何火聪,刘 枋,饶平凡*
1福州大学生物工程研究所,福州 350002;2福建省肿瘤医院,福州 350014
蕲蛇蛇毒中一种新型金属蛋白酶AA-MP-I的纯化和表征
潘剑茹1,何火聪2,刘 枋2,饶平凡1*
1福州大学生物工程研究所,福州 350002;2福建省肿瘤医院,福州 350014
本研究通过嗜硫色谱、Sephadex G-75、蓝胶和 POROS HQ 20离子交换色谱,从蕲蛇蛇毒中分离得到一种新组分AA-MP-I。该酶为分子量 22.9 kDa的单体蛋白,等电点为 5.55,不含中性糖基,N端序列为 STEFQRY ME IV IVVDHS MVK,结果表明其为新型 P-I型金属蛋白酶,对温度敏感,具有抗凝血活性,40℃下抗凝血活性最强,具有出血毒性,无磷脂酶A2活性。
蕲蛇;蛇毒;金属蛋白酶;抗凝血;出血毒
蕲蛇,又称尖吻蝮蛇,是一种剧毒的蛇。福建产蕲蛇来自武夷山,从其蛇毒的粗毒中已分离纯化得到多种纯组分,如具有凝血酶活力的金属蛋白,分子量约为 28.0 kDa,具有精氨酸酯酶活力和激活因子ⅩⅢ的活性,但没有明显的出血反应[1];分子量24.3 kDa的类凝血酶,不具有激活因子ⅩⅢ的活性[2];分子量约为 25.4 kDa的抗凝血因子,但不具有磷脂酶A2活性、纤溶活性和出血活性[3]等。
蕲蛇蛇毒中还含有很多金属蛋白酶,蛇毒金属蛋白酶 (snake venom metalloproteinases,SVMPs)属于含锌离子金属蛋白酶的亚类,蕲蛇咬后常见的局部出血症状就是由蛇毒金属蛋白酶所引起的。这类金属蛋白酶都含有保守的 Zn离子螯合序列HEXXH,这是实现其蛋白酶活性的基础片段[4]。金属蛋白酶的结构有三个部分:金属蛋白酶、类去整合蛋白和半胱氨酸富集区[5]。根据蛋白质结构域和基因的不同,蛇毒金属蛋白酶可以划分为 P-I到 PIV四种类型。P-I型蛇毒金属蛋白酶分子量最低,只有大约 200个氨基酸,含 Zn2+结合位点的金属蛋白酶域,这一结构域也是四种类型所共有的结构域, P-II型蛇毒金属蛋白酶多一个类去整合蛋白结构域,P-III型蛇毒金属蛋白酶 C端比 P-II型多一个半胱氨酸富集区,P- IV型蛇毒金属蛋白酶比 P-III型多一个二硫键连接的 C-凝集素域[6]。
已经得到的 P-I型金属蛋白酶有从皖南尖吻蝮蛇蛇毒中纯化得到 AaH I、AaH II和 AaH III[7],以及从台湾五步蛇蛇毒中得到的 AC-1[8]。AaH I、AaH II和AaH III的分子量均为 22 kDa左右,等电点分别为 pH 4.6、5.0和 9.0,都具有出血毒性[7]。AaH I和AaH III通过 cDNA克隆,已得到了蛋白序列,二者的序列同源性为 60%[9,10]。AC-1蛋白分子量为 22.4,等电点为 pH 4.7[8]。AC-1蛋白 N端前20个氨基酸的序列与AaH I相同,全序列的同源性为84%左右。
本研究从武夷山蕲蛇蛇毒中纯化得到了一种新型 P-I型金属蛋白酶AA-MP-I的,并对其理化性质进行了表征。
1 仪器与材料
1.1 仪器
可见紫外分光光度计 (Bioλ-10型,美国 PE公司);恒温水浴锅(福建厦门医疗仪器厂)。
1.2 材料
蕲蛇蛇毒购自福建光泽小方蛇业有限公司。Sepharose CL-6B和 Sephadex G-75(Phar macia公司);POROS HQ 20(Applied Biosystems公司);Affigel blue gel(Bio-Rad公司);二乙烯砜 (DVS)和β-巯基乙醇(Sigma公司);兔血浆 (自制:加 0.38%柠檬酸钠抗凝,4000 r/min,离心 15 min),其余试剂均为分析纯。
2 方法
2.1 蛋白质纯化
2.1.1 嗜硫色谱
嗜硫色谱按 Scoble和 Scopes[11]的方法制备。嗜硫色谱柱用含 0.1 mol/L Na2SO4,0.02 mol/L PB, pH 7.0缓冲液充分平衡后,将 1 g蛇毒溶于 100 mL上述缓冲液,离心 (10000 r/min)5 min,流动上样,用相同缓冲液平衡后,用 pH 7.0的 0.02 mol/L PB缓冲液洗脱,线性流速为 0.5 mL/min,检测波长为280 nm,收集穿透峰,浓缩、透析后待用。
2.1.2 Sephadex G-75凝胶过滤
经处理后的 Sexphadase G-75用 0.02 mol/L PB,pH7.0缓冲液充分平衡后,将上述收集的穿透峰上柱,用相同缓冲液洗脱,线性流速为 0.3 mL/ min,检测波长为 280 nm。收集第二个洗脱峰 (峰Ⅱ),浓缩、透析后待用。
2.1.3 Blue胶亲和色谱
Blue胶用 0.02 mol/L Tris-HCl,pH 7.4缓冲液充分平衡后,将上述峰Ⅱ上柱,用相同缓冲液平衡后,用含 1 mol/L Na2SO4的平衡缓冲液进行洗脱,线性流速为 1 mL/min,检测波长为 280 nm,收集其穿透峰(Bc),浓缩、透析后待用。
2.1.4 POROS 20 HQ强阴离子交换色谱
POROS 20 HQ强阴离子交换柱用 0.02 mol/L Tris-HCl,pH7.4缓冲液充分平衡后,将上述收集的Bc上柱,用相同缓冲液平衡后,用含 0~0.06 mol/L Na2SO4的平衡缓冲液直线梯度洗脱,线性流速为 1 mL/min,检测波长为 280 nm,得到蛋白质纯品,AAMP-I。
2.2 蛋白质性质鉴定
蛋白质纯度用 SDS-PAGE[12]和等电聚焦(IEF)[13]法进行检测,SDS-PAGE分离胶浓度为12.5%,浓缩胶浓度为 4.4%,工作电压 150 V,考玛斯亮蓝 R-250染色。总糖含量的测定采用硫酸苯酚法[14],以果糖为标准。蛋白质N端序列利用AB I公司 476A蛋白质序列测定仪测定。
2.3 磷脂酶 A2活性测定
底物的配制采用 Kawauchi等的方法[15]加以改良进行。测活时取 6 mL新鲜配制的底物,搅拌,加入AA-MP-I同时计时,用 0.02 mol/L KOH中和水解产生的脂肪酸,维持 pH在 8.20,根据每毫克AAMP-I消耗 KOH的速度求出 PLA2的活力。
2.4 抗凝血活性测定
比浊法。取兔血浆 0.1 mL与牛凝血酶混合后于 37℃水浴 5 min,加入待测样品 0.1 mL,振匀后,扫描 10 min内OD 500的吸光值变化。
2.5 蛋白酶活性测定
采用福林–酚试剂法[16]。蛋白酶酶活定义:在40℃,每分钟水解干酪素产生 1μg酪氨酸定义为一个蛋白酶活力单位。
2.6 出血毒活性测定
每 3只昆明系小白鼠(22±2 g)为一组,不同浓度的样品液 (样品溶解液为 0.02 mo1/L,Na2HPO4-NaH2PO4缓冲液含 0.15 mo1/L NaCl,pH7.0)0.l mL分别皮下注射小鼠背部,6 h后,乙醚处死,剥下小鼠皮肤,测量注射皮肤部位出血斑的面积,取每组的平均值,以面积对剂量作图。最小出血剂量(MHD)定义为引起 10 mm直径的出血斑大小所需的剂量[17]。
3 结果与分析
3.1 蛋白质纯化
AA-MP-I的纯化过程如图 1所示,蛇毒粗毒先通过嗜硫色谱进行初分离 (图 1a),收集、浓缩嗜硫色谱的穿透峰,通过 Sephadex G-75分离得到两个峰(图 1b),收集第二个峰并将其通过 Blue胶进行亲和 (图 1c),亲和所得洗脱峰先进行浓缩、透析,最后利用 POROS HQ 20高效液相色谱进行分离 (图1d),其梯度洗脱得到的第一个峰即为纯组分,命名为AA-MP-I。
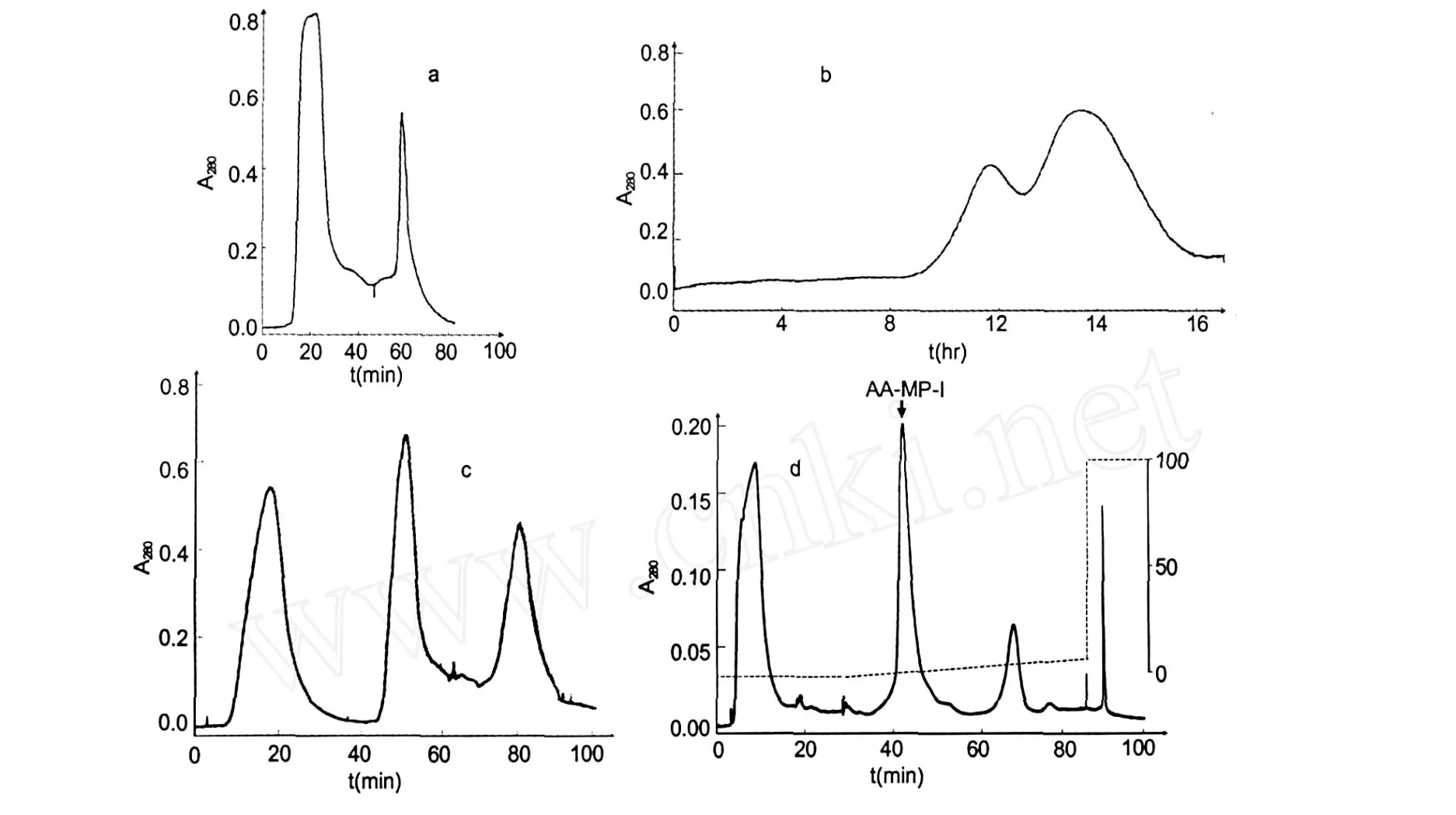
图1 AA-MP-I纯化过程Fig.1 Purification scheme ofAA-MP-I
3.2 理化性质
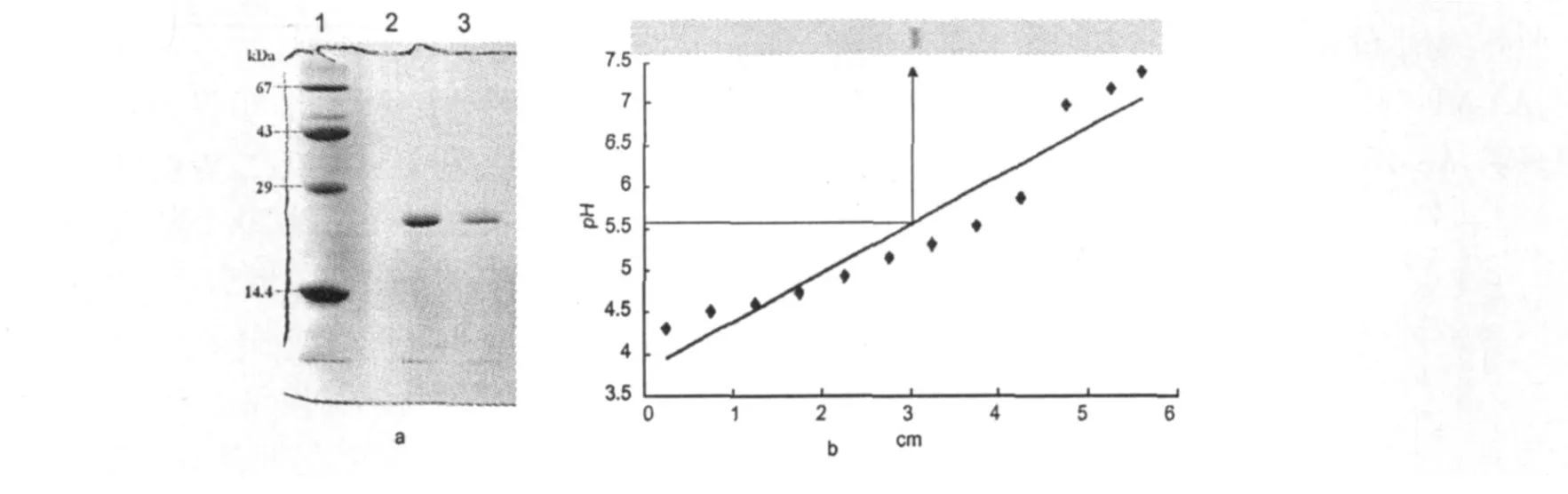
图2 AA-MP-I的分子量和等电点Fig.2 Molecularweight and isoelectric point ofAA-MP-I
由图 2a可以看出,还原型和非还原型AA-MP-I在 SDS-PAGE上均表现为单一条带,结合图2b的等电聚焦结果,可以肯定纯化得到的AA-MP-I以达到电泳纯。该蛋白分子量为 22.9 kDa,为单体蛋白,等电点为 5.55,非糖蛋白,N端 15个氨基酸的序列为 STEFQRY ME IV IVVDHS MVK。
3.3 蛋白酶活性
对AA-MP-I进行的蛋白酶活性分析结果表明,该蛋白具有碱性蛋白酶活性,用 1 mmol/L的 EDTA对半稀释AA-MP-I后,测定其蛋白酶活力。发现这时的蛋白酶活力为零,说明该蛋白是一种金属蛋白酶,这与序列分析结果相吻合。
如图 3所示,AA-MP-I蛋白酶活性对温度比较敏感,37℃水浴时,蛋白酶活性随水浴时间的增加直线下降,水浴时间 150 min后,AA-MP-I的蛋白酶活性降至 0,水浴温度大于 40℃时,蛋白酶活性在水浴 30 min后全部丧失。
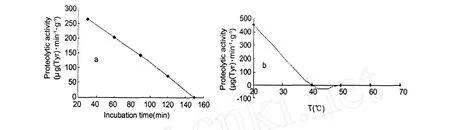
图3 AA-MP-I蛋白酶活性的热稳定性Fig.3 Heat Stability of the proteolytic activity ofAA-MP-I
3.4 抗凝血活性和出血毒活性
据AA-MP-I蛋白 N端序列 blast结果分析,该蛋白可能具有抗凝血活性,体外进行的抗凝血实验证实了这一结果。
图 4的结果显示,AA-MP-I的抗凝血活性对温度也比较敏感,在25~40℃之间水浴时,抗凝血活性随水浴温度的增加而增加,水浴温度达到 40℃时,抗凝血活性最强,当水浴温度大于 40℃时,抗凝血活性迅速降低,在 50℃水浴 30 min后,抗凝血活性几乎全部丧失。
此外,对小鼠背部皮肤所进行的注射实验结果表明,AA-MP-I具备出血毒活性,其它活性检验实验结果表明,AA-MP-I无磷脂酶A2活性。
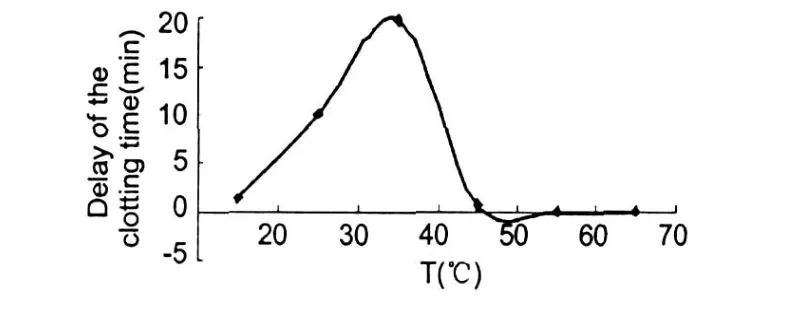
图4 AA-MP-I抗凝血活性的热稳定性Fig.4 Heat stability of the anticoagulant activity ofAA-MP-I
4 讨论
由表 1可以看出,几种 P-I型蛇毒金属蛋白酶分子量都在 22~23 kDa之间,除了未得到序列的AaH II[7]外,几种蛋白的N端序列都具有同源性,其中本研究得到的AA-MP-I蛋白、AaH I[7,9]和AC-1[8]蛋白的N端序列完全相同。但将AaH I和AC-1蛋白的全序列进行比对后发现,二者整体序列的同源性仅为 84%,虽然二者 N端 20个氨基酸序列相同,分子量和等电点相似,但二者为不同的蛋白质。将 AaH I[7,9]和 Acutolysin C[7-10]分子量相同,但等电点相差很大,N端序列同源性仅为 60%。由此可知,由于蛇毒蛋白的复杂性,判断两个蛇毒蛋白是否相同,不能单纯依靠分子量、等电点或 N端序列等单一指标,而要结合多方面的特征来判断。本研究纯化得到的AA-MP-I蛋白,虽然N端序列与AaH I和AC-1蛋白的相同,但分子量和等电点与这两种蛋白差异较大,因此可以判定AA-MP-I蛋白是一种新型 P-I型蛇毒金属蛋白酶,其与AaH I和AC-1蛋白的差别可能是由于几种蛇毒来源地差异引起的。为进一步研究三种蛋白的差异性,下一步将鉴定AA-MP-I蛋白全序列。
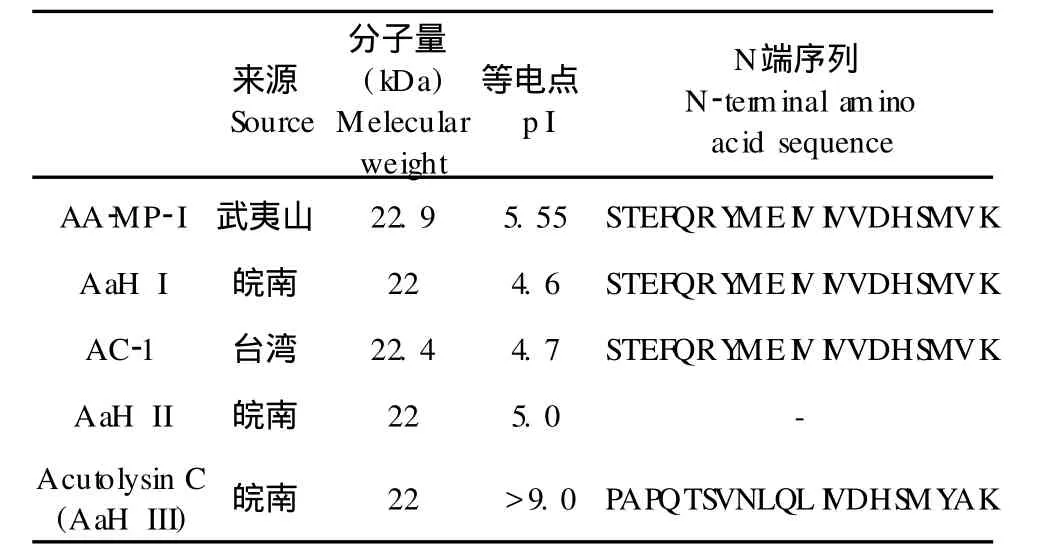
表 1 蕲蛇蛇毒中的 P-I SVMPsTable 1 P-I SVMPs from venom ofAgkistrodon acutus
1 XueWM(薛伟明),Guo CT(郭春腾),Chen TB(陈天豹), et al.Purification and characterization of a thrombin-like enzyme fromAgkistrodon acutus.J Fuzhou Univ,Nat Sci(福州大学学报,自科版),2001,29:112-115.
2 LaiWP(赖伟苹),Guo CT(郭春腾),Den WH(邓文汉), et al.Purification and characterization of a novel thrombinlike enzyme fromAgkistrodon acutusVenom.Life Sci Res(生命科学研究),2002,6:64-67.
3 Xu ZB(许志宾),Guo CT(郭春腾),Wang ZL(王中来),et al.Purification and characterization of an anticoagulant factor from the venom ofAgkistuodon acutus.J Snake(蛇志), 2003,15:21-24.
4 Rawlings ND,Barrett AJ.Evolutionary families of metallopeptidases.M ethods Enzym ol,1995,248:183-228.
5 Takeya H,Oda K,Miyata T,et al.The complete amino acid sequence of the high molecular mass hemorrhagic protein HR1B isolated from the venom ofTrimeresurus flavoviridis.J B iol Chem,1990.265:16068-16073.
6 HiteLA,JiaLJ,Bjarnason JB,et al.cDNA sequences for four snake venom metalloproteinases:structure,classification,and their relationship to mammalian reproductive proteins.A rch B iochem B iophys,1994.308:182-191.
7 Xu X,Wang C,Liu J,et al.Purification and characterization of hemorrhagic components fromAgkistrodon acutus(hundred pace snake)venom.Toxicon,1981,19:633-644.
8 Nikai T,Kato C,Komori Y,et al.Pr imary structure of Ac-1 proteinase from the venom of DeinAgkistrodon acutus(Hundred-pace snake)from Taiwan.B iol Phar m Bull,1995,18: 631-633.
9 Liu QC,Xu HX,Cheng X,et al.Molecular cloning and sequence analysis of cDNA hemonhagic toxin acutolysin a fram Agkistrodon acutus.Toxicon,1999,37:1539-1548.
10 Liu QD(刘庆都),Xu WH(徐卫华),Cheng X(承新),et al.Molecular cloning and sequence analysis of cDNA encoding acutolysin C,a Hemorrhagic metalloproteinase,from Agkistrodon acutus.Acta B iochim B iophys Sin(生物化学与生物物理学报)2000,32:425-429.
11 Scoble JA,Scopes RK.Ligand structure of the divinylsulfonebased T-gel.J Chrom atogrA,1997,787:47-54.
12 Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4.Nature,1970,227 (5259):680-685.
13 Zhao YF(赵永芳).Technique Principle and Application Of Biochemistry(生物化学技术原理及应用).Beijing:Science Press,2002.395-398.
14 DuboisM,Gilles KA,Hamilton JK,et al.Colorimetricmethod for determination of sugars and related substances.Anal Chem,1956,28:350-356.
15 Kawauchi S, Iwanaga S,Samejima Y,et al.Isolation and characterization of two phospholipase A’s from the venom of Agkistrodon lays blomhoffii.B iochim B iophys Acta,1971, 236:142-160.
16 SatakeM,Murata Y,Suzuki T.Studieson snake venom.XIII. Chromatographic separation and properties of three proteinases from Agkistrodon halys blomhoffii venom.J B iochem(Tokyo),1963,53:438-447.
17 Kondo H,Kondo S,Ikezawa H,et al.Studies on the quantitative method for deter mination of hemorrhagic activity of Habu snake venom.Jpn J M ed Sci B iol,1960,13:43-52.
Purification and Characterization of a NovelM etalloproteinase AA-M P-I from the Venom ofAgkistrodon acutus
PAN Jian-ru1,HE Huo-cong2,L IU Fang2,RAO Ping-fan1*1Institute of B iotechnology,Fuzhou University,Fuzhou 350002,China;2Fujian Provincial Tum or Hospital,Fuzhou 350014,China
A novel P-I snake venom metalloproteinase AA-MP-Iwas purified from the venom ofAgkistrodon acutusby using thiophilic adsorption chromatography,Sephadex G-75,Affi-gel blue gel,and POROS HQ 20 anion-exchange chromatography.AA-MP-Iwas a monomerwith the molecularweight of approx imate 22.9 kDa on SDS-PAGE and its isoelectric pointwas 5.55 analyzed by IEF.AA-MP-I hasn’t any neutral carbohydrate and itsN-terminal amino acid sequence was STEFQRY ME IV IVVDHS MVK.AA-MP-I has basic proteolytic and antithrombin activities,both of which are heat-unstable.In addition,AA-MP-Iwas proved to have hemorrhagic activity but no acidic phospholipase A2activity.
Agkistrodon acutus;venom;metalloproteinase;antithrombin;hemorrhage activity
1001-6880(2010)06-0929-05
2009-03-24 接受日期:2009-05-18
福建省科技厅重点项目(2000Z143)
*通讯作者 E-mail:pfrao@fzu.edu.cn
Q556+.9;R285
A
