电沉积金属Ni涂层的高温腐蚀性能
2010-11-24周科朝李志友
马 莉,周科朝,李志友
电沉积金属Ni涂层的高温腐蚀性能
马 莉,周科朝,李志友
(中南大学 粉末冶金国家重点实验室,长沙 410083)
通过调控电沉积过程中的阴极电流密度制备具有不同晶粒尺寸和择优取向的 Ni镀层。采用透射电镜(TEM)、扫描电镜(SEM)、能谱仪(EDS)和X射线衍射仪(XRD)对高温腐蚀前、后不同Ni镀层进行检测分析,对比研究不同Ni镀层经过960 ℃的78.07%Na3AlF6-9.5%AlF3-5%CaF2(质量分数)熔盐气氛腐蚀后的结构、成分和形貌。结果表明:在高电流密度下易获得晶粒细小,平均晶粒尺寸为120 nm,具有较强〈100〉择优取向的Ni镀层;而在低电流密度下所得的Ni镀层晶粒较粗大,平均晶粒尺寸为925 nm,具有较弱的〈111〉择优取向。在腐蚀气氛下,低电流密度下所得的Ni镀层在高温腐蚀后有利于生成晶粒粗大、且具有完整“八面体”结构的NiAl2O4尖晶石相;而高电流密度下所得Ni镀层表层腐蚀层的晶粒细小,且主要为NiO相。
电沉积;高温腐蚀性能;镍;晶粒尺寸;电流密度;择优取向
金属或合金的耐蚀性不仅取决于它的化学组成,还取决于其微观结构。例如,Ni基高温合金晶粒纳米化后可以有效地促进氧化膜中连续、致密的 Al2O3和Cr2O3膜的快速生成[1−4]。此外,晶粒细化还可以改善材料在室温下的耐点腐蚀性能[5]。除晶粒尺寸外,择优取向对单质金属材料及单晶材料耐氧化和耐腐蚀性能的影响也是不容忽略的。已有研究表明,在973 K空气中氧化时,在Ni(111)晶面上氧化物的生长速率要比Ni(100)上氧化物的生长速率低一个数量级[6]。这是由于基体取向影响NiO生长过程中晶界特征分布,因此,基体取向控制高温氧化或腐蚀过程中金属离子、氧离子或其他离子的扩散速率和路径[6]。
金属Ni作为一种重要的金属材料和合金元素,它的氧化和腐蚀性能一直颇受关注[6−12]。同时,为适应不同环境的需求,通过改变工艺参数来探索和了解Ni的氧化/腐蚀机理也备受重视。但在Ni的氧化研究中,多数研究集中在 Ni的纯度[7]、氧化温度[8]、炉内气氛[9]和表面粗糙度[10]等方面,且对纳米金属Ni涂层耐蚀性的研究也多集中在室温溶液环境[11−12]。而关于金属 Ni涂层的晶粒大小和晶体择优取向对其耐高温气氛腐蚀性能的影响的报道较少。
直流电沉积是制备金属或合金涂层的常用方法之一。众多研究表明,电沉积工艺参数与沉积层的结构和性能密切相关[13−14]。通过调节阴极电流密度和 pH值等工艺参数可以改变金属或合金镀层的晶粒大小和择优取向等,进而改变材料性能[13−14]。
在铝电解过程中,惰性阳极的金属导杆的气氛腐蚀行为也一直备受重视。本文作者通过调控电流密度来制备具有不同晶粒尺寸和择优取向的Ni涂层,并将该涂层置于 960 ℃铝电解的熔盐介质气氛(78.07%Na3AlF6- 9.5%AlF3-5%CaF2,质量分数)中进行12 h的腐蚀实验,通过研究腐蚀层的结构、成分和形貌来讨论分析上述因素对抗高温腐蚀性能的影响。
1 实验
本实验采用直流电沉积方法制备Ni涂层,电解液组成为 NiSO4·6H2O(250 g/L)、NiCl2·6H2O(45 g/L)、H3BO3(35 g/L),镀液pH值为4.5,沉积温度为45 ℃,电流密度分别为1 A/dm2和15 A/dm2。所用试剂均为分析纯,溶液用蒸馏水配制。阳极为加拿大INCO公司生产的电解镍,其化学组分见表 1。在镍基体上进行电沉积,工作面积为3 cm×3 cm。电沉积前基体依次经过除油,稀硫酸腐蚀,水和蒸馏水清洗。在电沉积过程中,镀液采用磁力器搅拌,搅拌速度恒定。调整电镀时间,使镀层厚度控制在为40 µm左右。腐蚀实验在大气和熔盐气氛的双重作用下进行,温度为960 ℃,熔盐介质为78.07%Na3AlF6-9.5%AlF3-5%CaF2(质量分数),腐蚀时间为12 h,加热炉为普通马弗炉。
采用线切割设备将沉积层切成小块,经过磨制、离子减薄制成薄膜样品,在H−800型透射电镜(TEM)下观察其微观结构,并通过统计500个晶粒的粒径绘制沉积层的晶粒尺寸分布图;采用JSM−5600LV型扫描电子显微镜(SEM/EDS)分析镀层腐蚀前、后腐蚀层的截面形貌和元素分布;采用 RIGAKU/MAX−3A型X射线衍射分析仪(XRD)考察镀层的晶体结构和腐蚀后腐蚀层的物相组成,实验所用的X射线为CuKα辐射(λCu-K=0.154 nm,步长为0.02°)。根据XRD检测数据计算沉积层的织构,以晶面(hkl)的织构系数TC来表征晶面择优程度[15],如式(1)所示。
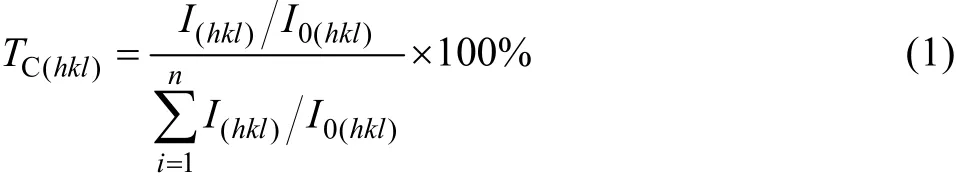
式中:I(hkl)和 I0(hkl)分别表示沉积层试样和标准镍粉末的(hkl)晶面的衍射线强度;n为衍射峰个数,为避免平行面的影响,本研究中n取值为3,即取(111)、(200)和(220)晶面进行计算。当各衍射面的 TC值相同时,晶面取向是无序的。如果某个(hkl)面的TC值大于平均值(33.3%)时,则该晶面呈择优取向。TC值越大,说明择优取向程度越高。
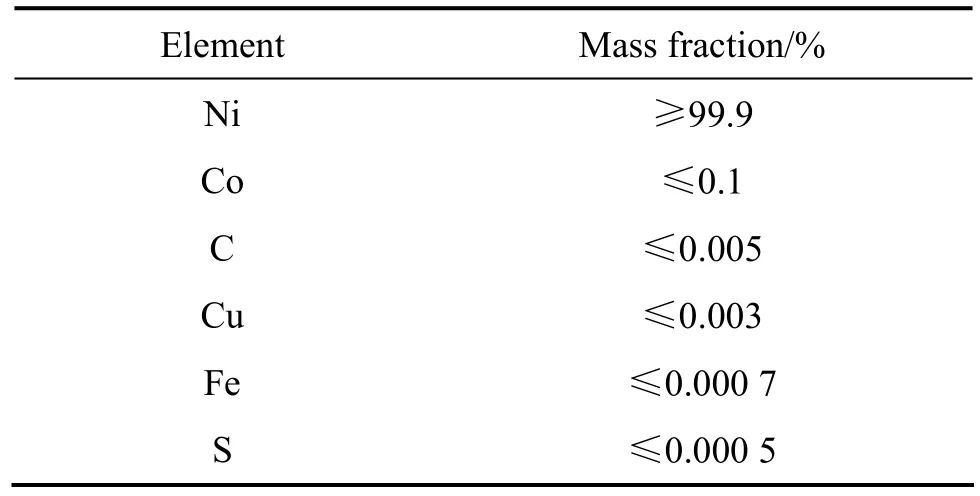
表1 阳极用IncoNi板的化学组分Table 1 Chemical composition of Inco Ni plate used as anode
2 结果与分析
2.1 不同电流密度下制备的Ni镀层的XRD和TEM分析
图1所示为不同电流密度下电沉积所得的厚度约为50 µm Ni镀层的XRD谱。从图1可以看出,在低电流密度(J=1 A/dm2)下沉积的镀层的晶粒具有〈111〉择优取向;而在高电流密度(J=15 A/dm2)下沉积的镀层的晶粒具有〈100〉择优取向。
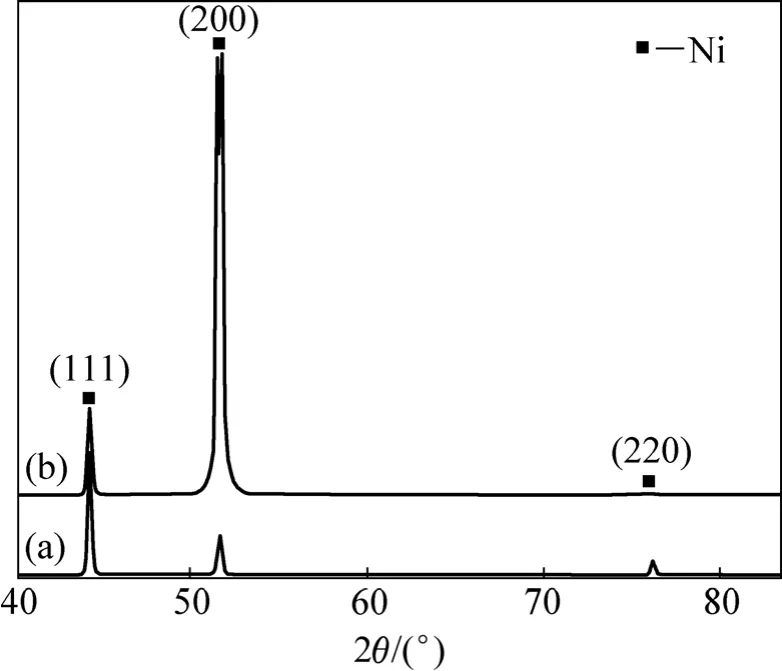
图1 Ni镀层的XRD谱Fig.1 XRD patterns of Ni coatings: (a) J=1 A/dm2; (b) J=15 A/dm2
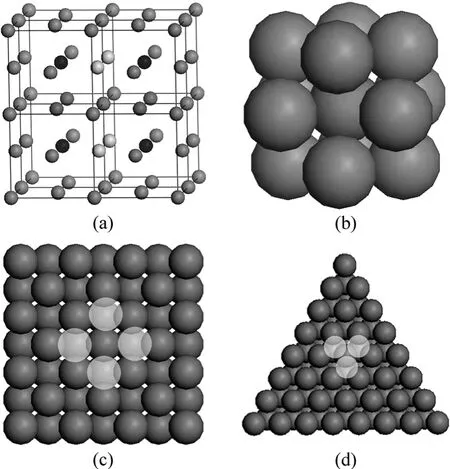
图2 Ni的原子结构Fig.2 Atomic structure of Ni: (a) Eight Ni single-cells (100);(b) Nearest neighbor atomic structure of Ni; (c) Ni(100); (d)Ni(111)
Ni是典型的具有面心立方结构的金属(见图2(a)),Ni原子的排列具有高度的对称性,每个Ni原子由12个最近邻Ni包围(见图2(b)),且中心原子与最近邻原子之间距离相等,均为2a / 2,a为布拉菲点阵常数。在此,假定每个Ni原子和周围12个Ni原子之间的相互作用远强于与其他原子之间的相互作用。从图 2(c)和(d)可以看出,Ni(100) 表面每个Ni原子被最近邻8个 Ni原子“固定”,有 4个最近邻原子位“悬挂”;而Ni(111) 表面每个Ni原子被最近邻的9个Ni原子“固定”,只有3个最近邻原子位“悬挂”。因此,Ni(111) 面Ni原子具有更高的稳定性。
此外,亦可根据fcc的表面自由能公式(2)[16],计算的Ni(100)、Ni(110)与Ni(111)的表面自由能之比为γ100:γ110:γ111=1:1/2:1/3,说明Ni(111)的能量最低,为最稳定晶面。

式中:Εb表示相邻两个原子之间的键能;d0表示键长;h、k、l 表示晶面指数。
当电流密度比较小时,晶体生长以平衡或近似平衡生长,晶体生长比较缓慢、有序。从热力学观点来看,当晶粒的每个表面均为{111}时,可以最大限度地满足晶体生长的Gibbs条件,即满足总表面自由能最小。由式(2)可知,Ni的{111}面具有最低表面能,由8个{111}面围成的正八面体结构为 Ni晶体的平衡形状,当晶粒以平衡或近似平衡生长时,晶体趋向于向正八面体结构生长。
当增大电流密度时,晶体生长速度加快,晶体生长不再遵循能量最低原则,将可能以最快堆垛形式生长[17−18]。由于Ni的{100}晶面的原子密度较小、面间距较小、面与面之间的吸引力较强,〈100〉成为另一个晶体优先生长的方向。
图3所示为两种不同结构和晶粒尺寸的纯Ni镀层的 TEM 明场像和选区电子衍射花样(SAED)谱。图4所示为其相对应的晶粒尺寸分布图。从图3可以明显地看到,当J=1 A/dm2时,所得镀层晶粒尺寸粗大,晶粒尺寸分布范围为0.2~2.0 µm,其中尺寸在0.6~1.2µm的晶粒占55%以上(见图3(a));当J=15 A/dm2时,所得镀层的晶粒尺寸相对细小,晶粒尺寸分布范围为10~300 nm,其中尺寸在40~200 nm的晶粒占70%以上。通过分别对500个晶粒进行统计并计算出它们的平均晶粒尺寸分别为975 nm和120 nm。这主要是由于低电流密度下晶体生长比较缓慢,故晶粒粗大;而高电流密度下晶粒生长迅速,故晶粒细小。
另外,由于图3(c)和(d)的SAED谱是由相同直径的选区光阑得到的,其中,图3(c)中的SAED谱为单晶Ni的衍射斑,而图3(d)中的SAED谱为多晶Ni的近同心圆环。这一实验结果也同样证明低电流密度下所得镀层的晶粒较粗大,而高电流密度下所得镀层的晶粒较细小。
此外,由于具有织构样品的倒易点阵可以用单晶的点阵绕织构轴旋转而得,其中的SAED是一层同心圆。当织构轴与电子束入射方向成一倾角时,原来衍射图中的圆环被分割成一些孤段。图3(d)样品的衍射环被分割成一些孤段,亦可说明图3(b)样品的晶粒具有一定的择优取向,这一点也与 XRD分析结果一致。

图3 Ni镀层的TEM明场像和其相应的选取电子衍射图谱(SAED)Fig.3 TEM bright-field images of Ni coatings (a, b) and corresponding SEAD patterns (c, d): (a), (c) 1 A/dm2; (b), (d) 15 A/dm2
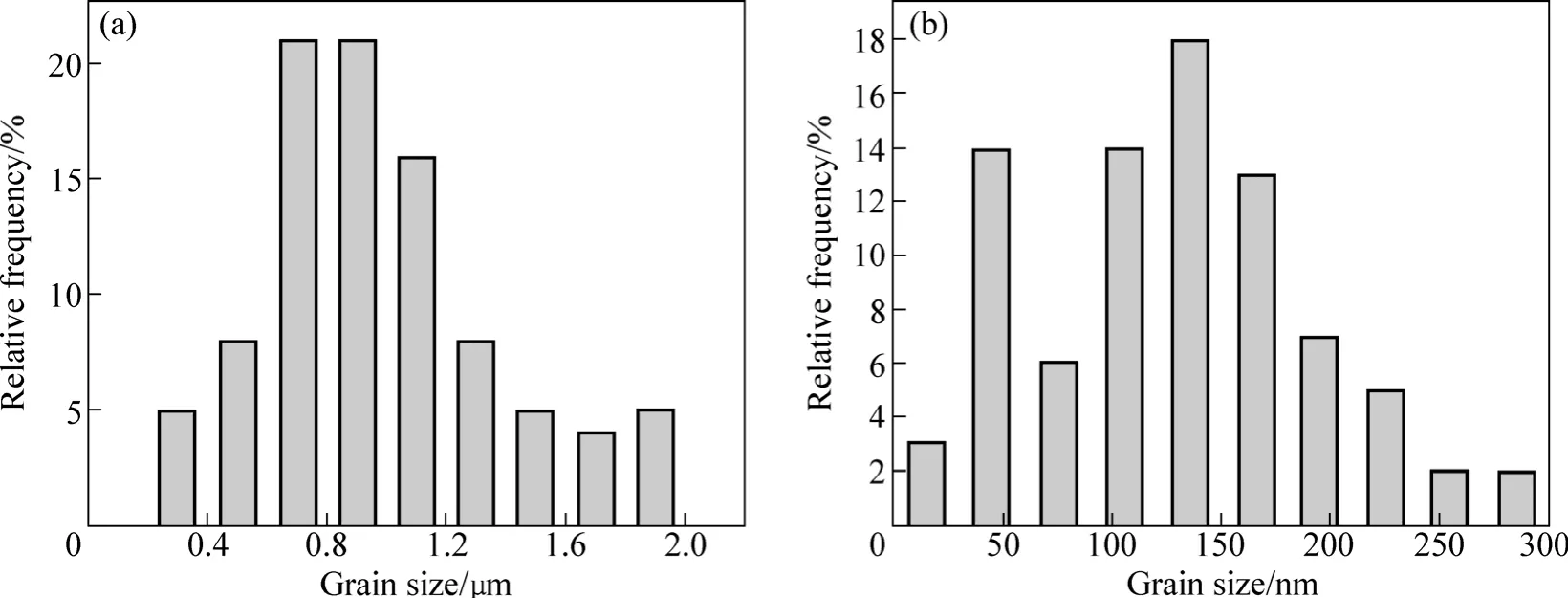
图4 Ni镀层的晶粒尺寸分布Fig.4 Grain size distribution of Ni coatings: (a) 1 A/dm2; (b) 15 A/dm2
表2所列为不同电流密度下所得Ni镀层的XRD谱和TEM数据分析。从表2中可以明显地看出,在低电流密度下制备的 Ni镀层,平均晶粒尺寸为 975 nm,具有较弱的〈111〉择优取向,择优取向度为38.7%;而在高电流密度下制备的 Ni镀层的平均晶粒尺寸为120 nm,具有较强的〈100〉择优取向,择优取向度为91.5%。
2.2 960 ℃气氛腐蚀12 h后Ni镀层的结构
图5所示为不同电流密度下电沉积所得Ni镀层在960 ℃的 78.07%Na3AlF6-9.5%AlF3-5%CaF2熔盐气氛下腐蚀12 h后的XRD谱。从图5可以看出,两种Ni镀层经腐蚀后表面除有NiO外,均有NiAl2O4生成。但NiO与NiAl2O4峰的峰强和峰数存在明显差异。高电流密度所得样品的 NiAl2O4的特征峰的数量和强度少于低电流密度所得样品的。这可能是由于不同电流密度所得镀层在高温气氛腐蚀后腐蚀层中 NiO、NiAl2O4的含量及其择优取向不同所致。在标准 PDF卡片中,NiO(111)峰的2θ角为37.248°,NiAl2O4(311)峰所对应的 2θ角为 37.009°,二者只相差 0.239°。A峰所对应的 2θ值均位于 36.6°~37.9°,因此,A 峰是NiO(111)峰与 NiAl2O4(311)峰共同作用的体现,故这里无法通过峰强度的方法计算NiO与NiAl2O4各个晶面的择优取向度。但除 A峰以外,图 5(a)中I NiAl2O4(220) IA , I NiAl2O4(400) IA , I NiAl2O4(422) IA ,I NiAl2O4(511) IA 和 I NiAl2O4(440) IA等峰强相对值均高于图 5(b)的,说明低电流密度下获得的 Ni镀层在腐蚀后 NiAl2O4含量相对较高。此外,图 5(a)中INiO(200)IA的强度相对值明显大于图 5(b)中INiO(200)IA的相对强度值,所以低电流密度下获得的Ni镀层经腐蚀后,腐蚀产物中 NiO存在明显的〈100〉择优取向。
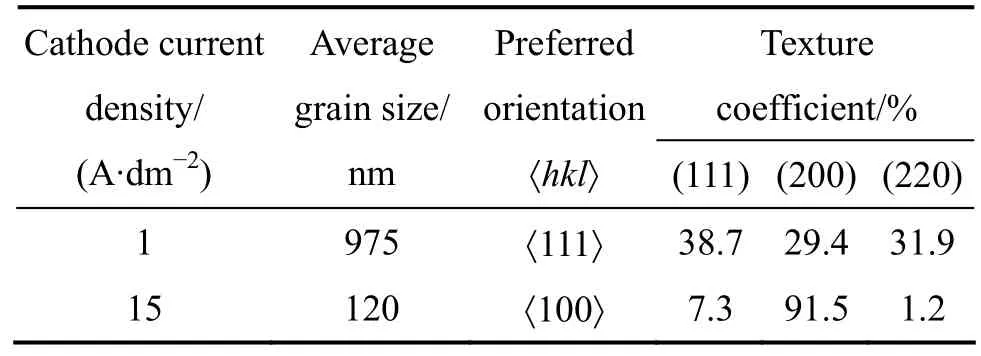
表2 不同电流密度下制备的Ni镀层的XRD和TEM数据分析Table 2 XRD and TEM data analysis of Ni coatings prepared under different current densities
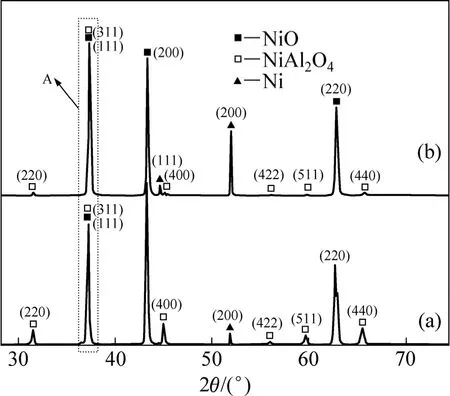
图5 Ni镀层在960 ℃的78.07%Na3AlF6-9.5%AlF3-5%CaF2气氛中腐蚀12 h后的XRD谱Fig.5 XRD patterns of Ni coatings electrodeposited with different current densities and then subjected to hot corrosion in environment of 78.07%Na3AlF6-9.5%AlF3-5%CaF2 at 960 ℃for 12 h: (a) 1 A/dm2; (b) 15 A/dm2
2.3 960 ℃腐蚀12 h后镀层的表面形貌
图6所示为不同电流密度下电沉积所得Ni镀层经大气与熔盐气氛混合气氛腐蚀后的表面形貌。从图 6可以看出,在低电流密度下制得的Ni镀层经腐蚀后,表层腐蚀层局部破裂(见图6(a)),呈现“包状”结构,且晶粒较粗大,晶粒尺寸为1~4 µm,晶形完整,每个晶粒具有明显的“正八面体”结构(见图6(b));而内腐蚀层晶粒相对较小(见图6(c)),这可能是腐蚀过程中内层的腐蚀气氛需要通过晶界和缺陷由表面扩散迁移到内层,故内层的腐蚀气体浓度要小于表面的浓度。而在高电流密度下制得的Ni镀层经腐蚀后,表层腐蚀层完整,无剥落,且表面氧化膜较平整、晶粒非常细小,晶界丰富(见图 6(d)和(e))。由于低电流密度下所得的Ni镀层晶粒粗大,晶界较少,腐蚀产物形核密度较小,腐蚀物晶粒可自由生长,导致腐蚀层晶粒粗大。而高电流密度下所得Ni镀层本身晶粒细小,且均为纳米尺度,晶界丰富,而晶界是易氧化和腐蚀的区域,氧化腐蚀速度快,单位面积腐蚀产物形核数量多,故腐蚀产物晶粒细小。
同时,根据表3的EDS分析可知,大气腐蚀后的镀层表面均没有发现 F元素及其化合物。其中 B区Al元素含量较多,C区Al元素含量相对B区有所减少;Ε区Al元素含量最少,Ni和O元素含量较多。
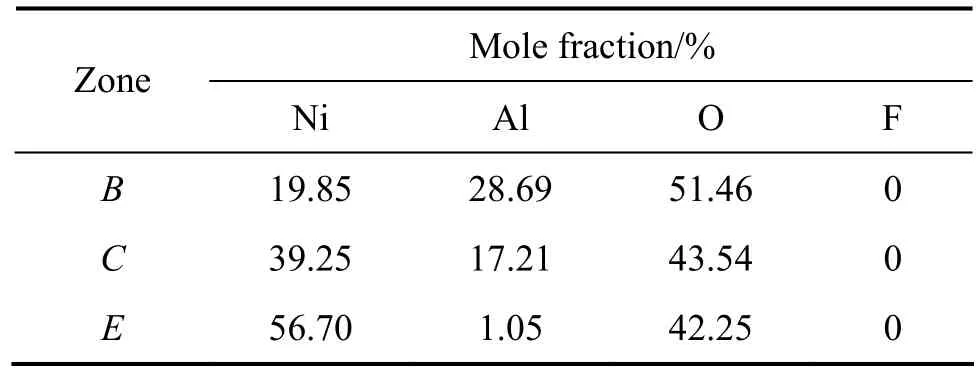
表3 图6中各微区的元素分析Table 3 Micro-area element analysis in Fig.6
2.4 960 ℃腐蚀12 h后样品的截面形貌
图7所示为不同电流密度下电沉积所得Ni镀层经熔盐气氛腐蚀后的SEM像。由图7可看出,不同电流密度下电沉积所得 Ni经熔盐气氛腐蚀后所得腐蚀层的厚度相差不大。在低电流密度下所得Ni镀层经腐蚀后,在腐蚀层/气体界面以及腐蚀层/金属界面出现了两条颜色较深的带(见图 7(a)和(b))。在高电流密度下所得Ni镀层经腐蚀后,其在腐蚀层/金属界面出现了一条颜色较深的带(见图7(c)和(d))。

图6 Ni镀层在 960 ℃的 78.07%Na3AlF6-9.5%AlF3-5%CaF2气氛中腐蚀12 h后的表面形貌Fig.6 Surface photographs of Ni coatings subjected to hot corrosion in environment of 78.07%Na3AlF6-9.5%AlF3-5%CaF2 at 960 ℃for 12 h: (a) 1 A/dm2; (b) Enlarged graphs of zone B; (c) Enlarged graphs of zone C; (d) 15 A/dm2; (e) Enlarge graph of zone Ε
图8 所示为不同电流密度下所制备的Ni镀层在960 ℃熔盐气氛下腐蚀 12 h后所得腐蚀层的截面的EDS分布。从图8(a)可以清楚地看出,在腐蚀层/气体界面以及腐蚀层/金属界面出现的两条颜色较深的带为Al元素的富集区域,腐蚀层/气体界面处富集Al元素在图8(a)的EDS表面能谱分析结果中进一步得到证实(见表 3)。而由图 8(b)可以看出,在腐蚀层/金属界面只出现了一条较深的带,该带为Al的富集区域。从图 8(c)的 EDS表面能谱分析中可知,该样品表面的Al含量较少(见表3),然而根据图5的XRD分析结果有表面腐蚀产物含有有NiO和NiAl2O4两相,故结合图5,表3和图8的检测结果可推测该Al元素的富集区域主要为NiAl2O4相。

图7 Ni镀层在960 ℃的78.07%Na3AlF6-9.5%AlF3-5%CaF2气氛下腐蚀12 h后氧化膜截面的SEM背散射像Fig.7 SEM back scattered images of oxides formed on Ni coatings subjected to hot corrosion in atmosphere of 78.07%Na3AlF6-9.5%AlF3-5%CaF2 at 960 ℃ for 12 h: (a) 1 A/dm2; (b) Enlarged graph of Fig.7(a); (c) 15 A/dm2 ; (d) Enlarged graph of Fig.7(c)
此外,从图7和8还可以看出,在不同电流密度下电沉积所得 Ni经熔盐气氛腐蚀后所得腐蚀层的平均厚度在40 µm左右,可能均为Ni涂层本身的厚度(40µm左右)。导致腐蚀层厚度相差不大的原因可能是:在涂层/金属基体界面由于应力产生裂纹,使得腐蚀介质、O2通过裂纹等区域扩散进入,并与暴露在腐蚀气氛和大气中的金属Ni基体发生反应。根据表4中1 200 K时的反应标准自由能可以看出,金属Ni与O2和AlF3同时作用生成 Al2O3的吉布斯自由能为−106.09 kJ/mol,且金属Ni或NiO形成NiAl2O4的吉布斯自由能分别为−150.05 kJ/mol和−16.18 kJ/mol,3个反应的吉布斯自由能均为负值,说明反应趋势较大,即易在基体/涂层界面处生成一层 NiAl2O4膜。由于 NiAl2O4尖晶石本身结构致密,对Ni2+和O原子的进一步扩散起到了阻碍作用。因此,经腐蚀后两组样品的腐蚀层厚度相差不大。
在进行高温气氛腐蚀实验时,在升温过程中,在温度未达到熔盐的熔融温度时,没有腐蚀介质挥发,Ni镀层表面暴露在富含氧气的大气环境中,随着温度的不断升高,表面Ni原子将被氧化生成NiO。由于不同电流密度下所得镀层晶粒尺寸存在明显差异,在温度由室温升至熔盐熔融温度的这段时间内,Ni镀层表面生成的NiO的氧化速率也存在很大差异。通常情况下,在氧化初期,氧化膜生长主要是沿晶界进行的短路扩散。在高电流密度下所得Ni镀层的晶粒细小,平均晶粒尺寸近纳米级,比表面能较大,活性较高,且富含大量晶界,在氧化初期,成膜离子或原子可通过大量的晶界迅速扩散迁移,故氧化速率较快,在较短的时间内金属Ni外层就会被一层较致密的NiO膜包裹;而在低电流密度下所得Ni镀层,晶粒较粗大,平均晶粒尺寸近微米级,晶界相对较少,成膜离子或原子通过晶界扩散的路径有所减少,氧化速率较慢,故在短时间内只有极少量的NiO生成。
为了进一步说明晶粒尺寸对氧化速率的影响,这里引用Hart模型[19]说明:

式中:Db和Dgb分别为体扩散系数和晶界扩散系数;f为通过晶界扩散系数所占的分数。假定Ni镀层的晶粒为柱状晶,对于柱状晶粒,f=2δ/d,其中 δ是晶界宽度,通常为10−7cm[20];d为柱状晶直径。当晶粒尺寸由微米级降到纳米级时,沿晶界扩散所占的比例将大幅度增加,而晶界扩散系数远大于体扩散系数(通常Dgb/Db=104~106)[20],高电流密度下所得Ni镀层的平均晶粒尺寸为120 nm,因此,在氧化初期,成膜离子或原子的有效扩散系数将会大幅度增大。此外,对于纯金属Ni来说,在973 K空气氧化中,(111)晶面的氧化速率比(100)晶面低一个数量级[6]。故可能上述两个原因的同时作用使得在腐蚀介质挥发前的升温过程中,在空气的作用下,低电流密度下制得的Ni镀层氧化速率较慢,而在高电流密度下制得的镀层氧化速率较快。

图8 Ni镀层在960 ℃的78.07%Na3AlF6-9.5%AlF3-5%CaF2气氛下腐蚀12 h后氧化膜的截面背散射图和EDS面分布图Fig.8 BSE images (a, b) and EDS mappings (b~h) along cross-section of oxides formed on Ni coatings subjected to hot corrosion in environment of 78.07%Na3AlF6-9.5%AlF3-5%CaF2 at 960 ℃ for 12 h: (a), (c), (e), (g) 1 A/dm2; (b), (d), (f), (h) 15 A/dm2
在腐蚀介质挥发前,由于低电流密度下所获得Ni镀层氧化速率较慢,在短时间内外层均主要是晶界处存在少量氧化,晶内几乎未被氧化。根据表4中式(3)的标准吉布斯自由能ΔGΘ<0可知,低电流密度下所获得Ni镀层在高温下与O2和腐蚀介质AlF3共同作用后,外表面有Al2O3生成。同时,根据表4中式(5)可知,Ni氧化形成NiO和NiAl2O4的标准吉布斯自由能分别为−133.19 kJ/mol和−150.05 kJ/mol,二者均为负值,说明反应的趋势较大,即该表层易于生成NiAl2O4相。
而在高电流密度下所获得的 Ni镀层经腐蚀后表面几乎没有 NiAl2O4的生成。可能的原因是:腐蚀初期,在大气的作用下,具有近纳米晶粒尺度、且具有〈100〉高择优取向的 Ni镀层的表面氧化速率较快,在很短的时间内便会被一层生成的NiO膜包裹。由表4中式(2)可知,在1 200 K时,NiO与AlF3相互作用生成 Al2O3的标准吉布斯自由能为 27.10 kJ/mol,即ΔGΘ>0,说明表层 NiO 与 AlF3相互作用无法生成NiAl2O4,故在大气气氛和腐蚀气氛的共同作用下,在腐蚀层/气体界面几乎没有NiAl2O4的生成。
但关于 Ni晶粒尺寸和晶粒择优取向对氧化膜中NiO和NiAl2O4各晶面择优生长的影响目前还未能给出具体分析和解释,这一部分工作还有待进一步研究。
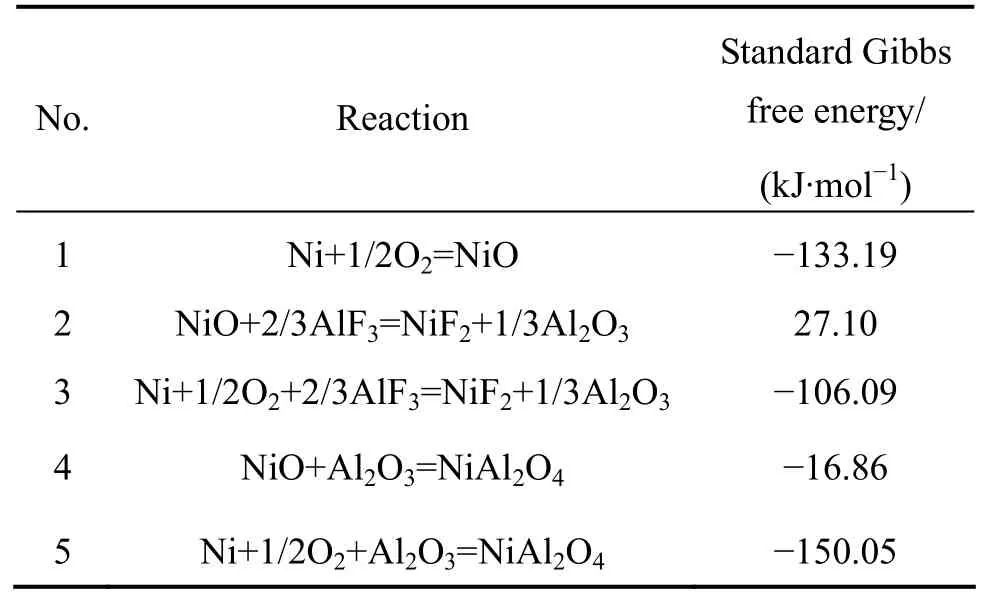
表4 1 200 K时的反应标准吉布斯自由能Table 4 Standard Gibbs free energy of reactions at 1 200 K
3 结论
1) 采用直流电沉积法,在低电流密度下制备的Ni镀层晶粒尺寸粗大,平均晶粒尺寸为945 nm,晶粒具有轻微的〈111〉择优取向,取向度为 38.7%;而在高电流密度下制备的Ni镀层晶粒尺寸细小,平均晶粒尺寸为120 nm,晶粒具有强烈的〈100〉择优取向,取向度为91.5%。
2) 在960 ℃时,低电流密度制备的Ni镀层在大气气氛和腐蚀气氛的双重作用下表层更有利于生成结构致密的 NiAl2O4尖晶石相,且腐蚀层的晶粒粗大;而在高电流密度制备的Ni镀层表层有大量的NiO和极少量 NiAl2O4尖晶石的生成,且其腐蚀层的晶粒细小。
REFERENCES
[1] YANG X, PENG X, WANG F. Hot corrosion of a novel electrodeposited Ni-6Cr-7Al nanocomposite under molten(0.9Na, 0.1K)2SO4at 900 ℃[J]. Scripta Materialia, 2007, 56:891−894.
[2] RAHMAN A, JAYAGANTHAN R, PRAKASH S, CHAWLA V, CHANDRA R. High temperature oxidation behavior of nanostructured Ni-Al coatings on superalloy[J]. Journal of Alloys and Compounds, 2009, 472: 478−483.
[3] MAHESH R A, JAYAGANTHAN R, PRAKASH S, CHAWLA V, CHANDRA R. High temperature cyclic oxidation behavior of magnetron sputtered Ni-Al thin films on Ni- and Fe-based superalloys[J]. Materials Chemistry and Physics, 2009, 114:629−635.
[4] SINGH R R K, GUPTA R K. Oxidation resistance of nanocrystalline vis-à-vis microcrystalline Fe-Cr alloys[J].Corrosion Science, 2009, 51: 316−321.
[5] YE W, LI Y, WANG F H. Effects of nanocrystallization on the corrosion behavior of 309 stainless steel[J]. Electrochim Acta,2006, 51: 4426−4432.
[6] CZERWINSKI F, SMELTZER W W. Microscopy of Oxidation-2[M]. 2nd ed. NEWCOMB S B, BENNETT M J.London: The Institute of Materials, 1993: 128.
[7] HUNTZ A M, ANDRIEUX M, MOLINS R. Relation between the oxidation mechanism of nickel, the microstructure and mechanical resistance of NiO films and the nickel purity Ⅰ.Oxidation mechanism and microstructure of NiO films[J].Materials Science and Engineering A, 2006, 415: 21−32.
[8] PERALDI R, MONCEAU D, PIERAGGI B. Correlations between growth kinetics and microstructure for scales formed by high-temperature oxidation of pure nickel I. Morphologies and microstructures[J]. Oxidation of Metals, 2002, 58: 249−273.
[9] AHN J H, KIM B J, KIM J G, KIM H J,HONG G W, LEE H G,YOO J M, RRADEEP H. Effects of oxidation conditions on the microstructure and texture of NiO in a cube-textured polycrystalline nickel substrate[J]. Physica C, 2006, 445/448:620−624.
[10] HUNTZ A M, LEFEVRE B, CASSINO F. Roughness and oxidation: application to NiO growth on Ni at 800 ℃[J].Materials Science and Engineering A, 2000, 290: 190−197.
[11] RAFAGHA R, LANGER R, EL-SHERIK A M, ERB U,PALUMBO G, AUST K T. The corrosion behaviour of nanocrystalline nickel[J]. Scripta Metall, 1991, 25: 2867−2872.
[12] MISHRA R, BALASUBRAMANIAM R. Effect of nanocrystalline grain size on the electrochemical and corrosion behavior of nickel[J]. Corrosion Science, 2004, 46: 3019−3029.
[13] THIEMIG D, LANGE R, BUND A. Influence of pulse plating parameters on the electrocodeposition of matrix metal nanocomposites[J]. Electrochimica Acta, 2007, 52: 7362−7371.
[14] BUND A, THIEMIG D. Influence of bath composition and pH on the electrocodeposition of alumina nanoparticles and nickel[J].Surface & Coatings Technology, 2007, 201: 7092−7099.
[15] YU Z, FLODSTROM A. Orientation of (1×1)-surface free energies of crystals[J]. Surface Science, 1998, 401: 236−247.
[16] CHEN L, WANG L P, ZENG Z X, XU T. Influence of pulse frequency on the microstructure and wear resistance of electrodeposited Ni-Al2O3composite coatings[J]. Surface &Coatings Technology, 2006, 201: 599−605.
[17] 余志明, 魏秋平, 叶 浚, FLODRSTRÖM A. 正二十面体金刚石的形成及其计算机模拟[J]. 新型炭材料, 2009, 23(6/7):1676−1682.YU Zhi-ming, WEI Qiu-ping, YE Jun, FLODRSTRÖM A.Formation of an icosahedral diamond crystal and its computer simulation[J]. New Carbon Materials, 2009, 23(6/7):1676−1682.
[18] HIBBARD G D, PALUMBO G, AUST K T, ERB U. Nanoscale combined reactions: non-equilibrium α-Co formation in nanocrystalline e-Co by abnormal grain growth[J]. Philosophical Magazine, 2006, 86(2): 125−139.
[19] HART E W. On the role of dislocations in bulk diffusion[J].Acta Metall, 1957, 5: 597.
[20] ATKINSON A. Diffusion along grain boundaries and dislocations in oxides, alkali halides and carbides[J]. Solid State Ionics, 1984, 12: 309−320.
Hot corrosion performance of Ni electrodeposited coatings
MA Li, ZHOU Ke-chao, LI Zhi-you
(State Key Laboratory of Powder Metallurgy, Central South University, Changsha 410083, China)
Ni coatings with different grain sizes, preferred orientation and impurity element contents can be electrodeposited by regulating cathode current density. Using transmission electron microscopy(TEM), scanning electron microscopy (SEM), energy dispersive spectroscopy (EDS) and X-ray diffractometry(XRD), the oxide film structures,composition and morphology of Ni coatings before and after being corroded in corrosive atmosphere of 78.07%Na3AlF6-9.5%AlF3-5%CaF2(mass fraction, %) were investigated comparatively at 960 ℃. The results show that Ni coatings with smaller grains and a strong 〈100〉 preferred orientation are easily obtained under higher current density.While Ni coatings deposited under lower current density have coarser grains and a weak 〈111〉 preferred orientation. In the corrosive atmosphere, Ni coating prepared with a lower current density is benefit to the formation of dense NiAl2O4spinel phase on the surface layer, while NiO is the major phase on the surface of oxide film after the corroding Ni coating prepared with a high current density.
electrodeposition; hot corrosive performance; nickel; grain size; current density; preferred orientation
TG133.4;TG174.2
A
1004-0609(2010)12-2377-10
国家重点基础研究发展计划资助项目(2005CB623703);国家高技术研究发展计划资助项目(2008AA030501);国家自然科学基金创新团队资助项目(50721003);湖南省博士研究生创新基金资助项目(CX2009B032);中南大学贵重仪器开放共享基金资助项目(ZKJ2009024);中南大学优秀博士论文扶持基金资助项目(2009ybfz02)
2009-12-28;
2010-03-05
周科朝,教授,博士;电话:0731-88836264;E-mail:marycsupm@gmail.com
(编辑 李艳红)
