日本看麦娘对高效氟吡甲禾灵代谢抗性的初步研究
2010-11-24韩瑞娟董立尧张宏军南京农业大学植物保护学院农药科学系农业部作物病虫害监测与防控重点开放实验室江苏南京0095农业部农药检定所生物测定室北京0006
韩瑞娟, 董立尧, 李 俊, 张宏军(.南京农业大学植物保护学院农药科学系,农业部作物病虫害监测与防控重点开放实验室,江苏南京 0095;.农业部农药检定所生物测定室,北京 0006)
日本看麦娘对高效氟吡甲禾灵代谢抗性的初步研究
韩瑞娟1, 董立尧1, 李 俊1, 张宏军2
(1.南京农业大学植物保护学院农药科学系,农业部作物病虫害监测与防控重点开放实验室,江苏南京 210095;2.农业部农药检定所生物测定室,北京 100026)
为了明确日本看麦娘对高效氟吡甲禾灵(haloxyfop-R-methyl)的代谢抗性机理,研究了抗性和敏感生物型体内细胞色素P450还原酶(cytochrome P-450 monooxygenases,P450)和谷胱甘肽-S-转移酶(glutathione-S-transferases,GSTs)的活性差异。结果表明,未用药剂处理时,抗性日本看麦娘P450与GSTs的活性均高于敏感日本看麦娘。高效氟吡甲禾灵茎叶喷雾处理2 d后,敏感植株反应剧烈,P450与GSTs活性均呈现急剧的变化趋势,而抗性种群的变化趋势平缓。处理后第6 d,敏感种群较抗性种群先出现下降趋势,其活性也明显低于抗性种群。处理后第10 d活性均降到最低,并且依然低于施药初期。从而可以得出:高效氟吡甲禾灵被抗性日本看麦娘体内的细胞色素P450还原酶催化,经过羟化作用迅速解毒,并在GSTs的催化下形成了无毒或低毒的化合物,使其免受伤害。表明代谢酶活性增强是日本看麦娘对高效氟吡甲禾灵产生抗性的机理之一。
日本看麦娘; 高效氟吡甲禾灵; 代谢; 抗性;P450; GSTs
日本看麦娘(Alopecurusjaponicus)是我国油菜田的一种恶性禾本科杂草,是制约油菜丰产丰收的主要因素。高效氟吡甲禾灵(haloxyfop-R-methyl)活性高,杀草谱广,选择性强,是油菜田防除一年生禾本科杂草的主导药剂。由于高效氟吡甲禾灵的连年广泛使用,近年有报道称日本看麦娘对其产生了明显的抗药性[1]。
关于抗性机制的研究,目前主要有两种:一是靶标酶ACCase结构改变,从而对药剂不敏感;二是对除草剂解毒代谢能力的增强。Brown等报道,鼠尾看麦娘(Aloecurusmyosuroides)ACCase中异亮氨酸突变为亮氨酸是其对烯禾啶(sethoxydim)产生抗性的原因[2]。Hall等研究表明,英国种群的鼠尾看麦娘对禾草灵(diclofop-methyl)和噁唑禾草灵(fenoxaprop-p-ethyl)产生抗性,在某种程度上是由于其对这两种药剂的代谢增强[3]。据报道,抗吡氟禾草灵(fluazifop-p-butyl)的马唐(Digitariasanguinalis)生物型经14C标记显示:吡氟禾草灵在其体内的吸收和输导与敏感型没有差异,但在抗性马唐体内能被快速代谢为其他无毒物质。显然,这种代谢能力的增强在抗性马唐体内起着重要作用[4]。
在杂草对除草剂的解毒代谢过程中有两个酶十分重要:细胞色素P450还原酶(cyt P450)[5-6]和谷胱甘肽-S-转移酶(GSTS )[7-8]。
日本看麦娘对高效氟吡甲禾灵的代谢抗性机理未见报道。因此本文旨在通过测定敏感及抗性日本看麦娘细胞色素P450还原酶和GSTs的活性,明确日本看麦娘对高效氟吡甲禾灵的抗药性是否与代谢增强相关,从而揭示其代谢抗性机理,并为制定油菜田恶性杂草日本看麦娘的防除策略和延缓抗性种群的发展提供科学依据。
1 材料与方法
1.1 供试材料
在安徽、上海、江苏、浙江等我国油菜田主产区采集有代表性的日本看麦娘成熟种子。其采集地点有:(A)句容油菜田;(B)合肥三十岗油菜田;(C)句容休闲田;(D)江苏阜宁;(E)常州市武进休闲田;(F)江都休闲田;(G)江都油菜田;(H)浙江绍兴油菜田;(I)滁州休闲田;(J)金坛市薛坪上阳油菜田;(K)金坛市金城油菜田;(L)上海南汇区油菜田;(M)金坛市开发区休闲田;(N)常州市武进油菜田;(O)金坛市薛坪上阳休闲田。
1.2 不同种群日本看麦娘对高效氟吡甲禾灵抗药性水平的测定
采用种子生物测定法。将40粒预先经低温浸泡过的日本看麦娘种子放于铺有一层滤纸的培养皿内,加入5 mL高效氟吡甲禾灵药液,置于光照培养箱内培养(光照:12 h。温度:白天18 ℃,晚上15 ℃)。药剂处理13 d后,测量芽长,计算日本看麦娘萌发的抑制中剂量(ED50),根据ED50值确定抗性及敏感种群。设清水为对照。重复4次。经过一系列试验得出最适的药剂剂量(表1)。

表1 用于种子生物测定的药剂剂量
相对抗性倍数=不同地区日本看麦娘种群的ED50/敏感日本看麦娘种群的ED50
1.3 细胞色素P450还原酶活性测定
1.3.1 供试材料的准备 将土与沙按2 ∶1混合均匀,装入直径为9 cm的塑料盆钵内,每盆播30粒低温浸泡过的日本看麦娘种子,置于光照培养箱内培养,培养条件同1.2。出苗后每盆定苗20株。3周后日本看麦娘长至3~4叶期,用高效氟吡甲禾灵97.2 mg/m2进行茎叶喷雾处理。喷雾采用农业部南京农业机械化研究所生产的3WPSH-500D型生测喷雾塔,圆盘直径50 cm,主轴转动速度6 r/min,喷头孔径0.3 mm,喷雾压力0.3 MPa,雾滴直径100 μm,喷头流量90 mL/min。分别在处理后第1 d、2 d、3 d、6 d、8 d、10 d采集样品。设清水为对照。
1.3.2 细胞色素P450微粒体的提取 取约5 cm高的幼苗1.00 g,立即用10 mmol/L的Na2S2O4浸洗,用沙布吸干后放入液氮中。在预冷的研钵中加0.5 g聚乙烯吡咯烷酮(PVP-40)和1.5 mL提取缓冲液(0.1 mol/L磷酸,pH值7.5,10%甘油,0.1%BSA,5 mmol/L DTT,1 mmol/L LiCO3)研磨,匀浆后于10 000 g离心20 min,取上清液于100 000 g超速离心80 min,将沉淀的微粒体部分悬浮于适当体积的0.1 mol/L磷酸缓冲液(含10%甘油,1.5 mmol/L巯基乙醇,pH值8.5),贮存于-20 ℃冰箱备用。以上操作均在0~4 ℃条件下进行[9]。
1.3.3 细胞色素P450还原酶的活性测定 参照Feng等[10]的方法。3 mL反应混合液中含有2.8 mL磷酸缓冲液、酶液100 μL、5 mg/mL细胞色素C 100 μL。样本比色杯中加入5 mg/mL还原型辅酶Ⅱ(NADPH)0.02 mL启动反应,立即混匀。另取3 mL混合液加入与NADPH等量的缓冲液作为对照。用分光光度计测定550 nm处的光吸收值A,每分钟测定1次,连续测定3次。以摩尔消光系数21 (mmol/L)-1·cm-1来计算活性。公式如下:
蛋白活性=D×1 000/(21×C)
其中D为吸光值,C为稀释后样品的蛋白质浓度(mg/mL),蛋白活性单位为nmol/(min·mg)。
P450相对活性为P450施药活性与同期对照活性的比值。
试验平行测定3次。
1.4 谷胱甘肽-S-转移酶(GSTs)活性测定
1.4.1 供试材料的准备 同1.3.1。
1.4.2 谷胱甘肽-S-转移酶(GSTs)的提取 取茎叶组织0.5 g在液氮中冷冻,并快速研磨成粉末。加入pH值7.5,0.1 mol/L Tris-HCL,1 mmol/L的EDTA,14 mmol/L的β-巯基乙醇,7.5%的PVP-40,并用双层纱布过滤。过滤后组织匀浆离心(4 ℃,15 000 g,20 min)。上清液用0.1倍体积的硫酸鱼精蛋白处理后,重新离心。最后用加入硫酸铵至饱和度为80%,如前所述条件下离心,所得蛋白质颗粒在-20 ℃下保存。上述蛋白提取物用2 mmol/L的磷酸钾缓冲液(pH值6.8)盐析,过Sephadex G-25柱子,收集馏分。调节蛋白质浓度至10 mg/mL,以备测定酶的活性[11]。
1.4.3 谷胱甘肽-S-转移酶(GSTs)的活性测定 参照John[12]、吴进才等[13]方法。在3 mL Tris-HCl缓冲液(0.1 mol/L,pH值8,含25 mmol/L还原性谷胱甘肽)中加0.1 mL酶液,25 ℃保温10 min,加入0.1 mL无水乙醇配制的13 mmol/LCDNB(2,4-二硝基氯苯),反应10 min后,于340 nm处测得D值。以摩尔消光系数9.5 (mmol/L)-1·cm-1来计算活性。公式如下:
蛋白活性=D×1 000/(9.5×C)
其中D为吸光值,C为稀释后样品的蛋白质浓度(mg/mL),蛋白活性单位为nmol/(min·mg)。
GSTs相对活性为GSTs施药活性与同期对照活性的比值。试验平行测定3次。
1.5 蛋白含量测定
参照Bradford(1976)[14]考马斯亮蓝G-250染色法测定,以牛血清蛋白(BSA)为标准曲线。
1.6 数据处理
用DPS软件数量型数据分析法分别求出高效氟吡甲禾灵对不同日本看麦娘种群的毒力回归方程、ED50。
2 结果与分析
2.1 不同日本看麦娘种群对高效氟吡甲禾灵的抗性水平
由表2可以看出,不同种群的日本看麦娘对高效氟吡甲禾灵的抗性水平不同。其中句容种群ED50值最大,为1756.00 μg/m2,其相对抗性倍数高达292.90;金坛市薛坪上阳休闲田ED50值最小,为6.00 μg/m2。表明句容种群对高效氟吡甲禾灵已产生明显的抗性,与本实验室前期报道结果一致[1]。因此,以句容种群为抗性生物型,薛坪上阳种群为敏感生物型进行试验。
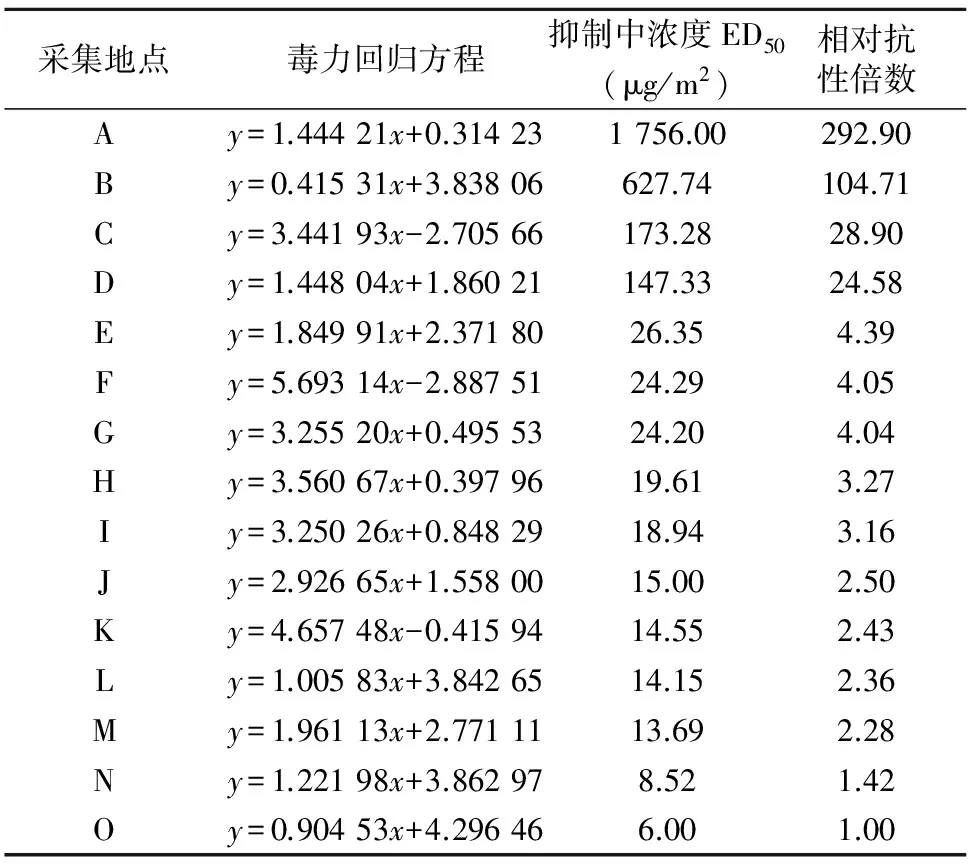
表2 不同日本看麦娘种群对高效氟吡甲禾灵的抗性水平
注:相对抗性倍数=不同地区日本看麦娘种群的ED50/金坛市薛坪上阳休闲田的日本看麦娘种群ED50
2.2 细胞色素P450还原酶活性
未用药剂处理时抗性日本看麦娘种群的P450活性为41.86 pmol/(min·mg),高于敏感日本看麦娘种群27.30 pmol/(min·mg)。图1显示,在高效氟吡甲禾灵97.2 mg/m2处理3 d后,敏感日本看麦娘种群P450活性急剧上升,而抗性种群上升趋势平缓,说明敏感种群受药剂影响较大,反应激烈。药剂处理6 d后,敏感种群P450活性开始下降,而抗性种群仍然保持增加趋势,表明抗性种群对高效氟吡甲禾灵仍有较高的代谢能力。药剂处理8 d后,抗性种群P450活性也开始出现下降趋势,但其活性明显高于敏感种群,这与敏感种群先于抗性种群出现死亡迹象相一致。

结果表明,高效氟吡甲禾灵被抗性日本看麦娘体内的细胞色素P450还原酶催化,迅速降解,可能是日本看麦娘对其产生抗性的机理之一。
2.3 谷胱甘肽-S-转移酶(GSTs)活性
未用药剂处理时,抗性日本看麦娘种群的GSTs活性11.01 nmol/(min·mg),高于敏感日本看麦娘种群6.39 nmol/(min·mg)。图2显示,高效氟吡甲禾灵97.2 mg/m2处理2 d后,敏感日本看麦娘种群GSTs活性急剧下降,而抗性种群下降趋势较缓。药剂处理3 d后,敏感种群GSTs活性升高,这可能是日本看麦娘本身受到外界环境胁迫后表现出的应激反应。随后又呈下降趋势,说明高效氟吡甲禾灵的药效逐渐显现。而抗性种群在整个过程中变化都很缓慢,说明抗性种群受药剂的影响较小。药剂处理8 d后,敏感及抗性种群体内GSTs活性又呈上升趋势,但敏感种群明显低于抗性种群,且均低于施药初期,这与敏感种群首先出现死亡迹象相一致。
结果表明,经过第一阶段的代谢作用产生的代谢产物,在GSTs的催化下形成了对抗性日本看麦娘无毒或低毒的化合物,使其免受伤害,可能是抗性机理之一。

3 讨论
除草剂在植物体内通过其官能团或反应基的变化经过3个阶段完成全部代谢过程,即代谢作用(metabolism)—缀合作用(conjugation)—分离(separation),从而使其生物活性完全丧失。第一阶段是最重要的,在这一阶段中,P450可以对不同类型的除草剂通过脱烷基或羟基化等作用进行修饰[15],催化众多亲脂除草剂的氧化作用[16]。大量证据证明了细胞色素P450酶系参与了对许多除草剂的代谢和解毒作用[17]。芳环或烷基羟基化是细胞色素P450羟基化酶诱导的除草剂最普遍的代谢反应。
在小麦(Triticumaestivum)中,禾草灵被其体内的细胞色素P450单加氧酶催化的芳基羟化作用迅速解毒[6]。在抗禾草灵的不实野燕麦(Avena sterilis)和鼠尾看麦娘中也发现了相似的代谢途径[18-19]。有报道称增强的解毒作用是瑞士黑麦草(Loliumrigidum)和看麦娘(Alopecurusaequalis)的抗药性机制,这种抗性机制常常是由细胞色素P450单加氧酶活性或表达增强引起的[3,20-21]。
第二阶段的代谢主要是合成过程,即酶催化第一阶段产生的代谢产物经过缀合作用,形成对植物无毒或低毒的化合物,此类代谢反应主要是由谷胱甘肽-S-转移酶诱导[16]。多种类型除草剂在杂草体内均是由GSTS催化进行不可逆的缀合作用而导致选择性的[22]。
噁唑禾草灵能在小麦、大麦(Hordeumvulgare)和止血马唐(Digitariaischaemum)体内被代谢则是由于在GSTs催化下其羟化丙酸酯基团被亲核取代(nucleophilic substitution)[21]。同时在鼠尾看麦娘的抗芳氧苯氧丙酸酯类除草剂生物型中发现了比敏感生物型更高的GSTs活性[7,23]。Western blot分析表明抗噁唑禾草灵的看麦娘体内GSTs活性增强与25 kd多肽和另两个异常的27 kd和28 kd免疫反应多肽的表达提高相关,因此GSTs的高活性和谷胱甘肽的有效性有助于通过谷胱甘肽与ACCase的轭合使除草剂解毒,从而使看麦娘对噁唑禾草灵产生抗药性[7]。
为了研究日本看麦娘的代谢与抗性机理的关系,本研究所选用的日本看麦娘种群是本实验室前期报道的抗性生物型,关于其抗性机理未见报道。本研究结果得出P450活性在抗性与敏感植株体内的变化存在着差异,并且由于测定活性时加入了NADPH,从而可以看出细胞色素P450可以催化高效氟吡甲禾灵使其羟基化。这一结论与Yun等的研究结果[24]相一致。Frear等[25]报道绿磺隆(chlorsulfuron)在小麦体内为羟基化代谢,且为小麦细胞色素P450催化。
未用药剂处理时抗性日本看麦娘的GSTs与P450活性均高于敏感日本看麦娘。施药1 d后P450与GSTs的活性均在敏感种群体内发生急剧变化,而在抗性种群中变化趋势平缓,并且敏感种群首先出现下降趋势,说明敏感日本看麦娘种群较易受到高效氟吡甲禾灵的影响。随后抗性种群较敏感种群首先出现上升趋势,即抗性种群代谢酶活性增强能迅速将体内除草剂代谢使其活性丧失,从而保护自身使其免受伤害。虽然敏感种群也能出现上升趋势,但其活性依然低于抗性种群,且明显低于施药初期。这可能是由于植物本身受到外界环境的刺激而表现出的应激反应,也就解释了为什么敏感种群首先出现死亡迹象。
研究表明,高效氟吡甲禾灵被抗性日本看麦娘体内的细胞色素P450还原酶催化,经过羟化作用迅速解毒,并在GSTs的催化下形成了无毒或低毒的化合物,使其免受伤害。因此,代谢酶活性增强是日本看麦娘对高效氟吡甲禾灵产生抗性的机理之一。
[1]杨彩宏. 油菜田日本看麦娘对高效氟吡甲禾灵抗药性的研究[J]. 中国农业科学,2007,40(12):2759-2765.
[2]Brown A E,Moss S R,Wilson Z A,et al. An isoleucine to leucine substitution in the ACCase ofAlopecurusmyosuroides(black-grass) is associated with resistance to the herbicide sethoxydim[J]. Pesticide Biochemistry and Physiology,2002,72:160-168.
[3]Hall L M,Moss S R,Powles S B. Mechanisms of resistance to aryloxyphenoxypropionate herbicides in two resistant biotypes ofAlopecurusmyosuroides(black-grass):Herbicide metabolism as a cross-resistance mechanism[J]. Pesticide Biochemistry and Physiology,1997,57(2):87-98.
[4]Hidayat I,Preston C. Enhanced metabolism of fluazifop acid in a biotype ofDigitariasanguinalisresistant to the herbicide fluazifop-P-butyl[J]. Pesticide Biochemistry and Physiology,1997,57(2):137-146.
[5]Helvig C,Tardif F J,Seyer A,et al. Selective inhibition of a cytochrome P450enzyme in wheat that oxidizes both the natural substrate lauric acid and the synthetic herbicide diclofop[J]. Pesticide Biochemistry and Physiology,1996,54:161-171.
[6]McFadden J J,Frear D S,Mansager E R. Arylhydroxylation of diclofop by a cytochrome P450dependent monooxygenase from wheat[J]. Pesticide Biochemistry and Physiology,1989,34:92.
[7]Cummins I,Moss S R,Cole D J,et al. Glutathione transferases in herbicide-resistant and herbicide susceptible black-grass (Alopecurusmyosuroides) [J]. Pestic Science,1997,51(3):244-250.
[8]Hatton P J,Dixon D,Cole D J,et al. Glutathione transferase activities and herbicide selectivity in maize and associated weed species[J]. Pestic Science,1996,46(3):267-275.
[9]向文胜,王相晶,越长山,等. 小麦细胞色素P450S对绿磺隆的催化代谢作用[J]. 东北农业大学学报,1999,30(4):396-399.
[10]Feng R,Houseman J G,Downe A E R. Effect of ingested meridicdiet and corn leaves on m idgut detoxification processes in the European corn borer,Ostrinianubilalis[J]. Pesticide Biochemistry and Physiology,1992,42(3) :203-210.
[11]Hatton P J,Cole D J,Edwards R. Influence of plant age on glutathione levels and glutathione transferases involved in herbicide detoxification in corn (ZeamaysL.) and giant foxtail (SetariafaberiHerrm)[J]. Pesticide Biochemistry and Physiology,1996,54(3) :199-209.
[12]John W G. Effect herbicide antidotes on glutathione content and glutathione S-transferase activity ofSorghumshoots[J]. Pesticide Biochemistry and Physiology,1987(29) :66-76.
[13]吴进才,许俊峰,冯绪猛,等. 稻田常用农药对水稻3个品种生理生化的影响[J]. 中国农业科学,2003,36(5):536-541.
[14]Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dyebinding[J]. Analyt Biochemistry,1976,72:248-254.
[15]向文胜,苏少泉,赵长山. 植物细胞色素P-450(cyt-P450)对除草剂的代谢作用[J]. 东北农业大学学报,1997,28(2):193-200.
[16]苏少泉. 除草剂在植物体内的代谢与选择性及使用[J]. 现代农药,2003,2(6):14-17.
[17]Werck-Reichhart D,Hehn A,Didierjean L. Cytochromes P450for engineering herbicide tolerance[J]. Trends in Plant Science,2000,5(3):116-123.
[18]Maneechote C,Preston C,Powles S B. A diclofop-methyl resistantAvenasterilisbiotype with a herbicide-resistant acetyl-coenzyme A carboxylase and enhanced metabolism of diclofop-methyl[J]. Pestic Science,1997,49:105-114.
[19]Menendez J,DePrado R. Diclofop-methyl cross resistance in a chlorotoluron-resistant biotype ofAlopecurusmyosuroides[J]. Pesticide Biochemistry and Physiology,1996,56(2):123-133.
[20]Preston C,Tardif F J,Christopher J T,et al. Multiple resistance to dissimilar herbicide chemistries in a biotype ofLoliumrigidumdue to enhanced activity of several herbicide degrading enzymes[J]. Pesticide Biochemistry and Physiology,1996,54(2):123-134.
[21]Menéndez J,De Prado R. Characterization of two acetyl-Co A carboxylase isoforms in diclofop-methyl-resistant and -susceptible biotypes ofAlopecurusmyosuroides[J]. Pesticide Biochemistry and Physiology,1999,65(2):82-89.
[22]DeRidder B P,Dixon D P,Beussman D J,et al. Induction of glutathione S-transferases in Arabidopsis by herbicide safeners[J]. Plant Physiol,2002,130:1497-1505.
[23]Tal A,Romano M L,Stephenson G R,et al. Glutathione conjugation:A detoxification pathway for fenoxaprop-ethyl in barley,crabgrass,oat,and wheat[J]. Pesticide Biochemistry and Physiology,1993,46(3):190-199.
[24]Yun M S,Yogo Y. Cytochrome P-450 monooxygenase activity in herbicide-resistant and -susceptible late watergrass (Echinochloaphyllopogon)[J]. Pesticide Biochemistry and Physiology,2005,83(2/3):107-114.
[25]Frear D S,Swanson H R. Induced microsomal oxidation of diclofop triasulfurom chlorsnlfuron and linuron in wheat[J]. Pesticide Biochemistry and Physiology,1997,41:274-287.
韩瑞娟,董立尧,李 俊,等. 日本看麦娘对高效氟吡甲禾灵代谢抗性的初步研究[J]. 杂草科学,2010(1):3-7.
S451.22+4
A
1003-935X(2010)01-0003-05
2009-12-25
国家自然科学基金(编号:30971928);博士点基金新教师类项目(编号:20090097120046)。
韩瑞娟(1985—),女,硕士研究生,研究方向为除草剂毒理及抗药性。E-mail:2007102110@njau.edu.cn。
董立尧,教授,从事除草剂毒理及抗药性研究。Tel:(025)84395672; E-mail:dly@njau.edu.cn。
