腐植酸尿素氨挥发特性及影响因素研究
2010-11-21刘增兵赵秉强林治安
刘增兵,赵秉强,林治安
(1中国农业科学院农业资源与农业区划研究所,北京100081;2江西省农业科学院土壤肥料与资源环境研究所,江西南昌330200)
尿素是中性有机态氮肥,是目前主要氮肥品种之一[1]。尿素施入土壤后,在短时间内即转化为离子态速效氮素营养供应作物,若作物不能及时吸收,易造成氮素损失。研究表明,尿素作物的当季利用率仅为28%~41%,平均为33.7%[2],其余大部分通过挥发和淋洗等途径损失,不但造成资源、能源浪费,也给环境带来巨大压力[3]。氨挥发是尿素施入农田后的主要损失途径之一[4-5],在石灰性[4]、中性或微酸性土壤中都有明显的氨挥发[6],损失量占施氮量的0.41%~40%[7-8]。降低氮肥损失,提高氮肥尤其是尿素的氮素利用率是当今植物营养领域的研究热点之一[9]。
腐植酸是一类用途广泛的复杂有机芳香羧酸大分子[10],含有酚羟基、羟基等多种官能团,具有较强的亲水、离子交换、络合和吸附能力。腐植酸与尿素有机结合,可生成稳定的化学键,降低氮释放速度[11]。通过施肥方式、添加化学物质(脲酶抑制剂、表面分子膜、杀藻剂等)降低氨挥发的研究已有不少报道[12],但有关熔体造粒工艺生产的腐植酸尿素的氨挥发损失研究还不多见。为此,采用室内培养试验,研究了添加不同腐植酸比例的熔体造粒腐植酸尿素在土壤中氨挥发损失特性及其与氮素释放特性、土壤脲酶活性、氮转化的关系,为腐植酸尿素生产工艺,减少氨挥发损失提供依据。
1 材料与方法
1.1 供试肥料制备
碱处理风化煤得到水溶性腐植酸溶液,与熔融尿素按比例混合,采用熔体喷浆造粒工艺制得HA类4种不同腐植酸含量的复合尿素产品:HA1(全氮42.14%,水溶性腐植酸 2.27%);HA2(全氮40.88%,水溶性腐植酸 5.52%);HA3(全氮39.49%,水溶性腐植酸 8.01%);HA4(全氮37.42%,水溶性腐植酸11.78%)。腐植酸尿素制造过程尿素加热温度控制在110~115℃,喷浆造粒采用油冷方式进行模拟,油冷柱高度为80 cm,尿素颗粒在油冷柱中下降时间为4~5 s,在柱中停留时间不少于10 min。
1.2 研究方法
1.2.1 氨挥发量测定 试验所用土壤取自中国农业科学院德州实验站禹城试验基地,前茬作物为夏玉米。土壤为潮土,有机质 1.53%,全氮 0.053 g/kg,有效磷15.2 mg/kg,有效钾 87.3 mg/kg。
土壤培养试验:4种腐植酸尿素于2008年4月15日开始,采用密闭培养瓶培养,以普通尿素(46.15%)作对照(CK),其他处理施氮量均为684 mg/kg,土,共5个处理,6次重复,其中3次重复测定氨挥发量,3次重复取土测定土壤脲酶和铵态氮、硝态氮含量。具体方法:每个培养瓶中装入过2 mm筛风干土壤1000 g,其中500 g先放入瓶中,加105 mL蒸溜水,另外500 g与腐植酸尿素混合均匀后放于瓶中,加蒸溜水105 mL,使土壤水分含量达到21%(最大田间持水量的60%),连续密闭25℃培养 。在培养 24 h、48 h、96 h 、1wk、2 wk、3 wk 和 4 wk后从培养瓶取土50 g,测定土壤脲酶活性和土壤铵态氮、硝态氮含量。土壤脲酶活性采用苯酚次氯酸钠比色法,铵态氮硝态氮测定采用氯化钙浸提,流动注射分析仪(产地荷兰)测定。
氨挥发量测定:采用“静态吸收法”[13],密闭培养瓶封闭培养。内置装有2%硼酸20 mL和两滴甲基红指示剂的小烧杯吸收释放的氨气,分别于培养第 1、2、3、4、5、6、7、10、14、18、21、28 和35 d 取出小烧杯,用0.01 mol/L硫酸标准溶液滴定氨吸收量,然后更换硼酸溶液继续培养试验。
1.2.2 肥料氮素淋溶特性试验
氮素淋溶测定:采用土柱淋洗法[14]。试验装置为下部带有止水夹细管的PVC管,高25 cm,直径6.5 cm,土柱底部有纱布与石英砂组成的过滤装置,保证淋洗土壤稳定性,土柱中装土壤-肥料混合物,顶部置一层1 cm厚的石英砂。称取过2 mm筛的风干土壤1000 g,施氮量684 mg/kg,供试肥料与土壤充分混匀,装入土柱,共5个处理(同1.2.1),3次重复。土柱置于培养箱内25℃培养。培养期间用去离子水保持土壤含水量21%(最大田间持水量的60%)。培养至 1、7、23、47、95h 和 1、2、3、4wk时 ,加50 mL去离子水,平衡1 h后打开止水夹,用烧杯收集等量渗出液,测定渗出液中的全氮含量,测定方法采用碱性过硫酸钾氧化—紫外比色法[15]。
2 结果与分析
2.1 腐植酸尿素氨挥发特性
不同肥料品种施入土壤后氨挥发量随培养时间的推移呈现先升高后降低的趋势。腐植酸尿素出现氨挥发高峰的时间比普通尿素(CK)稍晚,普通尿素在培养2 d,HA1和HA2在培养3 d出现氨挥发高峰,腐植酸含量较高的HA3和HA4在第4 d才出现氨挥发高峰,氨挥发高峰时的挥发量也远低于对照。其氨挥发总量也显著低于对照,HA1、HA2、HA3和HA4分别比CK减少氨挥发损失48.14%、47.99%、30.89%和59.22%,说明HA类肥料可以显著降低氨挥发损失(表1)。
表1还看出,各处理氨挥发量占总施氮量的比例,普通尿素为0.747%,HA类肥料中以HA3最高为0.516%,HA4最低为0.305%。腐植酸尿素中,HA4氨挥发损失量最小,且挥发高峰时间较晚;HA1和HA2氨挥发量不高,但氨挥发峰值出现较早。HA3腐植酸含量较高,有效延迟氨挥发高峰时间,但其氨挥发总量较高,原因可能与其后期氮含量较高,肥料加工中腐植酸与尿素结合效率较低有关。HA4有效延缓氨挥发高峰时间,并降低氨挥发损失总量,可能在于其高含量的腐植酸与较高的腐植酸与尿素结合效率;腐植酸与尿素结合方式和结合效率与腐植酸含量可能共同影响肥料氨挥发表现,具体原因需要进行肥料结构和结合效率的研究。
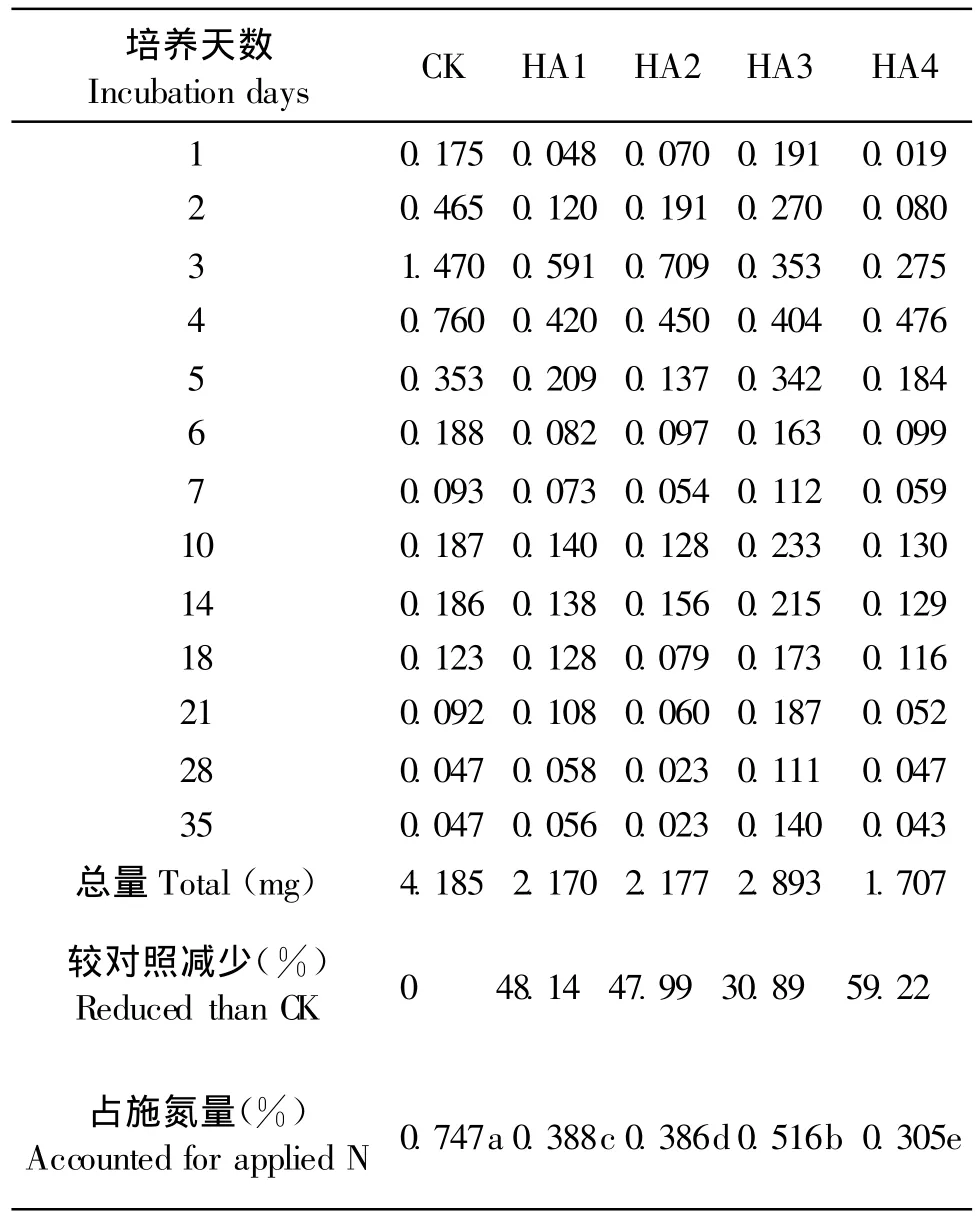
表1 各处理氨挥发损失氮量(mg/pot)Table 1 Volatilization of ammonia of different treatments
2.2 腐植酸尿素土壤脲酶活性及其对氨挥发的影响
整个培养期间,各处理土壤脲酶活性变化都呈先升高后降低趋势(图1)。表明尿素施入土壤后,氮释放能激活脲酶,提高脲酶活性;随培养时间延长,氮浓度下降,土壤中脲酶活性降低[16]。培养2 wk之前,各腐植酸尿素显著降低土壤脲酶活性,其中腐植酸含量高的HA4效果最明显;2 wk后腐植酸尿素的氮缓释性使土壤中脲酶活性维持一定水平。
图1看出,肥料在施入土壤1wk内,腐植酸尿素土壤脲酶活性低于CK。培养48 h,HA1、HA2、HA3和HA4脲酶活性分别比CK低30.74%、26.10%、40.44%、44.85%;培养96 h,分别比CK低30.16%、18.69%、40.01%、44.92%。培养7d左右时,各处理土壤脲酶活性都出现高峰,处理之间差异缩小。培养2~4 wk后,CK土壤脲酶活性快速下降,低于腐植酸尿素,而腐植酸尿素则维持一定水平。
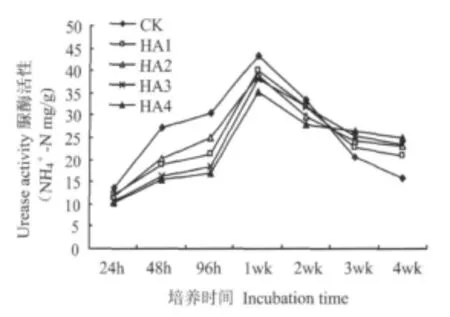
图1 培养期间土壤脲酶活性随培养时间变化Fig.1 Chang of soil urease activity in incubation time
脲酶是一种作用于线型酰胺键的水解酶,能催化尿素和有机氮的转化,有利于NH+4-N的形成[17],脲酶活性强弱直接影响土壤氨挥发损失[18]。在培养24、48、96 h和 1wk,氨挥发量同脲酶活性相关性分别为 0.315、0.825、0.808、0.384,表明肥料施入 24 h氮释放还未开始,脲酶未被诱导活性较低,在48~96 h,氨挥发量同脲酶活性相关性显著提高,随着培养时间的延长,土壤环境等影响因素发生变化,脲酶活性成为影响氨挥发量的一个影响因素而并非决定因素,二者相关性显著降低。
2.3 腐植酸尿素氮溶出率与氨挥发关系
由图2可知,培养期间CK氮淋出率在培养24~96 h下降迅速,到培养1wk基本释放完毕;HA1、HA2、HA3和HA4在淋洗初期氮淋出率低于对照,在培养48~96 h后高于对照,完全释放时间可持续2~3 wk。培养期间HA1、HA2、HA3和HA4氮累积溶出率分别为 68.38%、63.25%、62.78%和46.83%,分别比对照低6.76%、11.88%、12.36%和28.31%。说明腐植酸复合尿素具有缓释作用,能够有效降低尿素在土壤中氮释放速度和淋溶损失。土壤脲酶主要吸附于土壤有机无机复合体上[19],土壤中尿素吸附到土壤颗粒,与酶活性部位结合,才能完成尿素的转化[20]。分析表明,土壤中氨挥发总量同普通尿素和腐植酸尿素在土壤中累积溶出量相关系数(r)0.903,达到显著水平。腐植酸尿素和普通尿素淋出率反映土壤中肥料氮的释放比例及氮吸附到土壤颗粒的比例,因而直接影响土壤氨挥发。CK、HA1、HA2、HA3和HA4在1 wk内氮淋出量分别占各自在培养期间总淋出量的 98.60%、97.53%、97.42%、97.52%和96.63%;氨挥发量分别占各处理培养期间总氨挥发量的 83.7%、71.1%、78.5%、63.4%和69.8%,说明腐植酸尿素降低氨挥发的主要途径是影响尿素转化为氨态氮的过程。
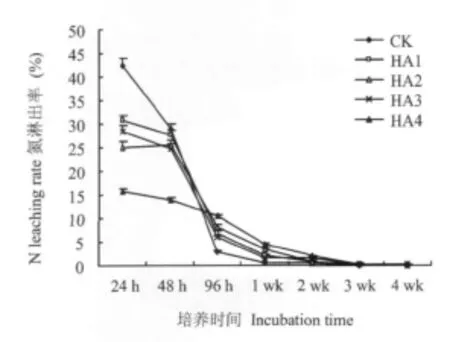
图2 腐植酸尿素土柱淋洗氮素淋出率Fig.2 N leaching rate of humic urea in soil
2.4 腐植酸尿素氮转化与氨挥发关系
土壤尿素在脲酶作用下水解,转化为铵态氮后,容易引起NH4的损失,氨在土壤中会进一步转化为硝态氮[21]。影响尿素在土壤中的转化过程,可能会影响到土壤的氨挥发过程与数量。
图3看出,土壤中铵态氮随培养时间变化呈先升高后降低趋势,主要铵态氮形成集中于培养1 wk之内 。CK 、HA1、HA2、HA3和HA4在1 wk内铵态氮形成 量 为 108.44、106.4、107.81、92.7 和 91.22 mg/pot,占培养期间总量的 88.80%、91.17%、88.18%、87.64%和91.72%,培养1~2 wk土壤中铵态氮数量迅速下降。其中尿素处理铵态氮含量高峰期在培养24~96 h,峰值出现在培养48 h;腐植酸尿素铵态氮形成集中在培养24 h到1 wk,HA1、HA2和HA3铵态氮含量高峰出现在培养48~96 h,HA4则在培养1 wk时才出现高峰。尿素与腐植酸尿素硝态氮集中转化时间不同,CK从96 h到培养2 wk硝态氮迅速形成,而腐植酸尿素硝态氮形成则集中于1~2wk之间。
本研究中培养1 wk氨气的形成与铵态氮含量的相关系数(r)为 0.8693,可能是腐植酸与NH2COOH结合形成复合体,延长铵态氮形成时间,降低其含量,从而延后氨气形成高峰时间,降低氨气挥发损失。
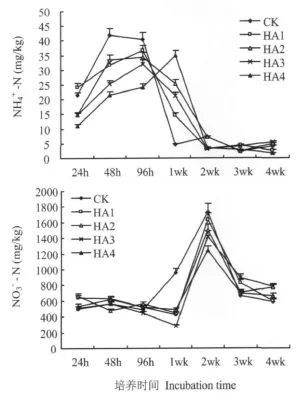
图3 土壤培养硝态氮和铵态氮含量Fig.3 Content of NO-3-N and NH+4-N of soil during incubation
3 讨论与结论
3.1 腐植酸尿素氨挥发特性
氮肥施入土壤中的去向主要有植物吸收、土壤固持、氨气挥发和以硝态氮形式淋失,其中氨挥发不但造成氮素损失,也带来环境问题[22]。NH3不仅以干湿沉降返回地表[23],而且作为N2O和NO的二次源,在对流层中通过光化学反应产生NO、NO2和相当数量的N2O[24],引起严重的生态环境污染。本研究中熔融造粒腐植酸尿素较普通尿素氨挥发量显著降低。关松荫等[25]通过表面分子膜处理可减少氨挥发数量30%。采用融造粒制成的腐植酸尿素无需特殊措施,可比普通尿素降低氨挥发量30.89%~59.22%,同时还降低氮素淋溶速度和淋出比例,提高肥料利用效率。熔融造粒腐植酸尿素降低氨挥发的特性,应用于设施保护地栽培,可有效降低因氨挥发对作物造成的损害[26]。腐植酸尿素中腐植酸添加比例不同,其降低氨挥发效果存在差异,添加高量腐植酸的HA4降低氨挥发比例最高,这可能与添加腐植酸的较高活性官能团总量和尿素与腐植酸较高结合效率有关。
3.2 腐植酸尿素氨挥发影响因素
熔融造粒腐植酸尿素施入土壤后,土壤脲酶活性在培养1周之前显著低于普通尿素,这是降低氨挥发数量的重要原因。腐植酸与尿素有机结合,降低氮淋溶速率,较低的氮溶出速率和比例,是腐植酸尿素土壤氨挥发降低的原因之一。腐植酸尿素转化为铵态氮的速度和比例显著低于普通尿素,有效降低氨气的生成数量。本研究结果显示,土壤氨挥发量与脲酶活性在土壤培养48和96 h呈显著正相关;土壤中氨挥发总量同普通尿素和腐植酸尿素在土壤中累积溶出量以及培养前期土壤氨挥发量同铵态氮含量也成显著正相关。
腐植酸尿素在土壤中的缓释性,表现在降低氮淋溶速度和比例,抑制脲酶活性,减缓尿素向铵态氮转化的速度。一般来说,氮溶出率低者,氨挥发少,腐植酸尿素缓释性的强弱,可以作为评估氨挥发的一个重要指标,也是衡量缓释肥料的一个重要指标[26]。本研究表明,腐植酸尿素氨挥发损失量与普通尿素差异达到显著水平,其中HA4氨挥发量最低。熔融造粒腐植酸尿素以相对简单的加工方法,有效降低氨挥发和氮溶出损失,提高肥料利用率,在有效控制农业面源污染和减少氮肥施用引起的生态问题方面具有积极作用。
[1]郑福丽,石元亮.抑制剂对尿素转化及土壤中氮的影响研究[J].土壤通报,2007,38(2):412-414.Zheng F L,Shi Y L.Effects researches of inhibitors on urea transformation and N concentration and formation in soil[J].Chin.Soil Sci.,2007,38(2):412-414.
[2]陈德明,王亭杰,雨山江.缓释和控释尿素的研究与开发综述[J].化工进展,2002,21(7):455-461.Chen D M,Wang T J,Yu S J.Review on the research and development of control-release urea and slow-release urea[J].Chem.Ind.Eng.Prog.,2002,21(7):455-461.
[3]赵秉强,张福锁,廖宗文,等.我国新型肥料发展战略研究[J].植物营养与肥料学报,2004,10(5):536-545.Zhao B Q,Zhang F S,Liao Z W et al.Research on development strategies of fertilizer in China[J].Plant.Nutr.Fert.Sci.,2004,10(5):536-545.
[4]曹金留,田光明,任立涛.江苏南部地区稻麦两熟土壤中尿素的氨挥发损失[J].南京农业大学学报,2000,23(4):51-54.Cao J L,Tian G M,Ren L T.Ammonia volatilization from urea applied to the field of wheat and rice in southern Jiangsu Province[J].J.Nanjing Agric.Univ.,2000,23(4):51-54
[5]朱兆良,文启孝.中国土壤氮[M].南京:江苏科学技术出版社,1992.213-249.Zhu Z L,Wen Q X.Nitrogen in soilsof China[M].Nanjing:Jiangsu Science Technology Press,1992.213-249.
[6]Cai G X,Peng G H,Wang X Z et al.Ammonia volatilization from urea applied to acid paddy soil in southern Chian and its control[J].Pedosphere,1992,4:345-354.
[7]沈善敏.氮肥在中国农业发展中的贡献和农业中氮的损失[J].土壤学报,2002,39(增刊):12-25.Shen S M.Contribution of nitrogen fertilizer to the development of agriculture and its loss in China[J].Acta Pedol.Sin.,2002,39(suppl.):12-25.
[8]Tian G M,Cao J L,Cai Z C et al.Ammonia volatilization fromwinter wheat field top-dressed with urea[J].Pedosphere,1998,8(4):331-336.
[9]李兆君,马国瑞.腐植酸尿素的制造及其增产作用机理的研究近况[J].土壤通报,2004,35(6):799-801.Li Z J,Ma G R.The recent situation for manufacturing urea humic acid and mechanesm in incriasing crop yield[J].Chin.Soil Sci.,2004,35(6):799-801.
[10]武丽萍.腐植酸肥料与绿色农业[J].腐植酸,2003,(4):6-10.Wu L P.Humic acid fertilizer and green agriculture[J].Humic Acid,2003,(4):6-10.
[11]梁宗存,成绍鑫,武丽萍.煤中腐植酸与尿素相互作用机理的研究[J].燃料化学学报,1999,27(2):176-181.Liang Z C,Cheng S X,Wu L P.Study on mechanism of interaction between coal humic acid and urea[J].J.Fuel Chem.Tech.,1999,27(2):176-181.
[12]庄舜尧.表面分子膜降低氨挥发的Logistic模型研究[J].土壤与环境,2002,11(1):47-49.Zhuang S Y.Logistic model research on effect of surface film on ammonia volatilization[J].Soil Environ.Sci.,11(1):47-49.
[13]凌莉,李世清,李生秀.石灰性土壤氨挥发损失的研究[J].土壤侵蚀与水土保持学报,1999,5(6):119-122.Ling L,Li S Q,Li S X.Study on ammonia volatilization from calcareous soil[J].J.Soil Eros.Soil Water Conserv.,1999,5(6):119-122.
[14]薛世川,孙志梅,彭正萍,等.腐植酸复合肥的养分释放规律与控释机理研究[J].腐殖酸,2001,(3/4):30-32.Xue S C,Sun Z M,Peng Z P et al.Research on nutrients releasing rule and control release mechanism of humic acid compound fertilizer[J].Humic Acid,2001,3/4):30-32.
[15]鲁如坤.土壤农业化学分析方法[M].北京:农业出版社,2000.Lu R K.Soil agricultural chemistry analysis[M].Beijing:Agricultural Press,2000.
[16]杜建军,毋永龙,田吉林,等.控/缓释肥料减少氨挥发和氮淋溶的效果研究[J].水土保持学报,2007,21(2):49-52.Du J J,Wu Y L,Tian J L et al.Effect of several controlled slowrelease fertilizers on decreasing ammonia volatilization and N leaching[J].J.Soil Water Conserv.,2007,21(2):49-52.
[17]彭正萍,门明新,薛世川,等.腐植酸复合肥对土壤养分转化和土壤酶活性的影响[J].河北农业大学学报,2005,28(4):1-4.Peng Z P,Men M X,Xue S C et al.Effects of humic acid(HA)compound fertilizer on the conversion of soil nutrient and activities of soil enzyme[J].J.Hebei Agric.Univ.,2005,28(4):1-4.
[18]邱业先,彭仁,陈文荣,等.红壤稻田脲酶消长规律研究[J].江西农业大学学报,1999,21(3):311-313.Qiu Y X,Peng R,Chen W R et al.A study on urease growth and decline law in red soil paddy fields[J].J.Jiangxi Agric.Univ.,1999,21(3):311-313.
[19]Term G L.Volatilization losses of nitrogen as ammonia from surface applied fertilizers,organic amendments and crop residues[J].Adv.Agron.,1979,31:189-223.
[20]和文祥,刘恩斌,朱铭莪.土壤脲酶活性与底物浓度定量关系研究[J].西北农业学报,2001,10(1):62-66.He W X,Liu E B,ZhuM E.The study on quantitative relationship between soil urease activity and substrate concentration[J].Acta Agric.Bor.-Occid.Sin.,2001,10(1):62-66.
[21]朱启红.木质素复混肥对土壤脲酶活性的影响[J].农机化研究,2007,(5):151-152.Zhu Q H.Effects of the lignin slow-release fertilizer on soil urease activity[J].J.Agric.Mech.Res.,2007,(5):151-152.
[22]SchlesingerW H,Hartley A E.A global budget for atmospheric NH3[J].Biogeochemistry,1992,15:199-211.
[23]苏成国,尹斌,朱兆良.稻田氮肥的氨挥发损失与稻季大气氮的湿沉降[J].应用生态学报,2003,14(11):1884-1888.Su C G,Yin B,Zhu Z L.Ammonia volatilization loss of nitrogen fertilizer from rice field and wet depositionof atmospheric nitrogenin rice growing season[J].Chin.J.Appl.Ecol.,2003,14(11):1884-1888.
[24]Williams E J,Hutchinson G L,Tehsenfeld F C.NOXand N2O emission from soil[J].Glob.Biogeochem.Cycl.,1992,6:351-388.
[25]关松荫.土壤酶及研究方法[M].北京:农业出版社,1986.294-297.Guan S Y.Soil enzyme and its research means[M].Beijing:Agricultural Press,1986.294-297.
[26]孙克君,毛小云,卢其明,等.几种控释氮肥减少氨挥发的效果及影响因素研究[J].应用生态学报,2004,15(12):2347-2350.Sun K J,Mao X Y,Lu Q M et al.Mitigation effect of several controlled-release N fertilizers on ammonia volatilization and related affecting factors[J].Chin.J.Appl.Ecol.,2004,15(12):2347-2350.
