外源NO对铜胁迫下番茄光合、生物发光特性及矿质元素吸收的影响
2010-11-21张义凯韩小娇金洪陈秀灵崔秀敏吴小宾徐艳如
张义凯,韩小娇,金洪,陈秀灵,崔秀敏*,吴小宾,徐艳如
(1山东农业大学资源与环境学院,山东泰安271018;2中国林业科学研究院,北京100091;3国际网络竹藤中心,北京100102)
铜(Cu)是植物生长发育的必需微量元素,参与植物的光合作用等许多过程,在植物的新陈代谢过程中起着重要的作用,但植物组织中过量的Cu会对植物产生毒害作用[1]。目前Cu矿的开采和冶炼厂三废的排放,含Cu农业化学物质(杀真菌剂,杀虫剂和化肥)和有机肥(高Cu猪粪,鸡粪和厩肥)的施用可使农田土壤,特别是温室土壤含Cu量达到一般农田土壤的几倍乃至几十倍[2-4];温室土壤重金属污染已变得日益严峻[5-6]。因此,研究重金属毒害的缓解机理已成为农业可持续发展中亟待解决的问题。
一氧化氮(nitric oxide,NO)是最近发现的生物体内的生长调节物质,同时也是一种活性极强的两性分子,具有毒害和保护细胞的双重功效;但NO的这种毒害或保护效应与细胞内生理环境和NO的有效生理浓度、作用部位及细胞内生理环境不同而异[7-8]。NO广泛存在于植物组织中,参与植物对各种非生物胁迫的调节。据报道,NO能缓解盐胁迫对黄瓜、水稻、小麦和玉米的伤害作用[9-12];能通过诱导气孔关闭[13]和增强根细胞质膜内向K+通道的活性[14]等提高小麦的抗旱性,能缓解Cd胁迫对玉米、水稻、向日葵的伤害[15-16];能缓解Fe、Cu胁迫对玉米、人参、水稻的伤害[17-19];此外还能促进Cu胁迫下小麦种子的萌发[20]。然而,目前关于NO对Cu胁迫下番茄光合作用和矿质元素的研究尚未见报道。为此,开展了NO对Cu胁迫下的番茄光合特性,超微弱发光(ultraweak luminescence,UWL)、荧光、磷光强度以及矿质营养元素吸收的影响研究,为缓解重金属毒害提供依据。
1 材料与方法
1.1 试验设计
试验在山东农业大学温室内进行。番茄品种为“玫瑰”(Lycopersicon esculentum Mill.cv.Meigui)。种子经55℃温汤浸种消毒15 min,然后在润湿的吸水纸上26℃催芽。待种子露白后,播于洗净的蛭石中,萌发后用1/4 Hoagland[21]营养液浇灌。当幼苗具有3~4片真叶时,挑选生长一致的植株洗净根部蛭石后,移栽于5 L塑料盆中,用厚度为3 cm的泡沫塑料板做成锲形盖子,覆盖在塑料盆顶部。每盆栽5株,用1/2 Hoagland营养液进行栽培。1周后换成完全营养液,此后每3 d更换一次营养液。营养液栽培期间用电动气泵24 h连续通气。当植株具有5~6片真叶时,对番茄幼苗进行处理。
NO供体硝普钠[Na2Fe(CN)5]NO,SNP,购自Sigma公司,先用蒸馏水配成200 mmol/L的母液,4℃避光保存,用时按所需浓度稀释。血红蛋白(Hb,Sigma公司生产,上海生工分装)为NO的清除剂;其他试剂均为国产分析纯。由于SNP分解的产物除NO外,还有NO2-/NO2-和Fe(CN)25-等阴离子[13],在试验中加入一定浓度的NaNO2/NaNO3和Na3Fe(CN)6(后者也是SNP的相似物,但不能产生NO)作为相关对照,二者在本试验条件下均不能产生NO。
试验设6个处理:1)CK,Hoagland完全营养液为对照 ;2)50 μ mol/L CuCl2;3)50 μ mol/L CuCl2+100 μ mol/L SNP;4)50 μ mol/L CuCl2+100 μ mol/L NaNO2+100 μ mol/L NaNO3(其中 NaNO2+NaNO3以NOx-代替 ,下同);5)50 μ mol/L CuCl2+100 μ mol/L Na3Fe(CN)6;6)50 μ mol/L CuCl2+100 μ mol/L SNP+0.1%Hb,分别用 CK 、Cu 、Cu+S 、Cu+N 、Cu+F 、Cu+S+H表示,3次重复,在温室内随机排列。处理期间每天更换营养液,用低浓度KOH或HCl调节至pH 5±0.2。温室内光照约12 h,白天最高温度32℃,夜间最低温度15℃。处理8 d后,取相同节位的叶片用于分析测定。
1.2 测定项目与方法
叶绿素含量的测定:取植株中上部功能叶片,用直径为1cm的打孔器采取叶圆片,加80%的丙酮和少许MgCO3,低温避光条件下匀浆,离心,采用Arnon的方法测定叶绿素含量[22]。
光合参数的测定:净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)用英国PP-systems公司生产的CIRAS-1便携式光合系统测定,测定光强为 800 μ mol/(m2·s)。
超微弱发光强度的测定:参照张新华等[23]的方法。取叶片鲜重 0.5 g左右,白炽灯[光强 10 μ mol/(m2·s)]照射5 min后立即放入测量杯中测量超微弱发光。超微弱发光仪(BPCL)由中国科学院生物物理研究所研制。测量参数为:调节高压为800 V,标准光源发光强度7000 counts/s,本底强度5 counts/s,采样时间200 s,采样间隔时间1 s。样品测定在暗室及恒温(20±1)℃、恒湿(RH 75%±2%)条件下进行。
叶片荧光强度的测定:测定仪器为日立F-4500荧光仪,激发光EX波长440 nm,发射光EM波长 500~ 700 nm,缝宽 EX/EM 为 10.0 nm/5.0 nm,扫描速度12000 nm/min,扫描间隔EX/EM为10.0 nm/5.0 nm[24]。
叶片磷光强度的测定:仪器为日立F-4500荧光仪,EX波长210 nm,EM 波长400~500 nm,缝宽EX/EM 10.0 nm/5.0 nm,扫描速度240 nm/min,扫描间隔EX/EM 10.0 nm/5.0 nm[24]。
矿质元素的测定:样品在105℃下杀青30 min,并在65~70℃下烘干至恒重,样品磨碎过筛,HNO3-HClO4法消煮后,采用FP640型火焰分光光度计测定K,AA370MC型原子吸收分光光度法测定Ca、Fe、Cu 、Zn、Mn等矿质元素的含量[25]。
SAS统计软件对平均数用Duncan’s新复极差法进行多重比较。
2 结果与分析
2.1 外源NO对铜胁迫下番茄叶片叶绿素含量的影响
表1看出,50 μ mol/L的Cu处理(Cu)显著降低番茄叶片的叶绿素a、叶绿素b和叶绿素a+b的含量,降低叶绿素a/b比值,而外施100 μ mol/L的SNP处理(Cu+S)能显著缓解Cu胁迫下对番茄叶片叶绿素a、叶绿素b和叶绿素a+b的抑制,提高叶绿素a/b比值;在添加NO清除剂血红蛋白处理(Cu+S+H)后,SNP的缓解效果被消除。在Cu处理液中加入 100 μ mol/L NO-x(Cu+N)或 100 μ mol/L 亚铁氰化钠(Cu+F),与Cu胁迫处理差异不显著。
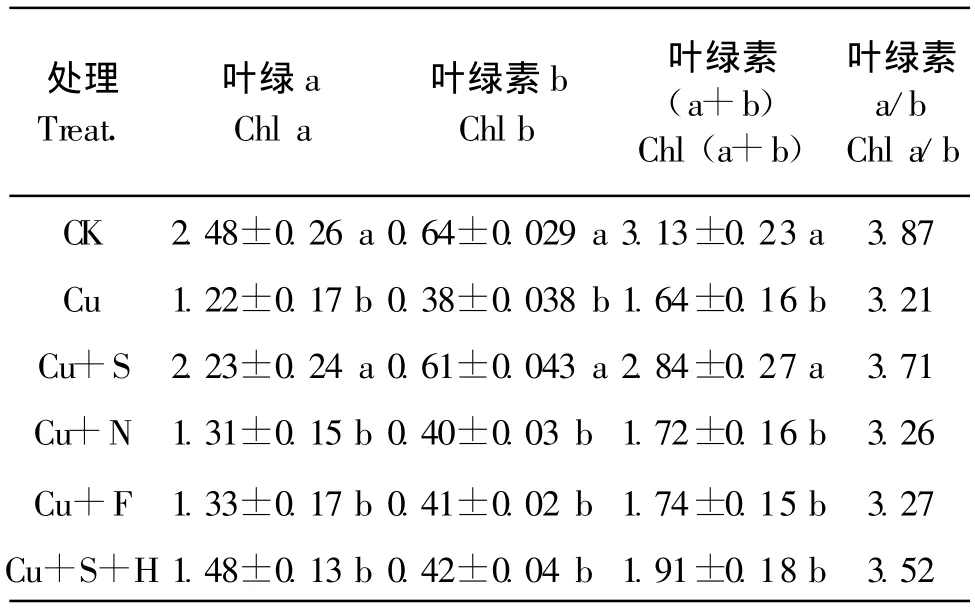
表1 外源NO对铜胁迫下番茄叶片叶绿素含量的影响Table 1 Effects of exogenous nitric oxide on the chlorophyll contents in leaves of tomato under Cu stress(mg/kg,FW)
2.2 外源NO对铜胁迫下番茄叶片光合参数的影响
由图1看出,与CK 处理相比,50 μ mol/L的Cu处理8 d番茄叶片的Pn,Tr和Gs显著降低,番茄叶片Ci显著上升,而外施100 μ mol/L的SNP处理(Cu+S)能显著提高Cu胁迫下番茄叶片的Pn、Tr和Gs,降低番茄叶片Ci;用NO清除剂血红蛋白处理(Cu+S+H)后,显著消除SNP的缓解效果,而Tr未达到显著水平。在50 μ mol/L的Cu处理培养液中加入100μ mol/L NO-x(Cu+N)或 100 μ mol/L 亚铁氰化钠(Cu+F),与Cu处理相比,对番茄叶片光合参数影响差异不显著。

图1 外源NO对铜胁迫下番茄叶片净光合速率Pn、蒸腾速率 Tr、气孔导度 Gs和胞间 CO2浓度 Ci的影响Fig.1 Effects of exogenous nitric oxide on the net photosynthetic rate(Pn),transpiration rate(Tr),stomatal conductance(Gs)and intercellular CO2concentration(Ci)in leaves of tomato under Cu stress
2.3 外源NO对铜胁迫下番茄叶片生物发光强度的影响
50 μ mol/L的Cu胁迫处理显著提高番茄叶片UWL强度、荧光发光强度和磷光发光强度,外施100μ mol/L SNP处理(Cu+S)显著降低UWL、荧光和磷光的发光强度,然而,添加NO清除剂处理(Cu+S+H)可以显著消除SNP的效果。在Cu处理液中加入 100 μ mol/L NO-x(Cu+N)或100μ mol/L 亚铁氰化钠(Cu+F),与Cu处理相比,对番茄叶片UWL、荧光强度的影响差异不显著,磷光强度显著增加(图2)。
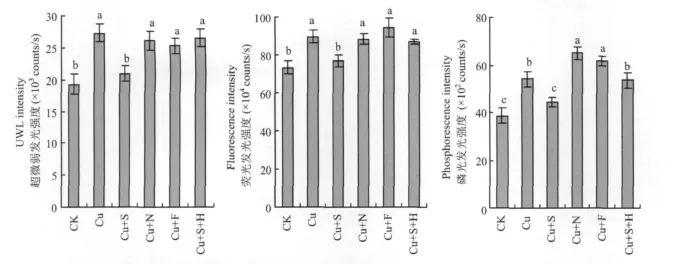
图2 外源NO对铜胁迫下番茄叶片超微弱发光强度、荧光强度和磷光强度的影响Fig.2 Effects of exogenous nitric oxide on ultraweak luminescence intensity,fluorescence intensity,phosphorescence intensity in leaves of tomato under copper stress
2.4 外源NO对铜胁迫下番茄植株矿质营养元素含量的影响
与CK相比,50 μ mol/L的Cu显著增加番茄叶片、根系中的Cu含量,显著降低番茄叶片中Ca、Fe、Zn、Mn和根系中K 、Fe、Zn 的含量 ,然而显著增加根系中Ca的含量,对叶片中K含量和根系中Mn含量影响不显著。与Cu胁迫处理相比,施加SNP处理(Cu+S)略微降低叶片、根系中Cu的含量,但未达到显著水平;SNP显著提高叶片中Ca、Fe、Zn、Mn以及根系中K、Fe、Zn的含量,并且显著降低根系中Ca、Mn的含量;在添加NO清除剂血红蛋白处理(Cu+S+H)后,SNP的效果被消除。在Cu处理液中加入 100 μ mol/L NO-x(Cu+N)或 100 μ mol/L 亚铁氰化钠(Cu+F),与Cu胁迫处理相比,对番茄叶片中K、Ca、Fe、Cu、Zn 、Mn 含量影响不显著,对番茄根系中K、Ca含量影响差异不显著;而Cu+N处理显著降低番茄根系中Fe、Cu、Zn、Mn含量,Cu+F处理显著增加根系中Fe含量,降低Cu、Mn含量(表2)。
3 讨论
叶绿素含量是反映光合强度的重要指标。植物受到重金属胁迫时,各种生理过程都会受到影响,直接或间接地影响到叶绿素的含量。Cu胁迫下,番茄叶片叶绿素含量显著下降。施加SNP显著增加番茄叶片叶绿素a、叶绿素 b、叶绿素a+b的含量,提高叶绿素a/b比值(表1);而添加血红蛋白后,SNP的效果被显著消除,施用NO-x和Na3Fe(CN)6,均不能减轻Cu胁迫对叶绿素含量的影响。SNP是NO的供体,而NO-x是NO的分解产物,Na3Fe(CN)6是SNP的相似物或分解产物,两者均不能产生NO,血红蛋白是NO的清除剂。因此,可以得出SNP释放出NO,提高番茄叶片叶绿素含量,维持Cu胁迫下番茄较高的光合速率。
光合作用的强弱对于植物生长、产量及其抗逆性都具有十分重要的影响,常作为判断植物生长和抗逆性大小的指标。Cu胁迫下,引起植物叶片光合速率降低的植物自身因素主要有两类,一是受气孔导度影响的气孔限制;二是受叶肉细胞光合活性的下降影响的非气孔限制。Farquhar和Sharkey[26]认为,Ci值的大小是评判气孔限制和非气孔限制的依据。Pn、Gs和Ci值同时下降时,Pn的下降为气孔限制;相反,如果叶片Pn的降低伴随着Ci值的提高,说明光合作用的限制因素是非气孔限制。本试验结果表明,Cu胁迫处理8 d后,番茄叶片的Pn、Gs下降,Ci升高(图1),说明此时非气孔限制成为主要因素;而外施NO能显著减轻Cu胁迫下番茄叶片Pn、Tr和Gs的下降幅度,从而抑制了番茄叶肉细胞光合活性下降,提高光合速率。

表2 外源NO对Cu胁迫下番茄植株矿质营养元素含量的影响(mg/kg,DW)Table 2 Effects of exogenous nitric oxide on mineral contents in tomato under Cu stress
植物UWL与植物体的氧化代谢、信息传递、光合作用、细胞分裂、死亡及生长调控等基本生命过程存在着内在联系,也与植物的抗逆性密切相关[27]。当植物受到外界不良环境刺激时,活性氧在体内积累,其中羟自由基与细胞膜上多聚不饱和脂肪酸通过脂质过氧化连锁反应,形成单线态氧,处于激发态的单线态氧退激回到基态时向外发射光子,形成UWL[28]。本试验条件下,Cu胁迫显著增加番茄叶片UWL强度(图2),这与活性氧机制[29]相符合。外施NO显著降低叶片UWL强度,表明NO能增强番茄体内活性氧清除机制,保护质膜免受重金属伤害,维持膜结构完整性。Cu胁迫下,番茄的光合作用受到显著抑制,过多的光能以荧光的形式或热能耗散,以保护光合作用机构免于强光破坏。本研究表明,过量的Cu能显著提高番茄叶片的荧光强度,表明非化学能量耗散加强,叶片光能利用率降低。Cu胁迫使光合电子传递过程受到抑制[30],光合机构受到损害,不利于番茄叶片把所捕获的光能转变为化学能。而外施NO能显著降低叶片的荧光强度,缓解Cu毒害对光合机构的破坏。磷光是一些处于第一电子激发三重态的有机分子发生辐射跃迁而下降到基态的各振动能级时产生的。通常情况下,组成蛋白质的氨基酸可以产生磷光发射[31]。在不良环境下植物叶片内的蛋白质受到胁迫的“刺激”,体内的氨基酸分子会发生大量的能级跃迁,导致植物叶片磷光强度增加[32]。在Cu胁迫处理8 d后,番茄叶片磷光强度增加,而外施NO能显著降低叶片磷光强度,表明NO能减轻重金属Cu对番茄叶片蛋白质的毒害。由此可以推断,NO有可能通过降低重金属对叶绿体中蛋白质的影响,减少叶绿素的分解,保护叶绿体结构和功能,从而提高重金属胁迫下的光合速率。
重金属Cu对植物的伤害是多方面的。作为植物必需营养元素,过量的Cu吸收会打破养分平衡,抑制营养元素的吸收和运转。Alva等[33]和黎耿碧等[34]报道,过量的Cu明显抑制柑橘对N、P、K、Ca、Mg、Fe、Zn、Mn等必需矿质元素的吸收;Alaoui-Sossé等[35]认为,Cu胁迫显著减少菠菜叶片中K、Mg、Ca、Fe、Na的含量。本试验表明,外源NO可显著提高根系中K、Zn、Fe 的含量以及叶片中Ca、Zn、Fe、Mn 的含量,降低根系中Ca、Mn的含量。然而,NO不能显著抑制Cu的吸收(表2),表明外源NO可能通过某种机制提高番茄对K、Ca、Fe、Zn、Mn的选择性吸收,维持胞质离子稳态,从而缓解Cu的毒害。植物受到Cu毒害时经常伴随失绿症的出现,而失绿症很可能是由于缺Fe引起。Alva等[33]报道,过量的Cu显著抑制柑橘对Fe的吸收;Lidon等[36]也报道,过量Cu会抑制水稻对Ca、Fe、Mn等的吸收。Dokiya等[37]在溶液培养中证实,Fe含量增加能够抑制水稻幼苗对Cu的吸收。Chen等[38]报道,Fe缺乏时能显著增加鸭跖草中Cu的含量。说明Cu和Fe在一定浓度范围内存在拮抗作用。Graziano等[39]发现,NO对植物叶片中Fe向叶绿体的分配具有重要的作用。本试验结果表明,外施NO能显著增加番茄叶片和根系中Fe、Zn等的含量。由此推断,外源NO提高叶绿素含量的原因可能是通过提高对Fe、Zn等的吸收和运输,增加向叶绿体的分配,进而提高叶片叶绿素的含量和保护叶绿体结构的完整性,维持番茄较高的光合速率。
[1]Marschner H.Mineral nutrition of higher plants(2nd)[M].London:Academic Press,1995.333-347.
[2]Kaplan M.Accumulation of Cu in soils and leaves of tomato plants in greenhouses in Turkey[J].J.Plant Nutr.,1999,22:237-244.
[3]Brun L A,Maillet J,Hinsinger P et al.Evaluation of copper availability to plants in copper-contaminated vineyard soils[J].Environ.Pollut.,2001,111:293-302.
[4]卢东,宗良纲,肖兴基,等.华东典型地区有机与常规农业土壤重金属含量的比较研究[J].农业环境科学学报,2005,24(1):143-147.Lu D,Zong L G,Xiao X J et al.A comparison of heavy metals concentration in soils of organic and conventional farming in typical regions of eastern China[J].J.Agric.Environ.Sci.,2005,24(1):143-147.
[5]黄治平,徐斌,张克强,杨秀春.连续四年施用规模化猪场猪粪温室土壤重金属积累研究[J].农业工程学报,2007,23(11):239-243.Huang Z P,Xu B,Zhang K Q,Yang X C.Accumulation of heavy metals in the four years’continual swine manure-applied greenhouse soils[J].Trans.Chin.Soc.Agri.Eng.,2007,23(11):239-243.
[6]曾希柏,李莲芳,白玲玉,等.山东寿光农业利用方式对土壤砷累积的影响[J].应用生态学报,2007,18(2):310-316.Zeng X B,Li L F,Bai L Y et al.Arsenic accumulation in different agricultural soils in Shouguang of Shandong province[J].Chin.J.Appl.Ecol.,2007,18(2):310-316.
[7]Beligni M V,Lamattina L.Is nitric oxide toxic or protective?[J]Trends Plant Sci.,1999,4:299-300.
[8]Beligni M V,Lamattina L.Nitric oxide counteracts cytotoxic processes mediated by reactive oxygen species in plant tissues[J].Planta,1999,208:337-344.
[9]Shi Q H,Ding F,Wang X F,Wei M.Exogenous nitric oxide protect cucumber roots against oxidative stress induced by salt stress[J].Plant Physiol.Biochem.,2007,45:542-550.
[10]阮海华,沈文飙,叶茂炳,徐朗莱.一氧化氮对盐胁迫下小麦叶片氧化损伤的保护效应[J].科学通报,2001,46(23):1993-1997.Ruan H H,Shen W B,Ye M B,Xu L L.Protection of nitric oxide on salt induced membrane oxidation inwheat leaves[J].Bull.Sci.,2001,46(23):1993-1997.
[11]张艳艳,刘俊,刘友良.一氧化氮缓解盐胁迫对玉米生长的抑制作用[J].植物生理与分子生物学学报,2004,30(4):455-459.Zhang Y Y,Liu J,Liu Y L.Nitric oxide alleviates growth inhibition of maize seedlings underNaCl stress[J].J.Plant Physiol.Mol.Biol.,2004,30(4):455-459.
[12]Uchida A,Jagendorf A T,Hibino T et al.Effectsof hydrogen peroxide and nitric oxide on both salt and heat stress tolerance in rice[J].Plant Sci.,2002,163:515-523.
[13]Mata C G,Lamattina L.Nitric oxide induces stomatal closure andenhances the adaptive plant responses against drought stress[J].Plant Physiol.,2001,126(3):1196-1204.
[14]闻玉,赵翔,张骁.水分胁迫下一氧化氮对小麦幼苗根系生长和吸收的影响[J].作物学报,2008,34(2):344-348.Wen Y,Zhao X,Zhang X.Effects of nitric oxide on root growth and absorption in wheat seedlings in response to waterstress[J].Acta A-gron.Sin.,2008,34(2):344-348.
[15]Hsu Y T,Kao C H.Cadmium toxicity is reduced by nitric oxide in rice leaves[J].Plant Growth Regul.,2004,42:227-238.
[16]Laspina N V,Groppa M D,Tomaro M L,Benavides M P.Nitric oxide protects sunflower leaves against Cd-induced oxidative stress[J].Plant Sci.,2005,169:323-330.
[17]敬岩,孙宝腾,符建荣.一氧化氮改善铁胁迫玉米光合组织结构及其活性[J].植物营养与肥料学报,2007,13(5):809-815.Jing Y,Sun B T,Fu J R.Nitric oxide improves photosynthetic structure and activity in iron-deficient maize[J].Plant Nutri.Fert.Sci.,2007,13(5):809-815.
[18]Yu C C,Hung K T,Kao C H.Nitric oxide reduces Cu toxicity and Cu-induced NH4+accumulation in rice leaves[J].J.Plant Physiol.,2005,162:319-330.
[19]Tewari R K,Hahn E J,Paek K Y.Modulation of copper toxicity-induced oxidative damage by nitric oxide supply in the adventitious roots of Panax ginseng[J].Plant Cell Rep.,2008,27:171-181.
[20]Hu K D,Hu L Y,Li Y H et al.Protective roles of nitric oxide on germination and antioxidant metabolism in wheat seeds under copper stress[J].Plant Growth Regul.,2007,53:173-183.
[21]Hoagland D R,Arnon D I.The water-culture method for growing plants without soil[J].Calif.Expt.Sta.Circ.,1950,347:1-39.
[22]Arnon D I.Copper enzymes in isolated chloroplasts,polyphenol oxidase in Brta vulgaris[J].Plant Physiol.,1949,24:1-15.
[23]张新华,杨洪强,李富军,张伟.杏花开放过程中超弱发光和ATP及活性氧含量的变化[J].植物生理与分子生物学报,2004,30(1):41-44.Zhang X H,Yang H Q,Li F J,Zhang W.Changes in ultraweak luminescence,ATP and active oxygen contents during apricot florescence[J].J.Plant Physiol.Mol.Biol.,2004,30(1):41-44.
[24]杨一心,赵天成,白晋涛,等.丙氨酸咪唑钐的三维荧光激发和发射光谱[J].光子学报,2002,31(9):1165-1168.Yang Y X,Zhao T C,Bai J T et al.Three-dimension fluorescence excitation and emission spectrum of alanine imidazole Sm compound[J].Acta Photon.Sin.,2002,31(9):1165-1168.
[25]中国土壤学会.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000.315-336.Soil Science Society of China.Analyses method of soil and agricultural chemistry[M].Beijing:China Agricultural Science andTechnology Press,2000.315-336.
[26]Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Ann.Rev.Plant Physiol.,1982,33:317-3451.
[27]王维江,韩俊英.生物超弱发光机制及其检测方法研究进展[J].广东工业大学学报,2000,17(1):49-54.Wang W J,Han J Y.Advance in the study of ultra-weak bioluminescent mechanisms and detecting methods[J].J.Guangdong Univ.Tech.,2000,17(1):49-54.
[28]Foyer C H,Lopez-Delgado H,Dat J F,Scott I M.Hydrogen peroxide-and glutathione-associated mechanisms of acclimatory stress tolerance and signalling[J].Physiol.Plant,1997,100:241-254.
[29]Boveris A,Cadenas E,Chance B.Ultraweak chemiluminescence:a sensitive assay for oxidative radical reactions[J].Fed.Proc.,1981,40:125-128.
[30]Maksymiec W,Wójcik M,Krupa Z.Variation in oxidative stress and photochemical activity in Arabidopsis thaliana leaves subjected to cadmium and excess copper in the presence or absence of jasmonate and ascorbate[J].Chemosphere,2007,66:421-427.
[31]魏玉霞,董川.磷光分析法在生命科学中的应用新进展[J].生命的化学,2003,23(4):320-322.Wei Y X,Dong C.Applicationprogress of phosphorimetry analysis in life science[J].Chem.Life,2003,23(4):320-322.
[32]国颖,杨洪强.高温对平邑甜茶幼苗生物发光与能量代谢的影响[J].园艺学报,2008,35(1):99-102.Guo Y,Yang H Q.Effects of high temperature on bioluminescence and energy metabolism of Malus hupehensis(Pamp)Rehd.var.pingyiensis Jiang[J].Acta Hort.Sin.,2008,35(1):99-102.
[33]Alva A K,Chen E Q.Effects of external copper concentrations on uptake of trace elements by citrus seedlings[J].Soil Sci.,1995,159:59-64.
[34]黎耿碧,陈二钦,Alva A K.外界铜离子浓度对柑桔小苗常量元素吸收特性的影响[J].广西农业大学学报,1996,15(3):195-201.Li G B,Chen E Q,Alva A K.Effects of external copper concentrations on uptake of routine elements by citrus seedling[J].J.Guangxi Agric.Biol.Sci.,1996,15(3):195-201.
[35]Alaoui-Sossé B,Genet P,Vinit-Dunand F et al.Effect of copperon growth in cucumber plants(Cucumis sativus)and its relationships with carbohydrate accumulation and changes in ion contents[J].Plant Sci.,2004,166:1213-1218.
[36]Lidon F C,Henriques F S.Copper toxicity in rice:diagnostic criteria and effect on tissue Mn and Fe[J].Soil Sci.,1992,54:130-135.
[37]Dokiya Y,Owa N,Mitsui S.Comparative physiological study of iron,manganese and copper adsorption by plantsⅢ.Interaction between Fe,Mn and Cu onthe absorptionof elementsby rice and barley seedlings[J].Soil Sci.Plant Nutr.,1968,14:169-174.
[38]Chen Y,Shi J,Tian G et al.Fe deficiency induces Cu uptake and accumulation in Commelina communis[J].Plant Sci.,2004,166:1371-1377.
[39]Graziano M,Beligni M V,Lamattina L.Nitric oxide improves internal iron availability in plants[J].Plant Physiol.,2002,130:1852-1859.
