伤寒沙门菌诱导巨噬细胞凋亡机制的探讨*
2010-11-20刘婷婷马丽娜李凤云
刘婷婷,马丽娜,李凤云,刘 勇,樊 蓉
伤寒沙门菌(Salmonella typhi,S.typhi)是重要的肠道致病菌,属胞内寄生菌,它可引起伤寒等严重疾病。巨噬细胞是人体主要的吞噬细胞,它在许多病原体的清除和破坏中起重要作用。伤寒沙门菌在巨噬细胞内生存、增殖的能力与其致病密切相关。越来越多的研究报道伤寒沙门菌可以引起吞噬细胞的凋亡〔1〕,但伤寒沙门菌诱导巨噬细胞凋亡机制还有待进一步研究,本实验拟采用人白血病细胞系
THP-1细胞经PMA(佛波醇酯)分化的巨噬细胞为模型,探讨伤寒沙门菌对巨噬细胞凋亡的机制,以深入了解伤寒沙门菌的致病机制。
1 材料与方法
1.1 菌种 伤寒沙门菌标准菌株,购自生物制品鉴定所。
1.2 主要试剂与仪器 Annexin FITC凋亡检测试剂盒(深圳晶美生物工程公司)caspase3/8/9比色法检测试剂盒(Biovision公司),caspase3/8/9抑制剂(Biovision公司),抗人 TNF-α抗体(Peprotechinc公司)及人TNF-α定量酶联检测试剂盒(上海森雄生物技术有限公司),NO检测试剂盒(南京建成生物工程研究所),流式细胞仪FACSCalibur(美国BD公司)。
1.3 细胞培养 用含小牛血清的RPMI-1640培养液培养THP1细胞,加入20 ng/mL PMA使其分化,37。C ,5%CO2条件下培养48h,镜下观察90%以上细胞出现棘状突起,认为细胞已分化成巨噬细胞,收获指数生长期巨噬细胞,以5×105接种于无菌六孔板中,常规培养5h后更换成不含小牛血清的营养液进行试验。
1.4 细菌培养 细菌在LB液体培养基培养,16h后使用酶标仪OD 600检测菌液浓度,用不含小牛血清1640调整菌液浓度。
1.5 实验方法
1.5.1 细胞感染 弃去细胞培养孔中陈旧培养液,加入1.0 mL不含小牛血清营养液,按细菌与细胞数之比为20∶1加入细菌,实验分组如下:A组:伤寒沙门菌诱导组;B组:空白对照组。
1.5.2 细胞凋亡检测 2组于诱导因素加入后8h分别收集细胞,Annexin V-FITC染色,1h内流式细胞仪检测,Cellquest软件获取数据,WinMDI2.9软件分析数据。
1.5.3 凋亡抑制效应检测 在培养的细胞中加入终浓度分别为 20μg/mL TNF-α抗体、2μmol/mL caspase3/8/9抑制剂,各组诱导因素作用8h后收集细胞,Annexin V-FITC染色、流式细胞仪检测细胞凋亡。
1.5.4 caspase3/8/9、TNF-α、NO 的检测:各组于诱导因素加入 8h后,获得上清后采用定量酶联法检测 TNF-α,按照说明书进行操作,酶标仪测量492nm处光密度OD值,根据标准曲线得到TNF-α含量。Caspase3/8/9检测采用比色法,收集作用8h后的细胞,按照说明书操作,酶标仪检测405 nm时的OD值。NO的检测采用硝酸还原酶法,检测步骤按说明书进行。测定550 nm吸光度值,根据公式计算NO浓度值。
1.6 数据处理 所得数据用SPSS10.0进行计算和分析。采用one-way ANOVA后t检验。
2 结 果
2.1 分别加入caspase3,caspase8,caspase9抑制剂及TNF-α抗体后伤寒沙门菌诱导巨噬细胞凋亡的流式分析图。
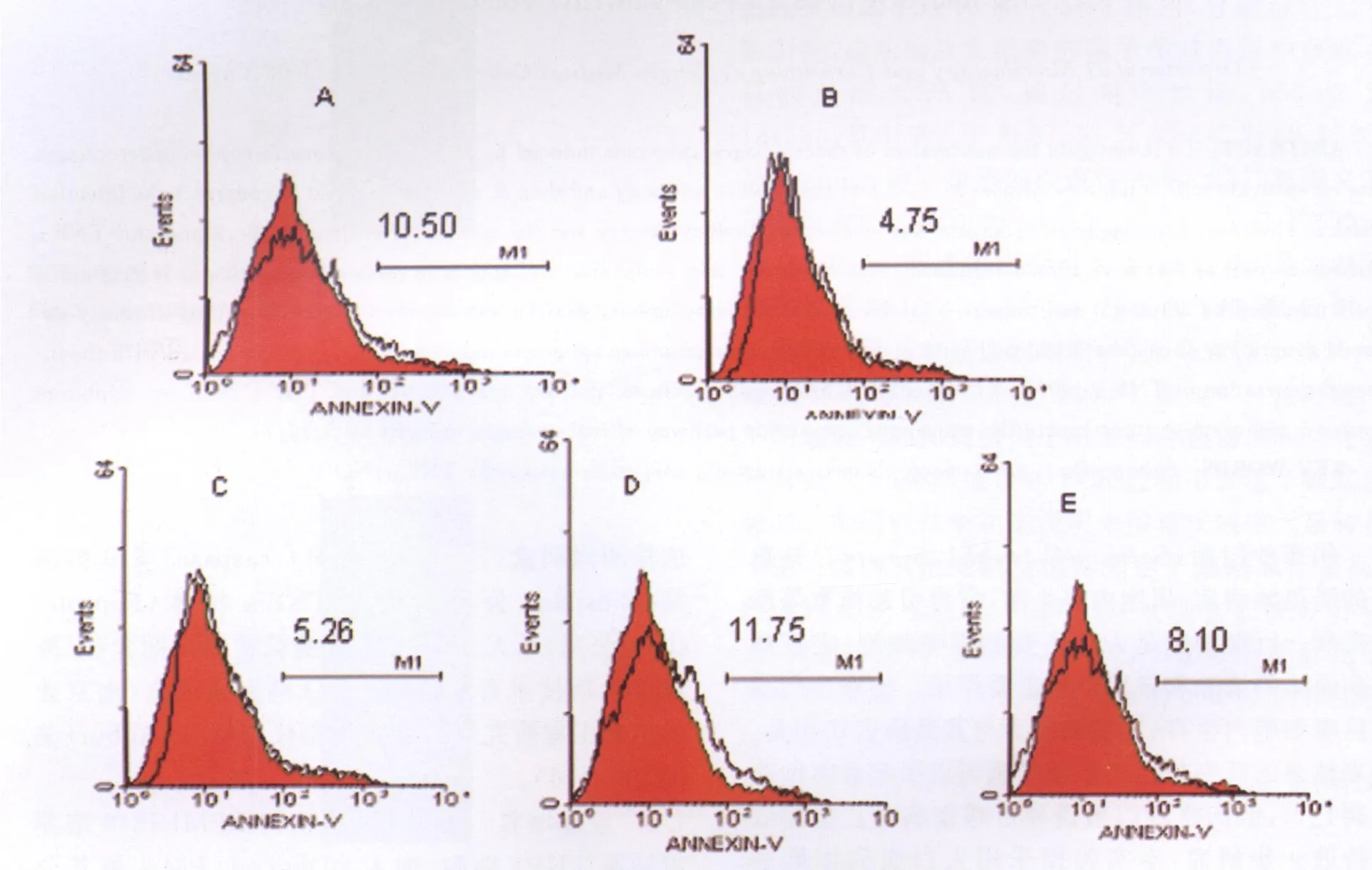
图1 加入caspase3/8/9抑制剂及抗TNF-α后伤寒沙门菌诱导巨噬细胞8h凋亡的AnnexinV-FITC流式分析图Fig.1 Analysis of Annexin V-FITC in macrophage apoptosis induced by S.typh i after theinhibitor of caspase3/8/9 and theanti-TNF-αThe marker M1 shows the percentage of Annexin positivecells.The black of the figure is the control.
2.2 比色法检测细胞中caspase3,caspase8,caspase9含量,伤寒沙门菌诱导巨噬细胞8 h收集细胞,使用细胞裂解液裂解,释放细胞内caspase3,caspase8,caspase9,分别加入相应荧光底物,酶标仪读取OD值,结果caspase3,caspase8均较对照升高(图 2)。
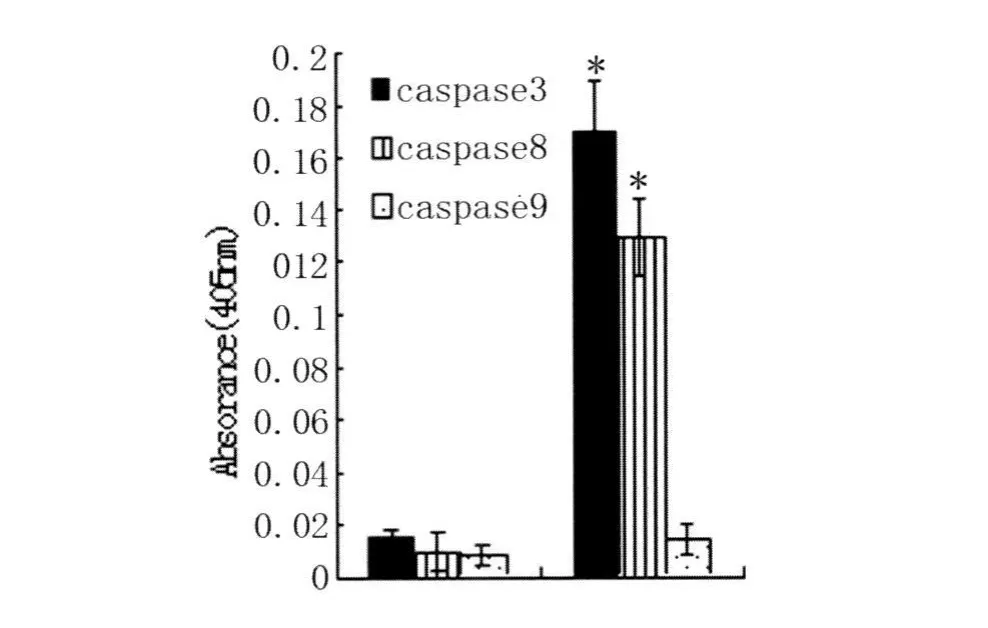
图2 伤寒沙门菌原菌诱导巨噬细胞8 h caspase3,caspase8,caspase9产生量(ni=6,±s)与对照组组比较:*P<0.01;Fig.2 Caspase3,caspase8,caspase9 activity of macrophages infected with Salmonella typhi after 8h incubation compared to control:*P<0.01
2.3 检测细胞培养液中TNF-α,NO含量,伤寒沙门菌诱导巨噬细胞8 h收集细胞培养液,采用硝酸还原酶法检测NO含量,ELISA检测TNF-α含量,结果均较对照组显著增高。(见图3,4)

图3 伤寒沙门菌诱导巨噬细胞8h NO产生量(ni=6, ±s)与对照组比较:*P<0.01;Fig.3 NO(μmol/l)in the culture supernatants of macrophages infected with Salmonella typhi after 8 hours compared to control:*P<0.01
3 讨 论
伤寒沙门菌感染致病的重要机制之一是在细胞内寄生,甚至繁殖。单核吞噬细胞是引发免疫应答的主要细胞,在免疫调节和维持机体内环境稳定方面具有重要的作用,它能吞噬和杀灭侵入的微生物,传递抗原,调节T细胞应答。巨噬细胞的分化、生存对免疫应答的深度至关重要〔1〕。越来越多的研究报道伤寒沙门菌可以引起吞噬细胞的凋亡,从而逃脱机体免疫系统的识别〔1-3〕,导致细菌在机体造成持续感染。
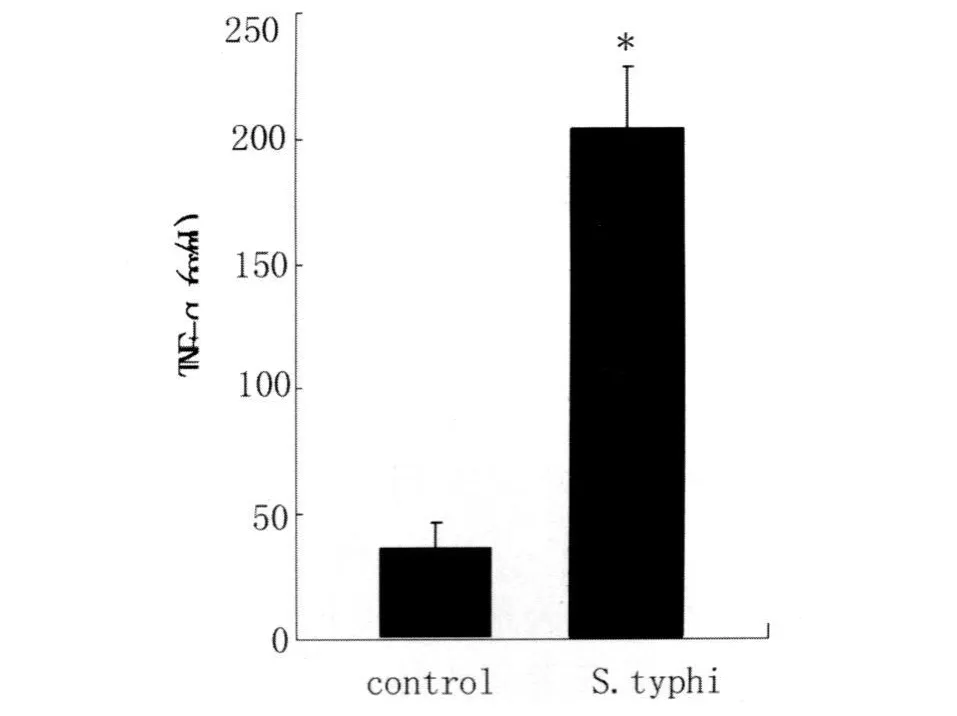
图4 伤寒沙门菌诱导巨噬细胞8h TNF-α产生量(ni=6,±s)与对照组比较:*P<0.01;Fig.4 TNF-α(pg/mL)in the culture supernatants of macrophages infected with Salmonella typhi after 8 hours compared to control:*P<0.01
本实验将伤寒沙门菌与巨噬细胞共培养,采用Annexin V-FITC染色、流式细胞仪检测细胞凋亡情况。结果发现伤寒沙门菌可以诱导巨噬细胞凋亡,且细胞凋亡可被caspase3和caspase8抑制剂及TNF-α抗体不同程度的抑制(P<0.01),细菌感染组作用 8h后caspase3,caspase8及 TNF-α和NO含量均较对照组升高(P<0.01),说明这些因子都参与伤寒沙门菌诱导巨噬细胞凋亡,caspase9抑制剂未能抑制伤寒沙门菌诱导的细胞凋亡,这与检测caspase9含量未见升高结果一致,说明caspase9未能参与伤寒沙门菌诱导的巨噬细胞凋亡。
经典的细胞凋亡途径有两条,分别为细胞外途径(细胞表面受体死亡途径)和细胞内途径(线粒体引发途径)。在细胞外途径中,死亡信号的传导依赖于死亡配体与受体的接合(如TNF-α与TNFR的结合),进一步激活caspase-8,使线粒体释放细胞色素C或直接作用于caspase-3及其它下游的caspase。在细胞内途径中,细胞内的死亡信号如DNA损伤、毒素和ATP耗竭等均可诱发线粒体释放细胞色素C,进一步顺序激活caspase-9、caspase-3、7等而诱发细胞凋亡〔4-5〕。
在革兰阴性菌内毒素脂多糖诱导巨噬细胞凋亡中,NO发挥重要作用。有报道细菌内毒素可引起小鼠灌洗液中NO2-/NO3-浓度显著增加,用一氧化氮合成酶抑制剂能阻断上述反应,提示NO的合成增加在巨噬细胞的凋亡中起到重要作用〔6〕。本实验研究发现伤寒沙门菌诱导巨噬细胞产生的NO浓度维持在较高水平,明显高于对照组,有研究表明NO可以增加caspase3的活性〔7〕,活化的 caspase3可以水解caspase活化酶抑制剂,从而使caspase激活的DNA酶裂解DNA〔8〕,这与本实验中caspase3活性增加导致细胞凋亡,加入caspase3抑制剂后凋亡有所下降的结果相一致。有报道TNF-α可引起不同类型细胞的凋亡〔9〕。Schuerwegh的研究发现在TNF-α诱导的牛软骨细胞凋亡中 NO起重要作用〔10〕。在细胞凋亡中,TNF-α同 caspase3的关系同NO和caspase3的关系一样得到证实〔11〕。Gup ta和Gollapudi发现在老年人体内的 T细胞凋亡增加与 caspase3及 TNF-α表达有关,在 TNF与TNF-α结合诱导免疫应答细胞凋亡时需要caspase3的活化〔12〕。本实验中,TNF-α介导的凋亡同伤寒沙门菌感染相关,采用抗人TNF-α抗体阻断TNF-α后细胞凋亡率明显下降,这与kim报道的结果相一致〔13〕。
总之,伤寒沙门菌可以诱导巨噬细胞凋亡,其凋亡机制可能是通过 TNF-α与其受体结合后激活NO和caspase3,caspase8介导的细胞外凋亡途径,本研究结果有助于我们更好的理解伤寒沙门菌的致病机理,为我们进一步的诊断与治疗提供了新的思路。
〔1〕 Monack DM,Mecsas J,Ahorin & Falkow S.Yersinia signals macrophage to undergo apoptosis and yop J is necessary for this cell death〔J〕.Proc Natl Acad Sci USA,1997,94(10):10385-10390.
〔2〕Van der,velder AWM,Lindgren SW,et al.Salmonella pathogenicity island in independent induction of apoptosis in infected macrophages by Salmonella enter ica serovar typ himurium〔J〕.Infect Imun,2000,68(12):5702-5709.
〔3〕Chin AC,Flynn A N,Fedwick JP,et al.The roleof caspase-3 in lipopolysaccharide-mediated disruption of intestinal epithelial tight junctions〔J〕.Can J 19ysiol Pharmacol,2006,84(10):1043-1050.
〔4〕Zhang X,Vallabhaneni R,Loughran PA,et al.Changes in FADD levels,distribution,and phosphorylation in TNFalphainduced apoptosis in hepatocytesis caspase-3,caspase-8 and BID dependent〔J〕 .Apoptosis,2008,13(8):983-992.
〔5〕Fischer U,Jänicke RU,Schulze-Osthoff K.Many cuts to ruin:a comprehensive update of caspase substratesn〔J〕.Cell Death Differ,2003,10(1):76-100.
〔6〕李良菊,王胜军.金黄色葡萄球菌及大肠埃希菌对小鼠产生一氧化氮及一氧化氮合酶的影响〔J〕.江苏医药杂志,2004,6(30):434-435.
〔7〕Schubert KM,Scheid MP,Duronio V.Ceramide inhibits protein kinase B/Ak t by promoting dephosphorylation of serine 473〔J〕.Biol Chem,2000,275(18):13330-13335.
〔8〕Enari M,Sakahira H,Yokoyama H,et al.A caspase-activated DNase that degrades DNA during apoptosis and its inhibitor ICAD〔J〕.Nature,1998,391(6662):43-50.
〔9〕Gordon S.The role of the macrophagein immune regulation〔J〕.Res Immunol,1998,149(7-8):658-688.
〔10〕Schuerwegh AJ,Dombrecht EJ,Stevens WJ,et al.Influence of pro-inflammatory(IL-1a,IL-6,TNF-a,IFN-g)and anti-inflammatory(IL-4)cytokines on chondrocyte function〔J〕.Osteoarthr Cartilage,2003,11(9):681-687.
〔11〕Binder C,Schulz M,Hiddemann W,et al.Induction of inducible nitric oxide synthase is an essential part of tumor necrosis factor-alpha-induced apoptosis in MCF-7 and other epithelial tumor cells〔J〕 .Lab Invest,1999,79(12):1703-1712.
〔12〕Nagata S.Apoptosis by death factor〔J〕.Cell,1997,88:355-365.
〔13〕Kim JM,Eck mann L,Savidge TC,et al.Apoptosis of human intestinal epithelial cells after bacterial invasion〔J〕.J Clin Invest,1998,102(10):1815-1823.
