鸡致病性大肠杆菌的分离鉴定及耐药基因的检测
2010-11-18张文娟田召芳
柳 林,张文娟,田召芳
(烟台市动物疫病预防与控制中心,山东烟台 264003)
大肠杆菌是Escherich在1885年发现的,是各种动物的肠道常驻菌,分布非常广泛。后来,人们才发现一些特殊血清型的大肠杆菌对人和动物的致病性。
禽大肠杆菌病(Avian colibacillosis)是由致病性大肠杆菌(Escherichia coli)引起的局部或全身性疾病,包括急性败血症、气囊炎、肝周炎、心包炎、卵黄性腹膜炎、输卵管炎、滑膜炎、眼炎、关节炎、脐炎、肉芽肿以及肺炎等,最常见的为气囊炎、肝周炎、心包炎、卵黄性腹膜炎、输卵管炎等[1]。在临床上往往不单独发病,一般继发于一些病毒病如新城疫、马立克氏病、传染性只气管炎等。这类疾病在鸡群中发病率一般为11%~69%,死亡率为3.2%~72.9%,且感染后的畜禽对沙门氏菌、新城疫、法氏囊病等细菌病和病毒病的易感性增高。各种品种及不同日龄的畜禽均可感染发病,该病给养禽业带来了巨大经济损失[1]。
虽然通过改善养殖条件及使用针对性的疫苗可以减少大肠杆菌病的发生,但最主要的防治措施仍然是使用抗菌药物。然而由于抗生素的大量使用,导致细菌耐药性的广泛产生。随着大肠杆菌耐药菌株的不断增多,大肠杆菌感染及其食品污染有不断上升的趋势,使人类食物中毒和胃肠炎不断暴发,己成为全球关注的焦点[2],因此,控制耐药菌的传播和防治大肠杆菌感染已成为一个世界性难题。目前,国内对致病性大肠杆菌氨基糖苷类的耐药性研究不多,而对鸡源大肠杆菌的aad类基因的检测研究尚未见有报道。本试验通过药敏试验,调查规模化鸡场致病性大肠杆菌对氨基糖苷类的耐药情况,用PCR技术对规模化鸡胚中分离的鸡致病性大肠杆菌的链霉素、卡那霉素耐药基因进行检测研究,调查和了解规模化鸡场链霉素、卡那霉素、庆大霉素的耐药基因的分布和流行情况,建立大肠杆菌对氨基糖甙类代表性药物链霉素、卡那霉素耐药基因的PCR检测技术,为我国控制大肠杆菌感染,制定用药规范,减少抗生素残留、降低耐药性的扩散和传播及氨基糖苷类抗生素耐药性的分子流行病学调查等提供科学依据,对保证我国畜禽业养殖的健康发展,保证食品安全和人类的健康有重要意义。
1 实验材料
1.1 仪器
电子天平 FA1004A,上海精天电子仪器有限公司;手提式高压蒸汽消毒锅YXQG02,山东新华医疗器械股份有限公司;超净工作台SW-CJ-1F,苏州集团苏州安泰空气技术有限公司;电热恒温培养箱YY0027-90,龙口电器有限公司;高速离心机 TGL-16G,上海安亭科学仪器厂;数显恒温水浴锅 HH-2,国华电器有限公司;低速离心机 TDL-5-A,上海安亭科学仪器厂;超速离心机85P-72,日本日立公司;紫外分光光度计 UV-2012C,尤尼柯(上海)仪器有限公司。
1.2 试剂
营养琼脂、普通肉汤、麦康凯琼脂、三糖铁琼脂、各种糖发酵及生化鉴定培养基,均按常规方法配制;生化试管,购于杭州天和微生物试剂有限公司;药敏纸片:链霉素,卡那霉素,四环素,氯霉素,复合磺胺,呋喃妥因,万古霉素,头孢呋新,头孢噻污,头孢派酮等购自上海伊华医科有限公司;DNA回收试剂盒,购自宝泰克生物工程公司;Taq DNA 聚合酶(5 U/μL)、dNTP、MgCl2、10×buffer,购于大连宝生物工程公司。
1.3 菌株
由本实验室分离自山东省滕州市某种鸡场死亡鸡胚及出壳弱雏
2 实验方法
2.1 细菌的分离培养
无菌采取死胚的肝脏或肺脏,直接划线接种于麦康凯琼脂平板,37℃培养24 h,挑取单个菌落,同时进行革兰氏染色镜检。纯化后置4℃冰箱中保存备用。
2.2 细菌生化特性鉴定
按常规方法对致病菌进行11项生化反应鉴定[3]。
2.3 药敏实验
将分离到的细菌涂布接种于麦康凯琼脂平板上,间隔一定距离贴上各种抗生素药敏试纸,于37℃培养24 h后观察各抗生素抑菌情况[4-5]。
2.4 引物设计
选用4对源于马孟根、王洪宁等的论文(猪源致病性沙门氏菌耐药基因的检测结果)的引物(氨基糖甙类的aph3'-2,addB和四环素类的tetA,tetC)(表1),由上海生物工程有限公司合成,实验结果证明引物设计可靠。

?
2.5 大肠杆菌耐药基因的PCR扩增和检测
PCR扩增体系:ddH2O 24.5μL,5×PCRbuffer(Mg2+)5.0 μL,MgCl25.0μL,dNTP 5.0μL,上、下游引物各2.5μL(25 pmol/μL),模板3.0 μL,Taq聚合酶 0.5μL(5 U/μL),总体积50μL。
PCR扩增条件:95℃预变温10 min;94℃变性30 s,退火温度aph3-Ⅱ、tetC是54℃30 s,tetA是55℃30 s,aadB 58 ℃30 s,72 ℃延伸 30 s,共35个循环;最后72℃延伸10 min。然后电泳检查结果[6]。
2.6 耐药基因的检测及测序
2.6.1 回收DNA
用MO BIO公司Ultra CleanTM15DNA Purification Kit回收PCR产物。
2.6.2 DNA片段与载体DNA的连接
(1)连接体系DNA片段0.3 mL,载体 DNA 0.03-0.1 mL,T4DNA ligase 1 mL,10 T4DNA ligase buffer 2.5 mL,再加dH2O到25μL。
(2)在16℃下过夜连接。
(3)次日加2.5 mL3M NaAC和62.5 mL冷水乙醇,置-20℃30~60 min,再以12 000 r/min离心10 min后回收沉淀。
(4)用70%冷水乙醇清洗沉淀,干燥后用25~50μL的TE溶液。取10~20μL转至100μL感受态。
2.6.3 感受态细胞的制备
参照《分子克隆实验指南》(第二版)所述方法用CaCl2制备新鲜的大肠杆菌TG1菌株的感受态细胞[7]。
2.6.4 重组DNA的转化
将10μL连接产物加到200μL新鲜制备的TG1感受态细胞中,混匀内容物,冰浴上放置30 min。然后将离心管放入42℃循环水浴中90 s,快速将管转移到冰浴中,使之冷却2~3 min。每管加LB培养基800μL,用水浴将培养基加温至37℃,然后转移至37℃摇床上温育45 min以上,使细菌复苏。取80~150μL菌液涂布到含有100μLg/mL AMP的LB琼脂平板上。倒置平皿于37℃温箱中培养过夜,次日挑取单个菌落进行质粒DNA的制备及鉴定[8]。
2.6.5 质粒DNA的酶切鉴定
将上述所提质粒各取3μL于0.8%琼脂糖凝胶中90 V电泳30 min,在凝胶成像系统下观察并记录结果,挑选DNA条带相对滞后的质粒DNA进行EcoR I和salI双酶切。酶切体系如下:质粒DNA 5.0μL,ddH2O 12.0 μL,10×H Buffer 2.0 μL,EcoR I 0.5 μL,sal I 0.5 μL,总体积20.0μL。
混匀后,稍微离心,37℃酶切1.5 h,然后于0.8%琼脂糖凝胶中90 V电泳45 min,在凝胶成像系统下观察并记录结果。
2.6.6 序列测定
由上海生物科技有限公司完成。
3 结果
3.1 细菌分离培养
在麦康凯等培养基上呈现光滑、湿润有光泽的红色菌落。
3.2 细菌的生化特性
生化反应结果:吲哚阳性;MR阳性;V-P阴性;枸椽酸盐阴性;H2S阴性;尿素阴性;分解乳糖、葡萄糖、麦芽糖、甘露糖产酸产气、蔗糖不产酸产气。所得生化试验结果证明所分离到的细菌为大肠杆菌。
3.3 药敏实验结果
实验结果表明6株大肠杆菌对氨基糖甙类和四环素类药物的耐药性最高,对磺胺类药物次之,硝基呋喃类和氯霉素类药物的耐药性最低(表2)。

?
3.4 PCR产物电泳结果
以质粒 DNA为模板对6株致病性大肠杆菌的aph(3')-Ⅱ、addB、te tA、tetC基因进行扩增,用1.0%琼脂糖凝胶电泳进行检测,结果见图1。
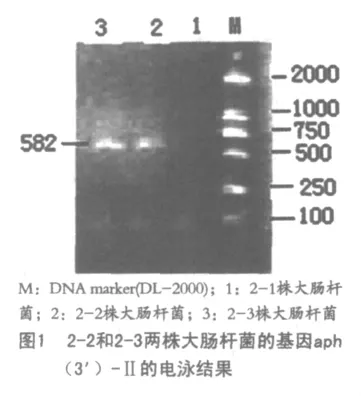
只有2-3和2-5两种细菌电泳条带的大小和要扩增的aph(3')-Ⅱ的基因片段大小一致,其余的均没有结果。
3.5 酶切目的DNA片段的电泳结果,如图2。
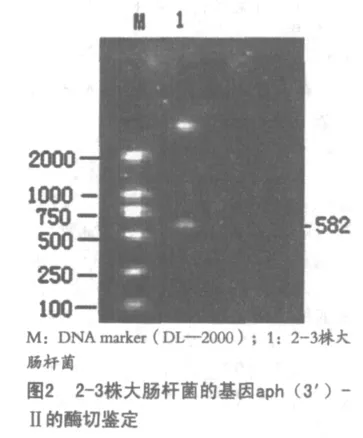
3.6 耐药基因的序列测定
序列结果显示,共有582个碱基。A、G、C、T 四种碱基的分布为:A -24.91%(145/582)、G -24.24%(141/582)、C-21.48%(125/582)、T-29.38%(171/582)。
4 讨论
4.1 关于大肠杆菌病的防治
气候、环境和饲养方式的变化,特别是鸡群较拥挤,是大肠杆菌病重要的诱发因素。所以要给予优良的饲养环境如注意卫生、通风,减少应激是预防该病的重要因素[9]。对于预防和治疗该病,根据上述药敏试验的结果,可避免几种药的使用,但由于该病病原对抗菌药物极易产生抗药性,使用敏感抗菌药虽有一定疗效但很容易复发。因此,一个疗程后,必须注意更换抗菌药物,且用药剂量要足,以防形成抗药性[1]。
4.2 关于药敏试验结果
氨基糖甙类作为一类抗生素,因其价格低廉、作用范围广泛等优点,曾广泛地应用于人医、兽医细菌性感染的防治,导致规模化鸡场大肠杆菌对氨基糖甙类药物产生了较为广泛的耐药性[10]。
药敏试验结果表明:规模化养鸡场对氨基糖甙类普遍存在耐药性,耐药率达到100%,而且大肠杆菌对除氨基糖甙类以外的多种抗生素也都产生了很强的耐药性,这些都为我们临床用药提供了理论依据,建议在规模化鸡场中在进行细菌性疾病的防治时,减少不敏感药物的使用,要根据药敏试验的结果选用合适的药物。
4.3 关于耐药基因PCR检测技求
PCR技术以微量、重复性好、快捷等特点已在人医及医学领域中得到了广泛应用,在医学疾病诊断方面由于其特异、敏感、准确、快速亦倍受青睐;在兽医临床上,常用此法进行病原特异基因的检测及克隆。既然基因突变及基因转移是耐药性存在的重要内因,这就决定了检测与抗生素耐药性相关的基因具有重要意义。国外用此技术对部分细菌的耐药机制进行了深入探讨,使耐药质粒的演变规律逐渐明了[11-12]。本实验用 PCR扩增获得aph(3')-Ⅱ的基因片段,成功建立了大肠杆菌aph(3')-Ⅱ基因的PCR检测技术,从分子水平上检测鸡源致病性大肠杆菌的耐药基因aph(3')-Ⅱ,克服了药敏试验只能检测耐药表型的缺点,可用于大肠杆菌对氨基糖甙类耐药性的分子水平检测。
本研究用PCR技术分别对6株耐药的大肠杆菌的耐药基因进行检测。结果表明,在6株耐药的大肠杆菌的质粒上扩出的基因aph3'-2,与药敏试验结果阳性符合,具有较高的检出率;其余5株耐药大肠杆菌质粒上扩出的基因与药敏试验阳性不符合,检出率较低。
4.4 关于序列分析
核苷酸序列分析能从分子水平上分析大肠杆菌对氨基糖甙类的耐药性,了解其遗传和生化机制。一方面,通过同源性比较,可了解来源相同和不同菌株核苷酸的变异情况;另一方面还可以根据已知序列,推定其编码氨基酸,预测蛋白质的二级和高级结构,了解其耐药性的生化机制,为抗生素工业中开发新的抗生素提供理论依据。
[1]刁有祥,张万福.禽病学[M].北京:中国农业科技出版社,2000.
[2]徐士新.国外抗菌药物耐药性的研究和相关规定 [J].中国兽医杂志,1998,24(11):12-13.
[3]赵静,杨汉春,李花,等.用聚合酶链式反应检测猪源大肠杆菌卡那霉素耐药基因 [J].农业生物技术学报,2000(13):84-91.
[4]赵静,杨汉春,查振林,等.规模化养猪场致病性大肠杆菌耐药性的检测 [J]. 中国兽医杂志,1998,24(24):12-13.
[5]潘志明,焦新安,刘学贤,等.鸡白痢沙门氏菌耐药性的变化趋势 [J].中国预防兽医学报,1999,21(4):305.
[6]J.萨姆布鲁克.分子克隆实验指南[M].金东雁,黎孟枫,译.北京:科学出版社,1990.
[7]奥斯伯.精编分子生物学实验指南[M].颜子颖,王海林,译.北京:科学出版社,1998.
[8]J.萨姆布鲁克,E.F.费里奇,T.曼尼阿蒂斯.分子克隆实验指南[M].金冬雁,黎孟枫,译.2版,北京:科学出版社,1995.
[9]Chen S,Zhao S H,White D G,et al.Characterzation of multiple antimicrobial resistant salmonella serovars isolated from retail meats[J].App Environ Microbiol,2004,70(1):1-7.
[10]王红宁,李书亮.规模化养猪场致病性大肠杆菌、沙门氏菌药敏区系调查 [J]. 西南农业学报,2000,8(3):237-239.
[11]Ubakata K,Nakagami S,Nitta A,et al.Rapid detection of the mecA gene in met hicillin resistantstaphytococciby enzymatic detectionof polymerasechain reaction products[J].JClin Microbio,1992,30(7):1728-1733.
[12]Ng L K,Mulvey M R,Martin I,et al.Genetic characterization of antimicrobial resistance in Canadian isolates of Salmonella serovar typhimuriumDT104 [J].Antimi-crob Agents Chemother,1999,43(12):3018.

