铱–钽氧化物涂层阳极氧化再生酸性蚀刻液
2010-11-16曾振欧李哲杨华赵国鹏
曾振欧,李哲,杨华,赵国鹏
(1.华南理工大学化学与化工学院,广东 广州 510640;2.广州二轻工业科学技术研究所,广东 广州 510170)
铱–钽氧化物涂层阳极氧化再生酸性蚀刻液
曾振欧1,*,李哲1,杨华1,赵国鹏2
(1.华南理工大学化学与化工学院,广东 广州 510640;2.广州二轻工业科学技术研究所,广东 广州 510170)
采用Ir–Ta氧化物涂层阳极(DSA)和直流电解法研究了酸性蚀刻液的阳极氧化再生回用过程。酸性蚀刻液在Ir–Ta氧化物涂层阳极的氧化再生过程中发生浓差极化,电极反应速率为Cu+离子扩散传质所控制,极限电流密度与Cu+离子浓度和温度成正比,采用小于或等于极限电流密度的电流密度进行阳极氧化时不析出氯气。酸性蚀刻液阳极氧化再生的电流密度小,槽电压低,电解能耗少,电流效率可达到 100%。阳极氧化再生后酸性蚀刻液的蚀刻能力与双氧水再生的相近,完全可以替代双氧水再生。
酸性蚀刻液;铱–钽氧化物涂层阳极;阳极氧化;一价铜离子;再生
1 前言
CuCl2–HCl酸性蚀刻液的再生回用对PCB生产企业的节能减排和降低生产成本具有十分重要的意义。目前大多数PCB生产企业在酸性蚀刻液失效后只能废弃或廉价卖给有回收资质的企业用化学法回收铜,而化学法处理酸性蚀刻废弃液只能回收铜而不能回收盐酸,且回收过程容易对环境造成二次污染[1-4]。在PCB生产的蚀刻过程中,酸性蚀刻液中的 Cu2+离子与铜箔作用生成Cu+离子,Cu+离子浓度不断升高,Cu2+离子浓度不断降低,则蚀刻能力逐渐降低。当酸性蚀刻液的蚀刻能力降低到一定程度时就必须进行再生处理。采用添加双氧水或其他氧化剂可将溶液中的 Cu+离子重新氧化成Cu2+离子,但最终存在废弃蚀刻液[5-7]。采用电化学法对酸性蚀刻液进行再生处理,则溶液中的Cu+离子在阳极上重新氧化成Cu2+离子,蚀刻过程中产生的多余Cu+离子在阴极上发生电沉积而被回收,蚀刻液体积不变且没有废液产生,有利于保护环境,降低企业生产成本[8-9]。本文主要采用 Ir–Ta氧化物涂层阳极(DSA)在不析氯气的条件下研究酸性蚀刻液的氧化再生过程。
2 实验
2. 1 溶液配制
工业生产中初始酸性蚀刻液的组成一般为:Cu2+120 ~ 180 g/L,H+1.5 ~ 2.5 mol/L,Cl-210 ~ 250 g/L。当溶液中Cu+离子超过10 g/L后就必须进行再生处理。实验用CuCl2·2H2O、CuCl、NaCl和w = 37%的盐酸(分析纯),加去离子水配制成溶液,溶液组成为:H+2 mol/L,Cl-7 mol/L,Cu+0 ~ 10 g/L,Cu2+115 ~ 120 g/L。
2. 2 极化曲线测量
阳极极化曲线采用上海辰华 CHI640电化学工作站测量,采用三电极体系,研究电极为Ir–Ta氧化物涂层阳极DSA(工作面积1 cm2),参比电极为饱和甘汞电极(SCE),辅助电极为大面积不锈钢电极,研究电极与参比电极之间以带鲁金毛细管的旋塞式盐桥实现电接触。电解池温度用超级恒温水浴恒定。
2. 3 溶液ORP的测量
溶液的氧化还原电位(ORP)采用铂片电极为工作电极和饱和甘汞电极为参比电极进行测量。铂片电极测量前在0.1 mol/L稀盐酸中浸泡30 min,用纯水清洗后再在饱和氯化钾溶液中浸泡6 h备用。
2. 4 酸性蚀刻液阳极氧化再生实验
将酸性蚀刻液(Cl-7.0 mol/L,H+2 mol/L,Cu2+115 g/L,Cu+10 g/L)置于装有阴离子交换膜的电解槽内,阳极区和双阴极区的电解液均为 1.2 L,阳极为Ir–Ta氧化物涂层阳极(双面,表观面积2 × 1 dm2),阴极为不锈钢电极(双阴极,表观面积2 × 1 dm2)。阳极电流密度0.05 ~ 4 A/dm2,电解温度25 °C。用库仑计记录通电量,阳极区溶液氧化还原电位ORP < 500 mV时通电1 A·h,然后取20 mL阳极液测量其ORP;溶液氧化还原电位ORP > 500mV时通电10 A·min,然后取20 mL阳极液测量其ORP,阳极氧化再生至氧化还原电位ORP > 600 mV时结束。
2. 5 氯气收集实验
氯气收集实验在密闭电解槽中进行,阳极区析出的气体导入1 mol/L的NaOH溶液,电解结束后用过量的硝酸将NaOH溶液调至酸性,然后加入KI溶液,观测是否有白色沉淀产生,有则过滤称重。
2. 6 再生酸性蚀刻液的蚀刻能力测试
将氧化剂(H2O2)再生的蚀刻液和阳极氧化法再生的蚀刻液用HCl + NaCl溶液将溶液中的总Cu质量浓度调至120 g/L,氧化还原电位ORP至500 mV(保证其他离子浓度不变),采用静态法[10]测量其对铜箔的蚀刻速率。取50 mL再生蚀刻液于100 mL烧杯中,恒温50 °C,将铜箔(双面,尺寸为40 mm × 50 mm × 35 µm)放入烧杯并使其完全浸入溶液中,蚀刻3 min后将残余铜箔取出,用2 mol/L HCl + 2 mol/L NaCl溶液洗涤,再用去离子水冲洗,吹干后称重。根据下式计算平均蚀刻速率:

式中v为平均蚀刻速率,单位 µm/min;Δm为蚀刻质量,单位mg;ρ为铜箔的密度(8.93 g/cm3);A为蚀刻面积,单位mm2;t为蚀刻时间,单位min。
3 结果与讨论
3. 1 酸性蚀刻液阳极氧化的极化曲线
图1为25 °C时酸性蚀刻液(Cu+0.5 ~ 10 g/L,Cu2+120 g/L)在Ir–Ta氧化物涂层阳极上阳极氧化的极化曲线(电位扫描速率为1 mV/s)。

图1 不同Cu+离子质量浓度下的阳极极化曲线Figure 1 Anodic polarization curves at different mass concentrations of Cu+
由图1可知,极限电流密度随Cu+离子浓度的增大而增大。结果表明,Cu+离子的阳极氧化过程发生了浓差极化,电极反应速率受Cu+离子扩散传质所控制。阳极电势在0.40 V左右时Cu+离子被阳极氧化成Cu2+离子;阳极电势大于0.50 V时均出现极限电流密度;阳极电势达到1.03 V以后才开始发生析氯反应。
根据浓差极化的动力学方程[11],对 Cu+离子浓度为6.0 g/L的极化曲线数据进行处理,可得到如图2所示的φ–lg[(jd- j)/j]直线关系。

图2 φ–lg[(jd ¯ j)/j]曲线Figure 2 Curve of φ vs. lg[(jd ¯ j)/j]
图2中直线的相关系数为0.997 6,斜率-0.060 9与理论值-0.059 1相近,半波电势为0.427 V。
以图 1中的极限电流密度对 Cu+离子浓度作图可得如图3所示的直线,其相关系数为0.999 3。该直线的斜率为0.047 4,其直线关系符合发生浓差极化的电化学动力学理论[11]。因此,通过测定极限电流密度,可确定溶液中 Cu+离子浓度;相反,已知溶液的 Cu+离子浓度,也可从理论上计算出电解时相应的阳极极限电流密度。

图3 阳极极限电流密度与Cu+离子质量浓度的关系Figure 3 Relationship between limiting current density at anode and Cu+ mass concentration
3. 2 温度对阳极氧化极限电流密度的影响
图4为不同温度下酸性蚀刻液(Cu+5.0 g/L,Cu2+120 g/L)在Ir–Ta氧化物涂层阳极上的极化曲线(扫描速率1 mV/s)。结果表明:温度升高,Cu+离子阳极氧化电势升高,极限电流密度增大,析氯电势降低。

图4 不同温度下的阳极极化曲线Figure 4 Anodic polarization curves at different temperatures
以图4中极限电流密度对温度作图可得如图5所示的直线,在25 ~ 50 °C范围内的斜率为0.008 5。

图5 温度对极限电流密度的影响Figure 5 Effect of temperature on limiting current density
3. 3 酸性蚀刻液的阳极氧化再生
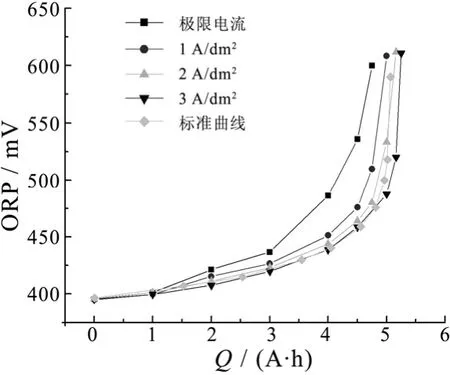
图6 不同电流密度下的蚀刻液电化学再生Figure 6 Electrochemical regeneration of acidic etching solution at different current density
图6为25 °C时酸性蚀刻液(Cu+10 g/L,Cu2+115 g/L)在不同电流密度下进行阳极氧化再生后,氧化还原电位 ORP与通电量的关系(包括 Cu+离子阳极氧化的理论曲线)。结果表明:通电量增加,阳极液氧化还原电位ORP不断升高,Cu+离子被氧化成Cu2+离子后其浓度不断下降。电解电流密度越大,曲线越向右边移动。当溶液ORP < 500 mV,电流密度低于2 A/dm2时,蚀刻液再生的关系曲线在理论曲线的左边;电流密度为3 A/dm2时,蚀刻液再生的关系曲线在理论曲线右边。这说明电解阳极电流密度为2 A/dm2以下时,电流效率大于100%。当阳极电流密度低于极限电流密度时,电解过程中无氯气析出,只发生 Cu+离子的阳极氧化反应;当阳极电流密度高于极限电流密度(1 A/dm2或2 A/dm2)时,阳极上伴随析氯反应,但阳极表面析出的氯气不逸出时也能迅速将 Cu+氧化成 Cu2+,使电流效率大于100%。阳极电流密度高于2 A/dm2时,氯气析出速度太快,导致氯气逸出,则电流效率下降。溶液氧化还原电位ORP > 500 mV后,溶液中Cu+质量浓度很低(小于0.5 g/L),析氯反应为主反应,槽电压升高,电流效率降低。
酸性蚀刻液在不同电流密度下阳极氧化再生时的电流效率与槽电压列于表1。

表1 不同电流密度下,阳极氧化再生的电流效率与槽电压Table 1 Current efficiency and cell voltage of anodic oxidation regeneration at different current densities
从表 1可以看出,阳极电流密度越小,则阳极超电势越小,槽电压相对较低,电流效率越高。电流效率大于100%主要是由溶液中溶解氧氧化Cu+所致。增大电流密度不仅阳极超电势和槽电压增大,酸性蚀刻液再生的电解能耗也增大,且电流效率降低,电解过程还伴随有氯气析出。
表2为25 °C时不同Cu+浓度的酸性蚀刻液(Cu+0.5 ~ 2.0 g/L,Cu2+120 g/L)在不同电流密度下阳极再生时析出氯气的情况。从表2可以看出,Cu+质量浓度为0.5 g/L时,阳极电流密度低于1.0 A/dm2则没有氯气逸出;若阳极电流密度为2.0 A/dm2,逸出氯气所用电量是总电量的0.58%。Cu+质量浓度为1.0 g/L时,若电流密度大于2.0 A/dm2,逸出氯气所用电量是总电量的0.14%以上;Cu+质量浓度为2.0 g/L时,即使电流密度高达4.0 A/dm2,也无氯气逸出。

表2 不同Cu+离子质量浓度的酸性蚀刻液在不同电流密度下的析氯情况Table 2 Cl2 evolution in acidic etching solutions with different Cu+ mass concentrations at different current densities
3. 4 阳极氧化再生液与双氧水再生液的蚀刻速率比较
蚀刻液蚀刻铜箔后,Cu+浓度增大、蚀刻能力下降,Cu+重新氧化成Cu2+后可达到再生回用要求。在50 °C下对酸性蚀刻液(Cu+10 g/L,Cu2+115 g/L)分别用阳极氧化、双氧水氧化和厂家氧化剂氧化进行再生–蚀刻循环使用4次,每次再生后酸性蚀刻液的蚀刻能力如表3所示。从表 3可以看出,厂家氧化剂氧化再生的蚀刻能力最好,阳极氧化与双氧水氧化再生的蚀刻能力相差不太,阳极氧化法完全可以替代双氧水氧化法。

表3 不同再生方法对蚀刻速率的影响Table 3 Influence of different regeneration methods on etching rate
4 结论
(1) 采用 Ir–Ta氧化物涂层阳极对酸性蚀刻液进行氧化再生的电极过程发生了浓差极化,电极反应速率受溶液中Cu+离子的扩散所控制。阳极氧化过程出现极限电流密度,与溶液中Cu+质量浓度和温度成正比,低电流密度下的阳极氧化再生不析出氯气。
(2) 在 Ir–Ta氧化物涂层阳极上进行酸性蚀刻液氧化再生,阳极电流密度越低,则槽电压越低,电解能耗越低,电流效率越高。低电流密度下,阳极氧化再生的电流效率高达100%。
(3) 阳极氧化再生酸性蚀刻液的蚀刻能力与双氧水再生相近,完全可以替代双氧水进行再生回用。
[1] 林金堵. PCB铜蚀刻废液“零”排放要大力推广应用开来[J]. 印制电路信息, 2007 (10): 5-6, 17.
[2] 聂忠源, 陈尚林. 印制板蚀刻、微蚀刻废液的再生和铜回收的技术及设备[J]. 印制电路信息, 2006 (11): 57-60.
[3] 郭仁东, 吴昊, 张晓颖. 高浓度含铜废水处理方法的研究[J]. 当代化工, 2004, 33 (5): 280-281, 310.
[4] 刘远彬, 左玉辉, 程志光. 循环经济与 PCB行业废弃物循环利用[J].城市环境与城市生态, 2003, 16 (6): 121-122.
[5] 彭丽芬, 张小春, 陈桧华. 酸性蚀刻剂的开发与应用[J]. 广东化工, 2004, 31 (4): 42-43, 27.
[6] 张志祥. 氯酸钠/盐酸型蚀刻铜再生剂之论述[J]. 印制电路信息, 2002 (3): 40-42.
[7] 王红华, 蒋玉思. 酸性氯化铜液蚀刻化学及蚀刻液再生方法评述[J].印制电路信息, 2008 (10): 57-60.
[8] CAKIR O. Copper etching with cupric chloride and regeneration of waste etchant [J]. Journal of Materials Processing Technology, 2006, 175 (1/3): 63-68.
[9] KESKITALO T, TANSKANEN J, KUOKKANEN T. Analysis of key patents of the regeneration of acidic cupric chloride etchant waste and tin stripping waste [J]. Resources, Conservation and Recycling, 2007, 49 (3): 217-243.
[10] 魏静, 罗韦因, 徐金来, 等. 印刷线路板精细蚀刻的影响因素[J]. 表面技术, 2005, 34 (2): 49-50, 55.
[11] 曾振欧, 黄慧民. 现化电化学[M]. 昆明: 云南科技出版社, 1999.
Regeneration of acidic etching solution by anodic oxidation with Ir–Ta oxide-coated anode //
ZENG Zhen-ou*, LI Zhe, YANG Hua, ZHAO Guo-peng
The process of anodic oxidation for regeneration and recycling of acidic etching solution was studied by direct-current electrolysis with an Ir–Ta oxide-coated anode (DSA). Concentration polarization occurs in the oxidation regeneration process of acidic etching solution at Ir–Ta oxide-coated anode. The electrode reaction rate is related to the diffusion of Cu+ions. The limiting current density is proportional to the Cu+concentration and temperature. At a current density lower than or equal to the limiting current density, chlorine gas is not evolved during the anodic oxidation regeneration. The anodic oxidation regeneration has the features of low current density, low cell voltage, little electrolysis energy consumption and current efficiency 100%. The acidic etching solution regenerated by anodic oxidation has an etching capacity similar to that regenerated by using hydrogen peroxide solution. Hence, anodic oxidation can substitute the use of hydrogen peroxide solution.
acidic etching solution; iridium–tantalum oxidecoated anode; anodic oxidation; cuprous ion; regeneration
School of Chemistry and Chemical Engineering, South China University of Technology, Guangzhou 510640, China
X781.1
A
1004 – 227X (2010) 11 – 0029 – 04
2010–08–25
曾振欧(1955–),男,教授,研究方向主要为应用电化学与金属表面处理。
作者联系方式:(E-mail) zhouzeng@scut.edu.cn。
[ 编辑:吴定彦 ]
