神经病理性痛大鼠鞘内注射GFAP抗体的效应及其血清GFAP的意义
2010-11-15陈建平屈江波郭张华牟晓杰山西医科大学第二临床医学院麻醉科太原030001
陈建平,屈江波,郭张华,牟晓杰,陈 丽 (山西医科大学第二临床医学院麻醉科,太原 030001)
神经病理性疼痛产生时,大鼠脊髓中的星形胶质细胞激活,其标记物胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)明显增加[1]。研究表明[2],急性脑损伤时由于血脑屏障功能受损导致血清中GFAP显著升高,并且其升高幅度可作为脑损伤病人预后的指标。进一步研究发现[3],在脊神经结扎的神经病理性疼痛模型中,相应脊髓节段存在血脊髓屏障(blood-spinalcordbarrier,BSCB)损伤,这种损伤可导致脊髓内源性白蛋白的渗漏,并且在该节段脊髓受损侧灰质中存在GFAP表达升高和星形胶质细胞的激活。但是,这种BSCB的损伤是否会引起GFAP的渗漏仍不清楚,因此,本研究通过观察血清中GFAP的水平及鞘内注射其相应抗体对神经病理痛的影响,旨在探讨GFAP在神经病理性疼痛中的预警及抗GFAP的镇痛效应。
1 材料和方法
1.1 主要试剂及仪器 GFAP抗体购自美国BD公司;本实验中所用的其他试剂均购自中国晶美生物公司。Model 680酶标仪(Bio.Rad公司,美国),The Plantar von FreyTM动态爪底触觉测量仪(UGO公司,意大利).
1.2 方法
1.2.1 动物分组和模型建立 18只雌性SD大鼠,体重250-300 g,购自山西医科大学实验动物中心。随机分为三组,分别为正常对照组(C组,n=6)、SNI组(S组,n=6)、SNI+抗 GFAP组(G 组,n=6);其中S组与 G组大鼠均按 Decosterd等[4]的方法建立SNI模型,于左后肢上缘切开皮肤,分离肌肉,暴露坐骨神经的主干及分支——胫神经、腓总神经和腓肠神经,结扎并切断胫神经和腓总神经,保留细小的腓肠神经,并避免牵拉腓肠神经;G组大鼠在建立SNI模型的同时鞘内注射GFAP抗体10 mg/kg;C组大鼠不做任何处理。
1.2.2 50% 机械缩爪阈值(mechanical withdrawal threshold,MWT)50%MWT是指多次机械刺激能够引起50%缩爪反应的机械力度,本实验采取upand-down[5]的方法测定大鼠后趾50%缩爪阈值。依次使用 0.45 g,0.70 g,1.2 g,2.0 g,3.63 g,5.5 g,8.5 g,15.1 g 的力度刺激后趾。开始使用 2 g 的力度刺激,若没有缩腿反应,则选择其上的一个力度3.63 g刺激后趾;若有缩腿反应,则选择其下的一个力度1.20 g刺激后趾。依次类推,在出现一次与前一次不同的反应(有缩腿反应至无缩腿反应或无缩腿反应至有缩腿反应)时,继续依序刺激4次,包括以前的2次,一共6次,即可完成50%缩腿阈值的测定。若需要使用的力度超过15.1 g或低于0.45 g,该侧阈值则直接记为15 g或0.45 g。50%缩爪阈值的计算使用公式:50%缩爪阈值=10log(X)+kδ,X为最后刺激使用的力度;k为不同刺激方式的系数,在文献[4]附表中查找;δ是指各刺激力度(lg值)相邻间距的平均数,此处δ=0.224。分别于SNI术前(T0)、术后1-6周(T1-T6)测定各组50%机械缩爪阈值。
1.2.3 ELISA 法检测各组血清 GFAP(sGFAP)、IL-1β(sIL-1β)和脑脊液GFAP(cGFAP)水平 分别于SNI术前(T0)、术后1-6周(T1-T6)采用截尾法采集大鼠血液,鞘内置管采集脑脊液,以1∶100稀释的兔抗大鼠 GFAP、IL-1β 包被 ELISA 板(100 μl/孔),阳性对照孔中分别加1∶100稀释的 GFAP、IL-1β 100 μl,实验孔中分别加1∶10稀释的各组大鼠血清或者脑脊液100 μl。阳性对照孔中加入1∶1 000稀释的 HRP标记的羊抗小鼠 IgG,实验孔中加入1∶1 000稀释的HRP标记的羊抗大鼠IgG,TMB显色后用酶标仪测定波长450 nm处的吸光度(A450)值。
1.3 统计学分析 采用SPSS13.0统计学软件进行分析,计量资料以±s表示,组间比较采用单因素方差分析,组内比较采用重复测量数据的方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 50 %MWT测定 三组术前50%MWT比较差异无统计学意义(P>0.05)。与T0时比较,S组、G组 T1-T6时50%MWT均低于术前(P<0.05),而C组各时点变化差异无统计学意义。与C组比较,S组和G组T1-T650%MWT均降低(均P<0.05);与S组比较,G组50%MWT升高(P<0.05),见表1。
表1各组不同时点50%MWT测定值比较(g,n=6,±s)Tab 1The values of 50%MWT in 3 groups(g,n=6,±s)
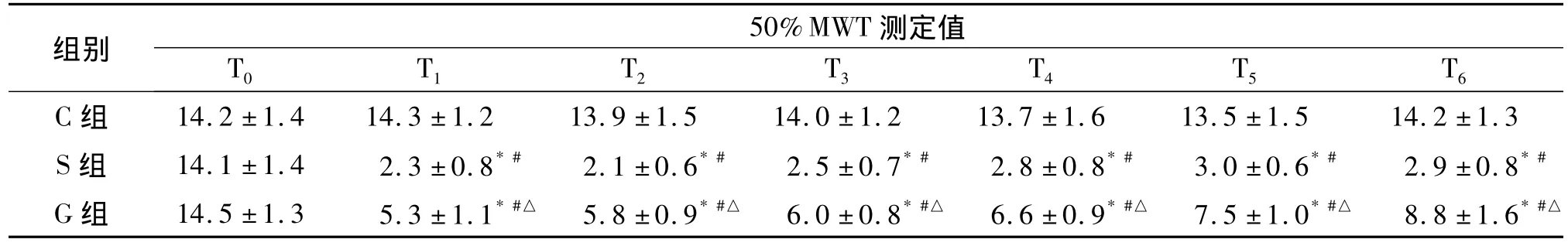
表1各组不同时点50%MWT测定值比较(g,n=6,±s)Tab 1The values of 50%MWT in 3 groups(g,n=6,±s)
与 T0比较,*P <0.05;同时点与 C组比较,#P <0.05;同时点与 S组比较,#P <0.05
组别50%MWT 测定值T0 T1 T2 T3 T4 T5 T6 6 13.5 ±1.5 14.2 ±1.3 S 组 14.1 ±1.4 2.3 ±0.8*# 2.1 ±0.6*# 2.5 ±0.7*# 2.8 ±0.8*# 3.0 ±0.6*# 2.9 ±0.8*#G 组 14.5 ±1.3 5.3 ±1.1*#△ 5.8 ±0.9*#△ 6.0 ±0.8*#△ 6.6 ±0.9*#△ 7.5 ±1.0*#△ 8.8 ±1.6*#△C 组 14.2 ±1.4 14.3 ±1.2 13.9 ±1.5 14.0 ±1.2 13.7 ±1.
2.2 ELISA 法检测血清 GFAP(sGFAP)、IL-1β(sIL-1β)和脑脊液GFAP(cGFAP)水平 术前(T0)三组间sGFAP、sIL-1β和cGFAP水平差异无统计学意义(均P>0.05)。与T0时比较,T1-T6时S组各项指标升高(P<0.05),于T5时达高峰,T6时开始回降;G组术后3-5周时各项指标升高(P<0.05),无高峰现象,并于T6时降至术前水平;C组各时点间各指标差异无统计学意义(P>0.05)。与C组比较,S组T1-T6各时点sGFAP、sIL-1β和cGFAP均升高,G组仅于 T3-T5时有所升高;与 S组比较,G组T3-T6时各指标降低(P<0.05),见表2。
表2三组大鼠各指标在不同时点的吸光度值A450(n=6,±s)Tab 2The levels of cGFAP,sGFAP,sIL-1β in 3 groups(n=6,±s)

表2三组大鼠各指标在不同时点的吸光度值A450(n=6,±s)Tab 2The levels of cGFAP,sGFAP,sIL-1β in 3 groups(n=6,±s)
与 T0比较,*P <0.05;同时点与 C 组比较,#P <0.05;同时点与 S组比较,△P <0.05
指标 组别 T0 T1 T2 T3 T4 T5 T6 cGFAP C 组 0.19 ±0.06 0.15 ±0.07 0.18 ±0.05 0.16 ±0.07 0.15 ±0.09 0.18 ±0.06 0.19 ±0.07 S 组 0.17 ±0.08 0.42 ±0.08*# 0.56 ±0.09*# 0.48 ±0.06*# 0.47 ±0.11*# 0.60 ±0.12*# 0.43 ±0.05*#G 组 0.19 ±0.01 0.12 ±0.05 0.19 ±0.04 0.30 ±0.10*#△ 0.37 ±0.08*#△ 0.33 ±0.07*#△ 0.23 ±0.03△sGFAP C 组 0.48 ±0.04 0.33 ±0.03 0.42 ±0.06 0.38 ±0.04 0.46 ±0.06 0.41 ±0.04 0.42 ±0.04 S 组 0.50 ±0.12 1.33 ±0.31*# 2.16 ±0.94*# 1.96 ±0.86*# 2.42 ±0.45*# 2.56 ±0.36*# 0.90 ±0.14*#G 组 0.43 ±0.03 0.47 ±0.06 0.56 ±0.11 1.21 ±0.92*#△ 1.16 ±0.78*#△ 1.35 ±0.68*#△ 0.49 ±0.13△sIL-1β C 组 0.35 ±0.02 0.29 ±0.04 0.36 ±0.10 0.32 ±0.09 0.32 ±0.05 0.36 ±0.05 0.30 ±0.07 S 组 0.37 ±0.11 0.91 ±0.15*# 1.27 ±0.98*# 1.29 ±0.91*# 1.28 ±0.86*# 1.33 ±0.91*# 1.12 ±0.87*#G 组 0.33 ±0.04 0.43 ±0.11 0.38 ±0.09 1.02 ±0.13*#△ 0.96 ±0.07*#△ 0.94 ±0.08*#△ 0.35 ±0.07△
3 讨论
由各种原因导致的外周神经损伤引起的神经病理性疼痛主要表现为痛觉过敏、痛觉异常和自发性疼痛。本课题组在前期的研究中曾多次成功复制保留神经损伤性神经病理性痛模型(SNI)、观察了大鼠的机械性触诱发痛和痛觉异常行为[6],本次实验检测了鞘内给予GFAP抗体的镇痛效应,同时观察了 SNI模型血清 GFAP(sGFAP)、IL-1β(sIL-1β)和脑脊液GFAP(cGFAP)的变化。
胶质细胞广泛分布于大脑和脊髓,占中枢神经细胞总数的70%以上。大量研究证实,神经病理性疼痛产生时,星形胶质细胞被激活,其特异性标志物GFAP表达水平增加,激活的星形胶质细胞可释放大量的细胞因子IL-1β[7],引起神经炎症和神经免疫反应,导致各种神经功能紊乱,引起痛觉过敏和痛觉异常。
有研究者[1]采用免疫组化的方法研究脊神经结扎模型,发现疼痛形成时大鼠脊髓GFAP明显增加,表明星形胶质细胞的激活与疼痛反应有关。Alexander等[8]的研究表明在复杂区域疼痛综合征患者中半数有脑脊液中GFAP水平升高。本研究结果也表明,在SNI术后1-6周脑脊液中的GFAP持续增高,并在5周时达到高峰,直至6周才开始回降。另有研究表明[9],在神经病理性痛的另一种模型,坐骨神经慢性压迫模型中,大鼠脊髓背角GFAP免疫染色明显增强。并且外周神经损伤后,星形胶质细胞的GFAP不仅表达增高并且持续时间长,表明星形胶质细胞活化与神经病理性疼痛的维持有关。
GFAP是星形胶质细胞的结构蛋白,正常情况下仅存在于神经系统。中枢神经系统急性损伤时脑脊液中会有大量的GFAP,在创伤性脑损伤病人中,其GFAP会通过受损的血脑屏障进入到血液里,研究证实在受伤后1 h,血清中的GFAP水平就会显著升高,并可作为脑损伤预后的指标[2]。Gordh 等[3]在L4脊神经结扎大鼠中观察到在相应脊髓节段存在血脊髓屏障损伤,这种损伤导致了内源性白蛋白的渗漏。本研究结果显示,神经病理性疼痛大鼠成模后1-5周时血清中的GFAP均升高,5周时达高峰,6周开始回落;与之变化一致,血清IL-1β也呈现相应改变,这可能与血脊髓屏障受损导致白蛋白的渗漏机制一致。
鞘内给予星形胶质细胞代谢抑制剂氟代柠檬酸(fluorocitrate)可显著减轻神经病理性疼痛的痛觉异常行为[10],本研究中通过鞘内注射GFAP抗体也显著减轻大鼠的痛觉异常,同时大鼠血清、脑脊液中GFAP,血清中IL-1β下降;但在鞘内注射2周后即术后3-5周(T3-T5)时,动物又表现出痛觉过敏行为,表明一次性鞘内注射GFAP抗体的作用时间大致持续2周左右。与S组不同的是,G组血清、脑脊液中GFAP,血清中IL-1β未在5周时出现高峰,并于6周时已降至术前水平。表明鞘内注射GFAP抗体可下调GFAP的表达从而缓解神经病理性痛;并且给予GFAP抗体后,可减轻远期痛觉异常行为(本实验中6周时,G组50%MWT明显高于S组,P<0.05)。本研究中G 组的50%MWT 在T2、T3、T6时未恢复至对照组水平,可能是因为神经病理性痛的发生机制较复杂,除星形胶质细胞和IL-1β外,还有其他因素存在。因此,尽管脊神经结扎后相应节段的脊髓血管屏障的损伤仍然存在,但通过减少GFAP的渗漏,仍可达到减轻神经性疼痛的目的。与检测脑脊液中的GFAP操作相比,检测血清中的GFAP要容易,因此血清中GFAP水平可作为评估痛觉异常的指标。
综上所述,在神经病理性疼痛中,鞘内注射GFAP抗体通过下调脊髓中的GFAP水平可明显缓解疼痛,并且通过检测血清中的GFAP水平可对痛觉异常进行预评估。
[1] Takeda K,Sawamura S,Sekiyama H,et al.Effect of methylprednisolone on neuropathic pain and spinal glial activation in rats[J].Anesthesiology,2004,100(5):1249-1257.
[2] Nylen K,Ost M,Csajbok LZ.Increased serum-GFAP in patients with severe traumatic brain injury is related to outcome[J].J Neurol Sci,2006,240(1-2):85-91.
[3] Gordh T,Chu H,Sharma HS.Spinal nerve lesion alters blood-spinal cord barrier function and activates astrocytes in the rat[J].Pain,2006,124(1-2):211-221.
[4] Decosterd I,Woolf CJ.Spared never injury:an animal model of persistent peripheral neuropathic pain[J].Pain,2000,87(2):149-158.
[5] Ghaplan SR,Bach FW,Pogrrel JW,et al.Quantitative assessment of tactile allodynia in the rat paw[J].J Neurosci Meth,1994,53(1):55-63.
[6] 陈建平,田玉科,王公明.NMDA受体2B亚基模拟表位对慢性神经病理性痛大鼠的镇痛效应[J].中华麻醉学杂志,2007,27(12):1100-1103.
[7] Shi L,Smolders I,Umbrain V,et al.Peripheral inflammation modifies the effect of intrathecal IL-1β on spinal PGE2 production mainly through cyclooxygenase-2 activity.A spinal microdialysis study in freely moving rats[J].Pain,2006,120(3):307-314.
[8] Alexander GM,Perreault MJ,Reichenberger ER,et al.Changes in immune and glial markers in the CSF of patients with complex regional pain syndrome[J].Brain Behav Immun,2007,21(5):668-676.
[9] Colburn RW,Rickman AJ,Deleo JA.The effect of site and type of nerve injury on spinal glial activation and neuropathic pain behavior[J].Exp Neurol,1999,157(2):289-304.
[10] Hassel B,Paulsen RE,Johnsen A,et al.Selective inhibition of glial cell metabolism in vivo by fluorocitrate[J].Brain Res,1992,576(1):120-124.
