带科绦虫线粒体基因组全序列研究进展*
2010-11-14贾万忠闫鸿斌郭爱疆史万贵付宝权
贾万忠,闫鸿斌,郭爱疆,史万贵,詹 芳,付宝权
2.甘肃省动物疫病控制中心,兰州 730046
带科绦虫(T aeniidae)幼虫引起的绦虫蚴病(Larval cestodiasis/infections with larva of cestodes)如棘球蚴病、囊尾蚴病等是一类重要的人兽共患寄生虫病,在我国和世界各地普遍流行,危害严重。本文将对带科绦虫线粒体基因组序列分析的研究进展、应用和今后发展方向做一简要综述。迄今,已完成包括带科绦虫带属7个种、棘球属绦虫5个种(10个基因型)在内共计17个线粒体基因组全序列测定。带科绦虫线粒体基因组的碱基组成、基因结构、基因变异等分析结果为带绦虫线粒体功能基因组学研究、比较基因组学研究、分子分类学研究、分子系统发育进化分析及其疾病诊断等提供了重要依据和指导作用。线粒体基因组序列分析不仅有助于解决一些新近发现的种如亚洲带绦虫(Taenia asiatica)和石渠棘球绦虫(Echinococcus shiquicus)独立种的分类地位,而且为解决细粒棘球绦虫(E.granulosus)各虫株(基因型)如马株(G4)和牛株(G5)等的分类学地位提供了有效途径:马株和牛株与普通绵羊株(G1)线粒体基因组序列差异较大,具有种间核苷酸序列的变异程度,据此应建议独立设种。同时可根据线粒体基因组序列,通过PCR方法有效地对临床上易混淆的带科绦虫的种、基因型等作出确切的鉴别和诊断,从而为带绦虫病的流行病学调查和防治等提供重要依据。
带绦虫蚴病是世界上危害严重的一类人兽共患寄生虫病,由带科绦虫幼虫引起〔1-3〕。带科(Taeniidae)绦虫隶属于扁形动物门(Platyhelminthes)绦虫纲(Cestoda),包括棘球属(Echinococcus)和带属(Taenia)二个属,曾报道的名称种达50多个,其中一部分为同种异名,不少种内还存在一定数目的亚种、变种或者基因型等现象,这给带科绦虫的分类与鉴定等造成了困难。线粒体基因组有许多独特的特征如动物线粒体基因组很小,独立于胞核染色体基因组之外,但又与胞核染色体基因组紧密联系;有相对稳定的基因数目,基本上是母系遗传,很少发生基因重组、基因位置的排列和遗传密码使用上的变化;tRNA的二级结构、碱基组成和变异等有也其自身特点。这为人们研究真核生物的起源和线粒体基因的演化提供了便利条件。线粒体基因组所有这些特征都已经在研究动物物种的分类、基因的进化、现有物种的进化史等方面得到应用〔4〕。传统的形态学方法有时难以对那些形态上相似、但在遗传方面却不同的虫种(隐藏种)加以鉴定。18S核糖体rRNA基因(18S rDNA)、内部转录间隔(ITS1和ITS2)被证明是鉴定绦虫的可靠的遗传标记,但是用线粒体基因来代替18S rDNA和ITS作为分子遗传标记用于分析和鉴定绦虫种类(特别是亲缘关系相近种或者虫株)、研究基因的变异现象等则更为有效。亚洲带绦虫和牛带绦虫18S rDNA序列核苷酸的差异性仅有0.7%,主要差异仅表现为个别碱基发生突变和小片段序列缺失,而线粒体基因组全序列间核苷酸的差异性达5.6%,因而可根据线粒体基因组序列设计引物通过PCR方法较容易地将这两个虫种鉴别开来。
本文对带科绦虫线粒体基因组序列碱基组成、基因结构、密码子使用、基因变异等特点,及其在分子系统发育、虫种的分类鉴定和疾病诊断中的应用等方面进行综述,以期对今后绦虫线粒体基因组研究、分子系统分类、分子进化、分子诊断等提供重要的指导作用。
1 带科绦虫线粒体基因组的一般特征
1.1 线粒体基因组大小及碱基组成 自2000年第一个带属绦虫肥头绦虫(T.crassiceps)线粒体基因组全序列被完整测序后,在带属中已另有6个种(其中我们完成 3个种)的mtDNA 被完整测序〔5-11〕;自1999年第一个棘球属绦虫多房棘球绦虫(E.multiculoralis)线粒体全基因组序列被完整测序后,在棘球属中另有4个种(包括9个虫株或基因型),共计10个线粒体基因组全序列被测定〔12-15〕。带科绦虫mtDNA结构与其它后生动物相似,为双链闭环分子,但更紧凑,核苷酸数目多在13.4 kb~13.8 kb之间,在目前已测序的所有后生动物线粒体基因组中,属于最小的一类;编码区占基因组95%左右,其中蛋白编码区约为74%;富含 AT,含量约70%,带属的AT含量稍高于棘球属AT含量,在4种碱基成分中,T含量最高,其次为A和G,C含量最低,见表1。

表1 已发表的带科绦虫线粒体基因组全序列及其特征
1.2 线粒体基因组的基因组成及排列 带科绦虫线粒体基因组共有36个编码基因,其中编码蛋白质的基因有12个,编码tRNA的基因有22个(其中编码丝氨酸-tRNA和亮氨酸-tRNA的基因有2个,其余18种tRNA分子各有1个,高度体现了密码子兼并性和生物利用资源的节约原则),编码rRNA的基因有2个。约占60%的蛋白编码基因是用于编码NADH-Q还原酶的 7个亚基(nad1~6及nad4L),其余的用于编码细胞色素还原酶的1个亚基(cob)、细胞色素氧化酶的3个亚基(cox1~ 3)和ATP合成酶的1个亚基(atp6),缺少较高等动物所具有的atp8基因。此外,线粒体基因组除1~39 bp小的非编码区外,还含有2个大的非编码区NR1和NR2(NR1,第一非编码区,位于trnY和trnL1基因之间;NR2,第二非编码区,位于nad5和trnG基因之间)。所有基因都位于一条链(即重链)上;基因转录和复制按同一个方向即顺时针方向进行,见图1。这与有体腔的后生动物线粒体基因组基因的转录以两个方向不对称进行不同。蛋白质基因中没有内含子,各蛋白质基因之间一般被tRNA基因分隔开;各个基因之间没有基因间隔或有少数基因间隔,部分基因之间还相互重叠如nad4L和nad4基因之间。tRNA基因呈单一排列如trnH或呈簇排列如trnN-P-I-K。带科绦虫线粒体基因组基因序列排列与扁形动物门中吸虫和线形动物门中线虫相比则较稳定、缺少变化。

图1 带科绦虫线粒体基因组图谱
1.3 tRNA的二级结构 带科绦虫线粒体tRNA长度约为55~76 nt,二级结构有2种形式:(1)多数(18个)为典型的三叶草结构如泡状带绦虫(T.hydatigena)线粒体 trnN,见图 2;(2)trnC、trnS1、trnS2和trnR四个则呈D-loop结构(D-环,缺配对的DHU臂)如泡状带绦虫线粒体精氨酸tRNA,见图2。线粒体tRNA结构相当保守:受体臂由7个碱基对组成;反密码子环由5个配对的碱基对形成的茎和一7个碱基的环组成,反密码子在带科绦虫间高度保守;连接各环的茎之间的碱基数目也比较保守,例如三叶草结构中反密码子环和 T Ψ C环间碱基数目多为4个(1-6个),三叶草结构tRNA的受体臂和D-环间碱基数多为2个(1~3个);D-loop结构中,非配对DHU臂碱基数为7-12个。

图2 泡状带绦虫(T.hydatigena)部分线粒体tRNA二级结构
1.4 NR1和NR2 带科绦虫线粒体基因组在大小上的差异在很大程度上取决于非编码区,尤其是2个主要非编码区的大小。带属NR1也称SNR(短非编码区),其长度基本一致,为64~70 bp;NR2长度为64~194 bp,其中豆状带绦虫(T.pisi f ormis)的NR2最短,只有64 bp,肥头绦虫(T.crassiceps)的NR2最长,为194 bp,见表2。棘球属除细粒棘球绦虫G1型和G4型的NR1长度与带属相似,而其它虫种(株)NR1和 NR2两者长度相近,约为180 bp。

表2 带科绦虫线粒体基因组两个主要非编码区长度变化
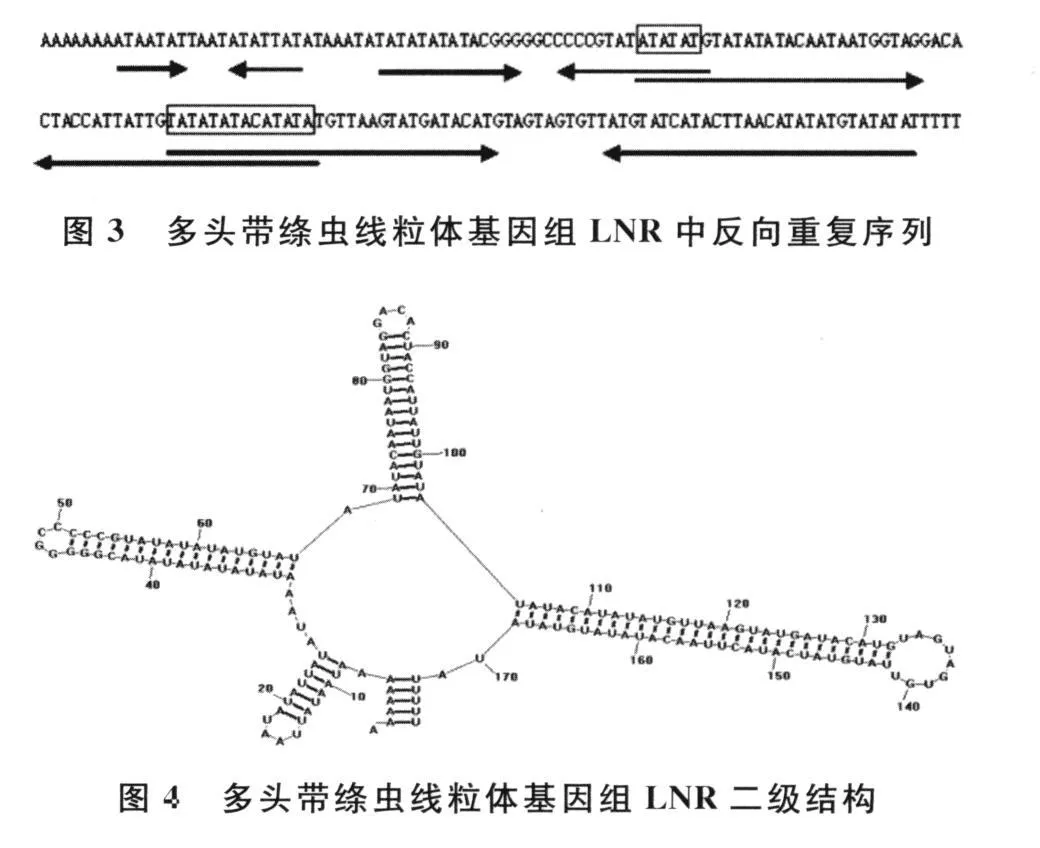
这些非编码区富含反向重复序列和串联重复序列,碱基A和T含量通常特别高(AT富集区),见图3。该区域序列即使是亲缘关系很近的扁形动物物种之间也很少有相似性,核苷酸序列差异很大。但是往往能形成富含茎—环的复杂二级结构,见图4〔9,11-13〕。这些茎-环结构类似于脊椎动物线粒体DNA中D环区附近的3个保守序列CSB1~CSB3,可作为DNA-蛋白质结合时蛋白质(转录起始因子)的结合位点,因此AT富集区被认为对线粒体DNA的复制和转录起着调控作用〔4,16〕。
1.5 密码子使用绦虫的核染色体基因组采用生物体通用遗传密码子,而线粒体基因组采用扁形动物门的线粒体遗传密码子〔17-18〕,具体为:(1)除广泛使用ATG作为起始密码子编码蛋氨酸外,部分基因如泡状带绦虫cox3用GTG作为蛋白质翻译的起始密码子。(2)终止密码子都用TAA和 TAG,有的蛋白质如猪带绦虫的cox1翻译还使用T作为转录终止信号,转录后加工时在T之后再插入AA作为蛋白翻译的终止密码子〔8〕。TGA在核基因组中是终止密码子,但在线粒体基因组中编码色氨酸。(3)AGA和AGG在线粒体编码丝氨酸而非精氨酸。(4)AAA编码天门冬酰胺(Asn)而非赖氨酸(Lys)。
2 线粒体DNA在绦虫分子分类学方面的应用
2.1 在棘球属绦虫分类学中的应用 自从Rudolphi将棘球属(Echinococcus)正式建立独立的一个属以来〔19〕,棘球属内种与种以下阶元之间的分类关系就一直存在着争论。20世纪50年代,Rausch等人将多房棘球绦虫(E.multilocularis)、分布于南美的少节棘球绦虫(E.oligarthrus)和福氏棘球绦虫(E.vogeli)各自立为独立种,而将散布于全世界的其他棘球绦虫种群统归为细粒棘球绦虫(E.granulosus)之后,争论渐趋平息,并获得学者们的公认〔20-23〕。近来,又在我国发现一新种—石渠棘球绦虫(E.shiquicus)。因此,目前公认的棘球属绦虫有5个种〔24〕。即使如此,棘球属绦虫尤其是细粒棘球绦虫种及以下阶元的分类学问题仍存在一定分歧和争议。
关于棘球绦虫的分类,长期以来一直以形态结构作为主要的分类指标,如果形态结构变异不能达到差异显著性,就不能确认为一个独立的种。后来发现在分类中被认为是同一个种的种下阶元其致病性、流行病学特征、发育历程等都存在着较大的区别,加之形态学分类法的不统一性,使得人们重新考虑棘球属绦虫尤其是细粒棘球绦虫的分类方法。随着生物技术的发展,在形态结构的基础上结合其它特征逐渐成为分类学上解决近似种分类的一种方法。目前,棘球属绦虫的分子分类方法主要是基因分析方法,在揭示棘球绦虫种株之间的关系上显示了巨大的应用潜力。
根据基因型的差异,人们将细粒棘球绦虫分为G1~G10十种不同基因型,与形态学、地理分布等传统方法所得到的虫株结果有良好的一致性,不同虫株所寄生的终末宿主和中间寄主稍有不同,其致病性、地理分布等方面存在不同程度的差异〔25-27〕。棘球属绦虫的分类学研究必须在掌握多项指标的情况下重新鉴定种和虫株,以揭示其生物学、遗传学和生理学特征,了解它们在不同地域和不同宿主内的变异特点。这不仅促进寄生虫分类学的进展,而且对人们认识棘球绦虫和棘球蚴病的流行病学及找出合理的预防措施有十分重要的意义。
根据已完成的细粒棘球绦虫线粒体基因组序列,表明马株(G4)与其它虫株间核苷酸差异在10%以上,从这个意义上讲它完全具有独立种的分类学地位 ;牛株(G5、E.ortleppi/E.felidis)与其它虫株间的核苷酸差异在6%以上,也具有独立种的地位。此外,除塔斯马尼亚绵羊株(G2)和水牛株(G3)与普通绵羊株(G1)间核苷酸差异很小外,称细粒棘球绦虫狭义种,而G6、G7、G8和G10与普通绵羊株(G1)间核苷酸差异均超过10%,因此它们应属于新的种〔15,28〕。
2.2 在带属绦虫分类学中的应用 亚洲带绦虫(T.asiatica)以前曾认为是牛带绦虫(T.saginata)的亚种(T.saginata asiatica),因此,其是否为一个独立种一直存在争论。自从Jeon等通过对这两种绦虫的线粒基因组全序列的测定,表明亚洲带绦虫与牛带绦虫线粒体基因组核苷酸序列的差异为5.6%,与猪带绦虫(T.solium)线粒体基因组序列的差异为11%,从而确定了亚洲绦虫新种的独立种地位和这三种绦虫的亲缘关系,并为临床诊断和防治等工作奠定了基础〔7-10〕。
3 在临床分子诊断中的应用
准确的诊断、有效的防治绦虫病取决于对病原的准确鉴定。但是,传统的形态学方法有时不能对那些形态上相似、但在遗传方面却不同的虫种加以鉴定。Yamasaki等利用cox1和nad1基因碱基突变位点上序列设计引物,用多重PCR方法不仅可分别扩增出大小不同的亚洲带绦虫和牛带绦虫cox1基因片段,而且也可分别扩增出大小不同的欧洲型和美洲型猪带绦虫cox1基因片段,这样可有效地将这三种绦虫和猪带绦虫基因型区别开来,这种方法为人绦虫病流行病学调查、临床检测、治疗及防控提供了便利〔29-31〕。
Anantaphruti等〔32〕应用 BSEE T-base reader analysis〔Base excision sequence scanning thyminebase(BESS T-base)reader analysis,碱基切除序列扫描胸腺嘧啶核苷阅读分析〕方法通过对cox1和cob片段上特定位点上胸腺嘧啶核苷酸碱基(T)的扫描可准确地鉴别出三种带绦虫,并对猪带绦虫两种基因型作出鉴别。该方法可以对福尔马林保存的样品标本进行鉴定,这极大方便了样品的保存和处理,降低了操作者被感染的危险。LAMP(Loop-Mediated Isothermal Amplification,LAMP,环介导等温扩增技术)也已逐渐用于宿主粪便、土壤和水源等寄生虫DNA检测,快速、简便(如不需要PCR扩增仪,只需要一个恒温水浴锅即可)、灵敏,适宜于现场大规模流行病学调查和基层推广,显示了良好的应用潜力。Nkouawa等〔33〕以组织酶 L样-半胱氨酸蛋白酶基因(clp)和cox1为目标靶,利用LAMP技术再结合限制性内切酶分析可以有效检测和鉴别人体粪便中猪带绦虫、牛带绦虫和亚洲带绦虫三种绦虫感染,敏感性达到从每克粪便中检出1个拷贝的目标基因或者5个虫卵的水平。
〔1〕蒋次鹏.我国包虫病流行现况〔J〕.中国寄生虫病防治杂志,1996,9(4):290-294.
〔2〕Eckert J,Gemmell MA,Meslin FX,et al.WHO/OIE manual on echinococcosis in humans and animals:A public health problem of global concern〔M〕.World Organization for Animal Health,Paris,France,2001.
〔3〕 M urell KD.Epidemiology of taeniasis and cysticercosis.In Murell KD.WHO/FAO/OIE guidelines for the surveillance,prevention and control of taeniasis/cy sticercosis〔M〕.Paris:OIE,2005:32-44.
〔4〕Boore JL.Animal mitochondrial genomes〔J〕.Nucleic Acids Res,1999,27:1767-1780.
〔5〕Le TH,Blair D,Agatsuma T,et al.Phylogenies inferred from mitochondrial gene orders-a cautionary tale from the parasitic flatworms〔J〕.Mol Bio Evol,2000,17(7):1123-1125.
〔6〕Zarlenga DS,George M.Taeniacrassiceps:cloning and mapping of mitochondrial DNA and its application to the phenetic analy sis of a new species ofTaeniafrom Southeast A sia〔J〕.Exp Parasitol,1995,81:604-607.
〔7〕Jeon HK,Kim KH,Eom KS.Complete sequence of the mitochondrial genome ofTaenia saginata:Comparison withT.soliumandT.asiatica〔J〕.Parasitol Int,2007,56(3):243-246.
〔8〕Nakao M,Sako Y,Ito A.The mitochondrial genome of the tapewormTaenia solium:a finding of the abbreviated stop codon U〔J〕.J Parasitol,2003,89(3):633-635.
〔9〕Jeon HK,Lee KH,Kim KH,et al.Complete sequence and structure of the mitochondrial genome of the human tapeworm,Taenia asiatica(Platyhelminthes;Cestoda)〔J〕.Parasitology,2005,130(Pt 6):717-726.
〔10〕Jeon HK,Eom KS.Taenia asiaticaandTaenia saginata:genetic divergence estimated from their mitochondrial genomes〔J〕.Exp Parasitol,2006,113(1):58-61.
〔11〕Jia WZ,Yan HB,Guo AJ,et al.The complete mitochondrial geomes ofTaenia multiceps,T.hydatigenaandT.pisi formis,additional molecular markers for a tapeworm genus of human and animal health significance〔J〕.BMC Genomics,2010,in press.
〔12〕Nakao M,Yokoyama N,Sako Y,et al.The complete mitochondrial DNA sequence of the cestodeEchinococcus multilocularis(Cyclophyllidea:Taeniidae)〔J〕.Mitochondrion,2002,1(6):497-509.
〔13〕Le T H,Pearson MS,Blair D,et al.Complete mitochondrial genomes confirm the distinctiveness of the horse-dog and sheepdog strains ofEchinococcusgranulosus〔J〕 .Parasitology,2002,124(Pt 1):97-112.
〔14〕Yang YR,Rosenzvit MC,Zhang LH,et al.Molecular study ofEchinococcusin west-central China〔J〕.Parasitology,2005,131(Pt 4):547-555.
〔15〕Nakao M,McManus DP,Schantz PM,et al.A molecular phylogeny of the genusEchinococcusinferred from complete mitochondrial genomes〔J〕.Parasitology,2007,134(Pt 5):713-722.
〔16〕Pham XH,Farge G,Shi Y,et al.Conserved sequence box II directs transcription termination and primer formation in mitochondria〔J〕.J Biol Chem,2006,281(34):24647-24652.
〔17〕Himeno H,Masaki H,Kawai T,et al.Unusual genetic codes and a novel gene structure for tRNA(AG YSer)in starfish mitochondrial DNA〔J〕.Gene,1987,56(2-3):219-230.
〔18〕Telfo rd MJ,Herniou EA,Russell RB,et al.Changes in mitochondrial genetic codes as phylogenetic characters:two examples from the flatworms〔J〕 .Proc Natl Acad Sci USA,2000,97(21):11359-11364.
〔19〕Kumaratilake LM,Thompson RCA.A review of the tax onomy and speciation of the genusEchinococcusRudolphi 1801〔J〕.Z Parasitenk,1982,58:121-146.
〔20〕Rausch R.Studies on the helminth fauna of Alaska.XX.The histogenesis of the alveolar larva ofEchinococcusspecies〔J〕.J Inf Dis,1954,94:178-180.
〔21〕Yamaguti S.Sy stema Helminthum Vol.II.The Cestodes of Vertebrates〔M〕.Interscience Publishers,Inc.New Yo rk.1959,441-442.
〔22〕T hompson RCA,Lymbery AJ,Constantine CC.Variation inEchinococcus:towards a taxonomic revision of the genus〔J〕.Adv Parasitol,1995,35:145-176.
〔23〕Thompson RCA.The tax onomy,phylogeny and transmission ofEchinococcus〔J〕.Ex p Parasitol,2008,119:439-446.
〔24〕Xiao N,Qiu JM,Nakao M,et al.Echinococcus shiquicus,a new species from the Qinghai-Tibet plateau region of China:discovery and epidemiological implications〔J〕.Parasitol Int,2006,55(Suppl):233-236.
〔25〕 Romig T.Epidemiology ofEchinococcosis〔J〕.Langenbecks Arch Surg,2003,388:209-217.
〔26〕Scott JC,Stafaniak J,Pawlowski ZS,et al.Molecular genetic analy sis of human cy stic hydatid cases from Poland:identification of a new genotypic group(G9)ofEchinococcus granulosus〔J〕.Parasitology,1997,114:37-43.
〔27〕Moks E,Jōgisalu I,Valdmann H,et al.First report ofEchinococcus granulosusG8 in Eurasia and a reappraisal of the phylogenetic relationships of‘genotypes'G5-G10〔J〕.Parasitology,2008,135:647-654.
〔28〕Saarma U,Jō gisalu I,M oks E,et al.A novel phylogeny for the genusEchinococcusbased on nuclear data,challenges relationships based on mitochondrial evidence〔J〕.Parasitology,2009,136:317-328.
〔29〕Yamasaki H,Allan JC,Sato MO,et al.DNA differential diagnosis of taeniasis and cysticercosis by multiplex PCR〔J〕.J Clin Microbiol,2004,42(2):548-553.
〔30〕Yamasaki H,Nakao M,Sako Y,et al.Mitochondrial DNA diagnosis for taeniasis and cy sticercosis〔J〕.Parasitol Int,2006,55(Suppl):S81-85.
〔31〕Jeon HK,Chaib JY,Kong Y,et al.Differential diagnosis ofTaenia asiaticausing multiplex PCR〔J〕.Exp Parasitol,2009,121(2):151-156.
〔32〕Yamasaki H,Nakao M,Sako Y,et al.DNA differential diagnosis of human taeniid cestodes by base excision sequence scanning thymine-base reader analysis with mitochondrial genes〔J〕.J Clin Microbiol,2002,40:3818-3821.
〔33〕Nkouawa A,Sako Y,Nakao M,et al.Loop-mediated isothermal amplification method for differentiation and rapid detection ofTaeniaspecies〔J〕.J Clin Microbiol,2009,47(1):168-174.
