仔猪轮状病毒FQ-PCR检测方法的建立*
2010-11-14魏锁成巩转娣宋昌军
魏锁成,巩转娣,宋昌军
2.西北民族大学医学院附属医院,兰州 730030
轮状病毒(Rotavirus,RV)性胃肠炎是流行广泛的人兽共患病,也是多种幼龄动物及婴幼儿的一种急性肠道传染病,以腹泻和脱水为特征,病死率可达50%〔1〕。RV基因由11个不连续的dsRNA节段组成,其平均长度约为660~3 300bp,根据RV群抗原的不同及病毒 RNA末端指纹图谱的分析,可将该病毒共分为A~G 7个群;根据其中和抗原VP7的差异可将A组轮状病毒分为14个G型(G1~G14)及 21个 P 型(P1~P24)〔2-3〕。
结构蛋白VP6是由基因组第6基因编码的内壳蛋白,占轮状病毒结构蛋白总量的80%,全长基因为1 356bp,VP6具有很强的抗原性和免疫性,单克隆抗体证明,VP6能与所有RV株的抗体反应,VP6在不同血清型间高度保守(87%~99%)〔4-5〕,因此是划分RV组和亚组的依据和抗RV理想的疫苗靶位,也是检测到的主要抗原〔6-7〕。
目前尚无治疗动物轮状病毒腹泻的特效药物,疫苗是预防的主要手段〔8〕。虽然人轮状病毒已有口服疫苗,但效力有待提高。鉴于此,本实验拟通过以MA104细胞分离RV,建立猪轮状病毒(procine rotavirus,PRV)VP6基因的实时荧光定量PCR(FQPCR)检测方法,以期为研发快速准确的诊断试剂盒和新型疫苗奠定基础。
1 材料与方法
1.1 实验材料与仪器
1.1.1 样本的采集 在甘肃榆中和庆阳等地猪场采集腹泻仔猪粪便样本42份,于采集管中加入适量保护液,低温冷藏。
1.1.2 细胞株和标准病毒株 罗猴肾细胞株(MA-104)兰州百源基因生物技术公司惠赠,猪轮状病毒参考株(AV-55)购自中国兽医药品监察所兽医微生物菌种保藏中心。
1.1.3 设备仪器 超低温冰箱,日本三洋公司MDF-390 AT;J-25冷冻离心机,Beckman Avanti;酶标仪 spectraMAXM2e型,Molecular devices公司;培养箱(Heal Force)HF160W;倒置显微镜(OLYMPUS);PCR扩增仪,垂直板凝胶电泳仪,高速离心机,基因扩增仪和培养箱等。
1.1.4 试剂及其培养基 轮状病毒诊断试剂盒(ELISA法),兰州生物制品研究所提供;胎牛血清和小牛血清,胰蛋白酶溶液,DMEM(高糖)培养基,MA-104细胞培养液,细胞维持液,病毒处理液,30%丙烯酰胺储存液,EB染色液和胶洗脱液等。
1.1.5 引物的设计与合成 按照荧光定量PCR引物设计原则,利用Primer Premier5.0软件设计合成引物。引物合成由北京百泰克生物有限公司完成。
1.2 实验方法
1.2.1 样本检测与处理 依照轮状病毒诊断试剂盒(ELISA法)的说明检测42份腹泻仔猪的粪便样本,酶标仪测定OD450值。
对阳性样本粪便用1×PBS(0.1mol/L)制成20%悬液,4℃3 000r/min,离心20min,取上清,再4℃,10 000r/min,离心30min。病毒悬液滤过除菌后,缓慢滴加浓度为400g/L的PEG6000,至终浓度70g/L,调节至pH 7.5,4℃冰箱过夜,即得到阳性处理样品(+)。用相同方法制备阴性处理样品(-),作为对照。
1.2.2 MA-104细胞的复苏与培养 培养液含10%小牛血清 +高糖 DMEM,于 37℃5%CO2孵箱,培养2~ 3d。
1.2.3 细胞接毒 取生长良好的MA-104细胞,用处理过的RV接种MA-104细胞,37℃5%CO2孵箱培养2~3d,然后收集。倒置显微镜下观察细胞形态的变化。
1.2.4 病毒纯化 将收集的细胞培养液,反复冻融3次,4℃3 000 r/min离心20 min,取上清液装入透析袋,用蔗糖包埋透析,收集浓缩液,4℃,45 000r/min离心120 min,弃上清液。将沉淀用PBS重新悬浮,经蔗糖不连续密度梯度45 000 r/min 4℃离心180min,收集折光性不同的病毒带,用少量PBS稀释,4℃,同样离心120 min,收集沉淀用少量PBS重悬,即为初步提纯的病毒。
1.2.5 病毒RNA抽提 将阳性、阴性仔猪粪便样品移至1.5mL离心管中,10 000r/min,4℃,离心30min,收集的沉淀用200μ L DEPC-H2O 溶解,加入等体积 2%SDS+0.2mol/L NaAc,室温下放置15min。加入 400μ L 酚-氯仿-异戊醇溶液,摇匀,8 000r/min,10min,取上层水相,按步骤重新抽提一次;再取上层水相(约 200μ L)并加入500μ L无水乙醇和 70μ L 3mol/L NaAc,置 -70℃2h以上。于4℃13 000r/min,离心30min,弃乙醇,收集沉淀。1.2.6 病毒RNA的反转录 采用20μ L反应体系,在 Eppendorf管中依次加入:阳性模板RNA2μ L,Oligo(DT)181μ L,无 RNA 酶去离子水9μ L,Buffer 4μ L,dNTP Mix 2μ L,RNAse Inhibitor 1μ L,AMV 1μ L,混匀,37℃反应 60min 后,70℃反应10min。对阴性样品用相同方法进行反转录。
1.2.7 聚合酶链反应(PCR) 采用 25L反应体系,在Eppendorf管中依次加入:模板cDNA(阳性、阴性 各 1 份)1μ L,PCR 缓冲 液 2.5μ L,dNTP 0.2μ L,上 、下游引 物各 0.2μ L,Taq DNA 聚合酶0.125μ L,ddH2O 19.0μ L。进行 PCR:72℃7min;95℃25s,51℃ 30s,72℃ 30s,35个 循 环;95℃5min。
1.2.8 聚丙烯酰胺凝胶电泳 将纯化、干燥后的阳性样品RT-PCR产物,加入100μ L ddH2O溶解后,再进行电泳。先将丙烯酰胺 2 700L,TBE 1 000L,H2O 6 300μ L,过硫酸铵 70μ L,TEMED 10μ L 溶液混匀,倒入电泳槽内,室温下放置待完全凝固,放入电泳槽中,用TBE冲洗加样孔。在其中一孔中加入Marker,另取阳性和阴性PCR产物各10μ L分别和非变性上样缓冲液10μ L,混匀后分别移至加样孔中电泳;用凝胶成像仪拍照、观察,检测扩增结果。
1.2.9 荧光定量PCR(FQ-PCR)方法检测 用荧光染料SyB配制荧光PCR反应体系,将配制好的荧光PCR体系混匀后分装于1、2、3和4号管中,每管16μ L,对应加入4μ L 模板样品,终体积201(注:1号管加入阳性样品PCR产物;2号管加入10倍稀释后的阳性样品PCR产物;3号管加入为阴性样品PCR产物;4号管加入 4μ L ddH2O作为空白,以排除非特异型扩增及假阳性。)实时荧光定量PCR反应条件与普通PCR相同,即:95℃,5min;35循环(95℃,5s;51℃,30s;72℃,30s)。观察荧光曲线。
1.2.10 引物设计与合成 根据VP6基因序列同源性比对结果,结合寡核苷酸引物设计原则,利用Primer Premier 5.0软件设计引物。见表1。

表1 用于RV VP6基因检测的引物Table 1 The synthesized primer used for detecting VP6 gene
1.2.11 FQ-PCR法与ELISA法结果比较 用本实验建立的FQ-PCR法测定采集的粪便样本,其结果与轮状病毒诊断试剂盒(ELISA法)得结果进行比较。
2 结 果
2.1 粪便样本的检测 42份腹泻猪粪便样本OD450值的测定,判断出编号为9、11、14、23和29号样本为阳性,检出率为11.91%。
2.2 病毒培养、分离 取阳性粪样5份分别接种MA 104细胞,接毒后传代18h出现明显的细胞病变(CPE),细胞膜缩融合、细胞层裂开、出现细胞核固缩,空泡化、染毒的细胞出现大片脱落区域,最后细胞死亡脱落。随传代次数增加,病变程度加深,CPE出现时间加快。结果分离到 1株轮状病毒。见图 1、2。

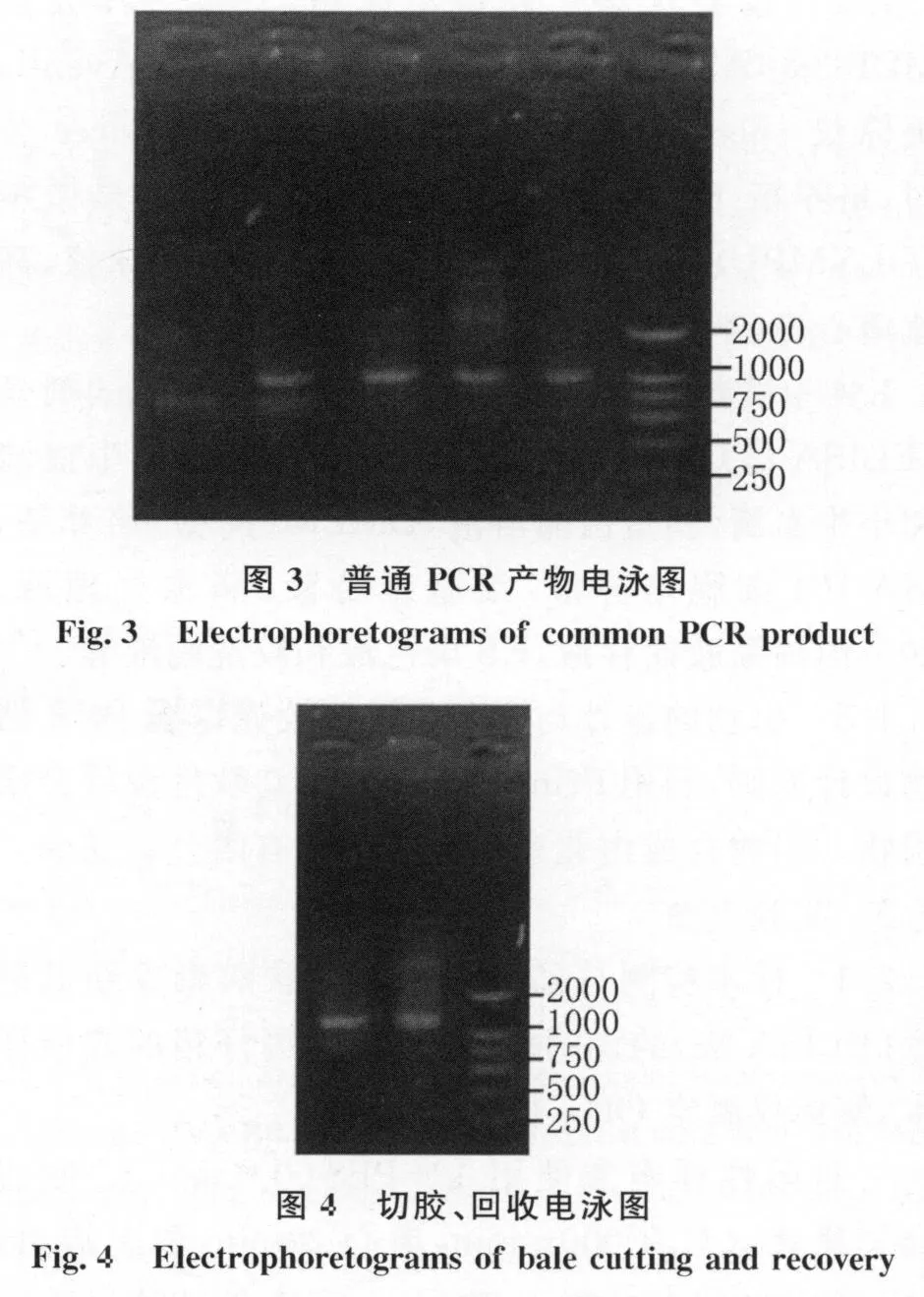
2.3 聚合酶链反应(PCR)及产物的验证 先进行普通PCR扩增,验证引物的特异性。从阳性粪便样本中提取RNA,以此为模板,结果得到约1 200bp的条带表明产物与预期条带相符(图3)。将回收、纯化、干燥后的阳性样品PCR产物,重复PCR反应,结果见图4。
2.4 核苷酸序列测定及同源性比较 经对分离的轮状病毒株VP6核苷酸序列测定,得到约1 200bp的VP6片段,与猪轮状病毒参考株(AV-55)的同源性达88.50%。初步确定为猪猪轮状病毒(PRV),暂命名为GS01毒株。
2.5 实时定量PCR检测 实时荧光定量PCR(FQ-PCR)的结果(见图5)表明,阴性样品与空白对照的荧光均为直线,而阳性样品荧光曲线在15个循环后明显上升,且曲线升高的幅度与模板浓度呈正比。

图5 实时定量PCR曲线图Fig.5 Curve of FQ-PCR for porcine rotavirus
2.6 FQ-PCR法测定结果及比较 对52份样本检测,发现5份阳性粪样,与ELISA法相同,但FQPCR法的灵敏度比普通PCR高数十倍。FQ-PCR比普通PCR和ELISA法更有优势。
3 讨 论
3.1 猪轮状病毒的MA-104细胞培养特性 细胞分离培养是研发轮状病毒疫苗的关键环节。但是,由于RV表面的VP4能抑制病毒在细胞中的生长,因此轮状病毒在一般组织培养中不能适应,需选用特殊的细胞株培养,多数研究认为MA-104细胞是动物RV生长最适宜的细胞〔9〕,因此我们选用了该细胞系。
此外,有研究〔10〕表明,在接种病毒后转瓶培养易出现CPE,但我们在实验中发现,采用静置培养,出现CPE的时间及CPE的程度与转瓶培养结果无太大的区别,即静置培养完全可以达到一般实验目的的要求,这与王鹏雁等(2002)〔11〕和苏小庚(2005)〔12〕的报道一致。也与鱼轲等(2007)用牛肾原代细胞培养轮状病毒的效果相似〔13〕。
Vp6蛋白作为RV重要的组抗原和亚组抗原,用抗Vp6抗体的间接免疫荧光法能准确地检测轮状病毒抗原,为病毒在组织和细胞中的定位检测带来方便,对于病毒在细胞内的增殖与组装的研究具有指导意义。Vp6蛋白在病毒感染的早期就开始合成,并在细胞质中呈弥散分布,随着感染时间的增加(12h后),Vp6蛋白主要以颗粒状分布于细胞核四周,大部分参与了病毒颗粒的组装〔14〕,这也可以解释细胞病变的时间是在接毒传代后18后出现。
3.2 分离株的同源性 本实验对ELISA检测试剂盒测定的5份阳性粪样分别接种MA-104细胞,CPE达到90%时收毒,分离到1株轮状病毒。且对分离的病毒株纯化、VP6核苷酸序列测定,得到1 200个核苷酸序列片段,与猪轮状病毒参考株(AV-55)的同源性达88.5%,初步确定为猪猪轮状病毒(PRV)。
3.3 荧光定量PCR与条件的优化 我们在建立了犬轮状病毒检测方法的基础上〔15〕,建立的FQ-PCR快速检测方法,其灵敏度比普通PCR高数十倍,且荧光定量PCR具有引物和探针双重保证。因此,无论从检测灵敏度、特异性,还是抗污染、省时省力方面,FQ-PCR比普通PCR和ELISA技术更有优势。荧光定量PCR技术的关键是设计好特异引物和探针,而该引物和探针应位于靶序列的高度保守区。只有这样,设计的引物和探针才能避免漏检。
目前将FQ-PCR用于检测动物 RV的研究少见。Pang等以SYBR Green I染料提供荧光信号,针对 RV NSP3进行检测〔16-17〕。本实验也用SYBR Green I为荧光染料,以 RV保守序列VP6基因为扩增靶标,建立了实时PCR法。荧光染料的优势在于能监测各种双链DNA序列的扩增,无需设计探针,方法简便,成本低廉。
尽管有文献报道,大多数情况下可以将优化的普通PCR条件直接用于荧光定量PCR,但实验表明,荧光定量PCR与传统PCR一样,也需要进行反应体系的优化〔18-19〕。
〔1〕魏锁成.动物轮状病毒病的流行病学及综合防治〔J〕.甘肃畜牧兽医,2005,27(3):27-28.
〔2〕王正党,单文鲁,黄家驷,等.新疆幼畜和人非典型轮状病毒的调查和鉴定〔J〕.病毒学报,1995,11(4):336-342.
〔3〕源宣之.轮状病毒感染的研究进展〔J〕.广西畜牧兽医,2000,16(4):41-43.
〔4〕肖玮,钱渊,张又.引起产科新生儿腹泻爆发的轮状病毒株VP4、VP7编码基因与毒力关系的探讨〔J〕.病毒学报,1999,15(4):314-321.
〔5〕Lements,Richard L Ward.Antibody-Independent Protection against Rotavirus Infection of Mice Stimulated by Intranasal Immunization with Chimeric VP4 or VP6 Protein〔J〕.Journal of Virology,2001,73(9):7574-7581.
〔6〕Ram I R.Pathogenesis of intestinal and systam in rotavirus infection〔J〕.Journal of Virology.2004,78(19):10213-10220.
〔7〕江志奎,李忠泽.轮状病毒疫苗的研究进展〔J〕.中国生物制品杂志,2000,13(1):61-62.
〔8〕刘丽利,黄永坤,魏群德.轮状病毒感染的研究进展〔J〕.医学综述,2004,10(12):759-762.
〔9〕李金慧,誉自强,孙文敏,等.MA-104细胞牛轮状病毒受体的提纯及鉴定〔J〕.中华实验和临床病毒学杂志,1998,12(3):265-268.
〔10〕Fukusho A,Shixnizu Y,Ito Y.Isolation of Cytopathic Rotavirus in cell roller culture in the presence of T ry psin〔J〕 .Arch Virol.1981,69:49-60.
〔11〕王鹏雁,陈创夫.猪轮状病毒的细胞培养〔J〕.石河子大学学报(自然科学版),2002,6(4):281-284.
〔12〕苏小庚,吴周良,王正秀,等.犊牛轮状病毒的分离鉴定〔J〕.河北农业大学学报,2005,28(4):93-100.
〔13〕鱼轲,魏至栋,庞兴,等.不同代次牛肾原代细胞培养轮状病毒的比较研究〔J〕.微生物学免疫学进展,2007,35(4):1-5.
〔14〕尹兴晓,文喻玲,赵庆欢,等.轮状病毒VP6蛋白的免疫荧光检测〔J〕.中国生物制品学杂志,2008,21(5),434-437.
〔15〕魏锁成,何丽.犬轮状病毒荧光定量 RT-PCR检测方法的建立〔J〕.中国动物检疫.2009,26(5),38-41.
〔16〕源宣之.轮状病毒感染环的研究进展〔J〕.广西畜牧兽医,2000,16(4):41.
〔17〕Chizhikov V,Wag ner M,Ivshina A,et al.Detection and genotyping of human group A rotavirus by oligonucleotide〔J〕.J Clin Micobiol,2002,40:2389-2407.
〔18〕邓小红,任海芳.PCR技术详解及分析〔J〕.重庆工商大学学报,2007,24(1):29-33
〔19〕蒋奎荣,刘训良.荧光定量PCR技术及其在肿瘤研究中的现状〔J〕.医学综述,2003,9(5):288-289
