新鲜和陈化莲籽化学成分和功能特性的比较
2010-11-12张旻罗丽萍丁红秀谢克强
张旻,罗丽萍,丁红秀,谢克强
(1.南昌大学生命科学与食品工程学院,江西南昌,330031;2.江西师范大学生命科学学院;3.江西广昌县白莲科学研究所)
莲(Nelumbo nuciferaGaertn.)为多年生水生草本植物,是我国特产,全国种植面积达10万hm2,主要分布在长江流域及其以南地区。莲籽为莲的干燥成熟种子,全国年产量达9 000万kg。莲籽含有丰富的营养物质,有补脾、益肺、益肾、润肠、养心、固精等多种功效,是一种老少皆宜的食疗佳品和著名的药食同源食物。
与其他谷物一样,长时间的贮藏会导致莲籽的陈化和品质劣变,当年新鲜莲籽与贮藏陈化莲籽蒸煮后表现明显不同,后者蒸煮后硬度上升、粘度下降,不论口感、品质还是烹调时间都不及当年新鲜莲籽。这一现象表明,莲籽在贮藏过程中发生了质构、组分等理化改变,从而导致其感官品质变化,即陈化。陈化后的莲籽的营养价值、食味和加工品质下降,给国民健康及国民经济带来重大的损失。
目前,国外对莲籽的研究主要集中在其提取物的抗氧化作用方面[1~2]。国内有关于莲籽主要成分的测定和提取、莲籽功效成分、食品加工和育种等方面的研究报道[3~5],虽有研究涉及莲籽淀粉品质特性[6],但通过对比新、陈莲籽的化学成分和功能特性变化,从而探讨其陈化机理,目前在国内外还未见文献报道。而对于大米[7]、玉米[8]等谷物陈化指标的判定及陈化机理已经有了较深入的研究。本文以新鲜和陈化的广昌产通心白莲为试验材料,较为系统地研究了2种莲籽的化学成分和功能特性变化,并对莲籽的陈化机理进行了初步的分析。研究结果可以为通心白莲贮藏和保鲜提供理论基础,为合理的储藏方法提供参考,为生产实践中莲籽的品质检验及监测提供依据,并为今后莲籽蛋白质食品和食品添加剂的开发应用提供基础性支持。
1 材料与方法
1.1 试验材料
新鲜和陈化的广昌通心白莲:由江西省广昌县白莲科学研究所提供。新鲜莲籽为2008年8月收获;陈化莲籽为贮藏1 a以上。两种莲籽在100℃沸水中煮相同时间(>60 min),新鲜莲籽口感软糯,汤汁粘稠,陈化莲籽口感脆硬,汤汁稀薄,延长煮沸时间,仍未改善。
分别将2种莲籽经粉碎后过80目(孔径0.175 mm)筛,再装入玻璃试剂瓶中,4℃冷藏备用;食用调和油:金龙鱼牌,南海油脂工业(赤湾)有限公司;其他试剂为国产分析纯。
试验仪器和设备有:1200型高效液相色谱仪(包括在线脱气装置,四元泵,柱温箱,光电二极管阵列检测器(DAD),G2170BA LC化学工作站),美国Agilent生产;KQ3200DE型数控超声波清洗器,昆山市超声仪器公司生产;UV-1700紫外可见分光光度计,SHIMADAZU;索氏提取器,四川蜀玻集团有限责任公司生产;KDN-044定氮仪,上海昕瑞仪器仪表有限公司生产;TDL-5-A台式离心机,上海安亭科学仪器厂;HH-6数显恒温水浴锅,国华电器有限公司生产;RE-52旋转蒸发仪,上海亚荣生化仪器厂生产;G2X-DH50电热恒温干燥箱,上海跃进医疗器械厂生产;HR1727搅拌机,飞利浦公司生产;JA1003N电子分析天平,上海精密科学仪器有限公司生产。
1.2 试验方法
①化学成分含量的测定 水分:根据GB/T5009.3-1985《食品中水分的测定方法》测定。蛋白质:根据GB/T5009.5-2003《食品中蛋白质的测定》测定。巯基:Ellman法[9]。粗脂肪:参照GB/T14772-2008《食品中粗脂肪的测定》,先用无水乙醚浸提16 h,再进行索氏提取。脂肪酸值:根据GB/T15684-1995《谷物制品脂肪酸值测定》法。直链淀粉和支链淀粉:双波长法[10]。
②醇提取物的HPLC分析 a.色谱条件。色谱柱:ZORBAX Eclipse XDB C18 色谱柱(4.6 mm×150 mm×5 μm);流动相为甲醇-0.1%甲酸,梯度洗脱,其时间程序为 0 min→8 min→14 min→19 min→22 min→26 min→28 min→33 min→38 min。甲醇含量0%→24%→30%→35%→40%→42%→44%→65%→25%,流速 1.0 mL/min,DAD 检测波长为 280 nm,进样量 20 μL,柱温35℃。
b.供试品制备。精密称取5 g莲籽粉末,加80%(v/v)甲醇溶液20 mL,室温超声提取30 min,过滤,用80%甲醇溶液定容至25 mL,冰箱中冷藏保存。经0.45 μm微孔滤膜过滤后进液相。采用中药色谱指纹图谱相似度评价系统软件统计新鲜和陈化莲籽HPLC指纹图谱之间的相似度。
③功能特性的测定 a.吸水性(water absorption capacity,WAC) 和吸油性(oil absorption capacity,OAC)。分别称取1 g新鲜和陈化的莲籽粉于离心管中,分别加入水或油10 mL涡旋振荡混合30 s,室温静置30 min后,以3 000 r/min离心30 min,计算每克样品吸水和吸油的体积[11]。
b.乳化性(emulsion activity,EA)与乳化稳定性(emulsion stability,ES)。取 5 mL 莲籽粉与蒸馏水制成的悬浊液(10 mg/mL)和5 mL食用调和油均质1 min形成乳状液,再以1 500 r/min离心5 min,记下乳化层高度,乳化能力的计算公式为:乳化性(%)=(乳化层高度/总高度)×100%[12]。
将乳状液置于80℃水浴中加热30 min后,以1 500 r/min离心5 min。记下加热后乳化层的高度,计算其乳化稳定性。乳化稳定性的计算公式为:乳化稳定性(%)=(加热后乳化层高度/加热前乳化层高度)×100%。
c.发泡性(foaming capacity,FC)和泡沫稳定性(foam stability,FS)。分别称取2 g新鲜和陈化的莲籽粉,加入100 mL蒸馏水,在搅拌机中进行高速匀质3 min,均质停止后随即记下泡沫的体积,计算发泡性。发泡性的计算公式为:发泡性(%)=(均质停止时泡沫体积/100)×100%。
匀质停止30 min后,记下此时泡沫体积,泡沫稳定性的计算公式为:泡沫稳定性(%)=(30 min后的泡沫体积/均质停止时泡沫体积)×100%。
d.胶凝性。在pH值为7.0的条件下,分别将不同质量的新鲜和陈化莲籽粉加入10 mL蒸馏水中,制成不同浓度梯度的悬浊液,在沸水浴中加热1 h,待完全冷却后放入4℃下静置1 h。用将样品反转不滑落的方法来确定最小胶凝浓度(least gelation capacity,LGC)[13]。

表1 新鲜和陈化莲籽的化学成分含量
1.3 数据处理
测定样品设3个平行样,所有数据经统计学处理后用平均值±SD表示,结果用SPSS软件进行方差分析。
2 结果与分析
2.1 新鲜和陈化莲籽化学成分的比较
新鲜和陈化莲籽的化学成分的含量测定结果见表1。
由表1可知,2种莲籽的含水量差异未达显著水平,陈化莲籽的含水量稍高,可能是因为贮藏过程中吸收了少量水分。蛋白质含量基本没有变化,而粗脂肪含量下降幅度稍大。总体来说,水、蛋白质和粗脂肪含量的变化都不是十分显著,这与大米陈化过程中化学成分变化相似[14]。说明水分、蛋白质、粗脂肪含量的变化不是莲籽产生陈化现象的主要原因,莲籽的陈化更可能是其化学成分内部结构,或化学成分间相互作用发生变化造成的,也说明各成分的微观结构变化可能是莲籽功能特性变化的主要原因。
蛋白质中的巯基含量显著降低,极有可能氧化形成二硫键[15],从而增加肽链的交联程度,使蛋白质的强度增大,并可与淀粉形成更加牢固的复合体,导致淀粉糊化难度增大,使莲籽不易煮烂。本试验表明,陈化莲籽巯基含量显著降低。脂肪酸值常被用作测试谷物新鲜度的重要指标[7],脂类在解脂酶和脂肪氧化酶的作用下,脂类的双键被打开,成为游离脂肪酸,导致蒸煮品质下降,并可由于进一步的氧化水解,形成醛、酮等挥发性羰基化合物,产生异味[8]。本试验表明,陈化莲籽脂肪酸值显著升高。
对谷物而言,一般认为直链淀粉含量更能影响谷物品质,特别是蒸煮食味品质,与吸水性、膨胀特性和蒸煮品质等直接有关。陈化莲籽的直链淀粉含量显著升高,支链淀粉含量显著下降,与前人对稻米陈化的研究结果基本一致[7],有报道认为由于在贮藏稻谷中脱支酶仍保持其活性,作用于1,6-糖甘键使支链淀粉脱支,使支链淀粉含量下降[16]。据此推测,莲籽淀粉在相关酶类的作用下被缓慢降解,导致支链淀粉含量下降,而部分支链淀粉转变为直链淀粉,使直链淀粉增加。
2.2 新鲜和陈化莲籽的HPLC分析
新鲜和陈化莲籽的甲醇提取物HPLC色谱图见图1。经统计相似度达到0.995,说明两者一些醇溶性的化学成分含量和组成差异不显著。莲籽中的醇溶物质主要是一些极性的次生代谢产物,这些物质在储存过程中未发生明显变化。由于农产品贮藏过程中微生物的滋生会造成次生代谢产物改变或积累。所以初步推断,莲籽的陈化不涉及次生代谢产物的变化,也与微生物没有明显的直接关系。
2.3 新鲜和陈化莲籽功能特性的比较
新鲜和陈化莲籽的几种功能特性测定结果见表2。
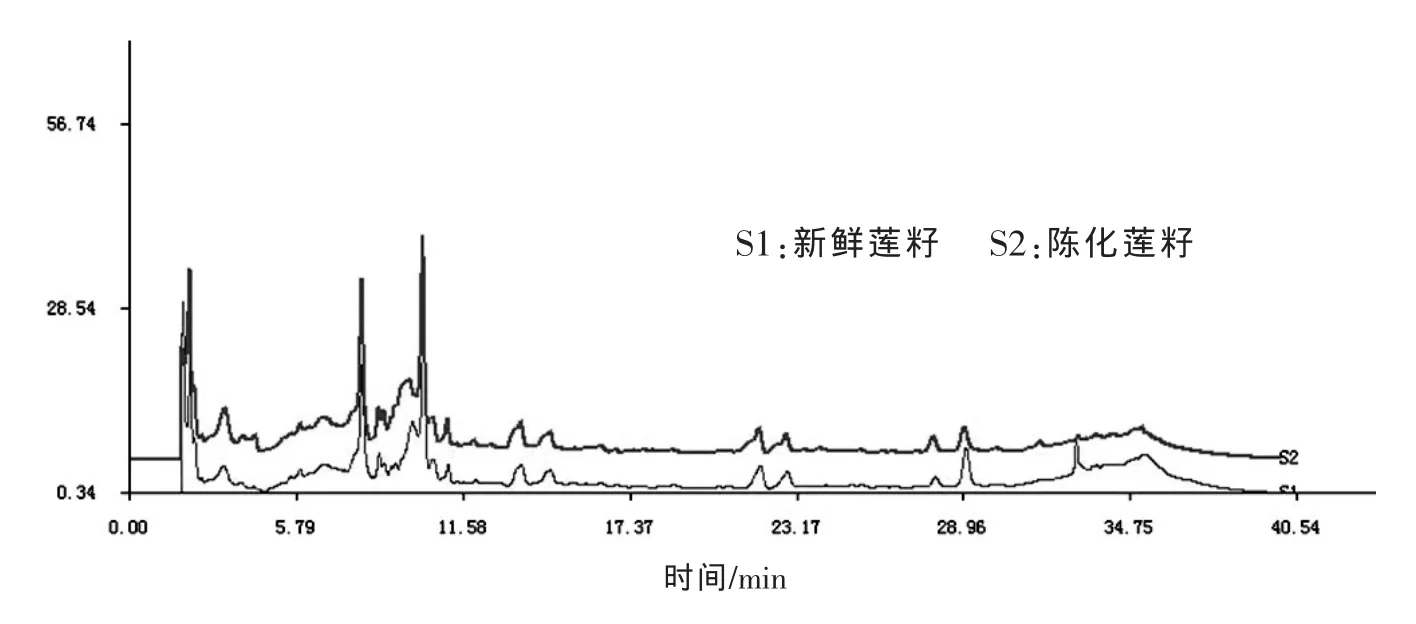
图1 新鲜和陈化莲籽的醇提取物HPLC色谱图(相似度:0.995)

表2 新鲜和陈化莲籽的功能特性
①吸水性和吸油性 由表2可知,新鲜和陈化莲籽在吸水性和吸油性方面存在显著差异,陈化莲籽的吸水性和吸油性低于新鲜莲籽,分别从(1.30±0.3) mL/g 和(1.73±0.21) mL/g 降低到(0.83±0.06)mL/g 和(1.40±0.15)mL/g。新鲜莲籽的蛋白质中含有大量的极性氨基酸,而在陈化过程中,极性氨基酸的含量逐渐减少,从而导致陈化后莲籽的吸水性下降。蛋白质的吸水性和吸油性与其分子表面亲脂、亲水基团的暴露数量、蛋白质分子物理截留作用等有关,说明陈化过程中,莲籽蛋白质的构象可能发生了改变。莲籽中总淀粉含量达到60%以上,且陈化前后的直链淀粉和支链淀粉含量有显著变化,淀粉发生糊化也会对吸水作用产生一定的影响。
②乳化性与乳化稳定性 乳化性是蛋白质在促进油水混合时,单位质量的蛋白质能够稳定的油水界面的面积。乳化稳定性是蛋白质维持油水混合不分离的乳化特性,对外界条件的抗应变能力。蛋白质具有乳化剂的特征结构,即两亲结构,同时含有亲水基团和亲油基团,能够降低水和油的表面张力。陈化导致蛋白质结构变化,会影响乳化能力的高低。由表2可知,陈化莲籽的乳化性和乳化稳定性较新鲜莲籽显著下降。
乳化剂溶液的柔韧性,如溶解能力、表面吸附能力和疏水区域的暴露,通常是决定蛋白质乳化性的重要方面。乳化性的显著降低再次证明,陈化莲籽的巯基含量显著下降,极有可能是形成了二硫键[15],因为蛋白质中的二硫键被还原,可增大分子的柔韧性,改进表面性能,增强乳化和乳化稳定性[17]。所以莲籽在其陈化过程中,也可能存在由蛋白质二硫键增加导致的蛋白质结构变化。
③发泡性和泡沫稳定性 蛋白质的发泡性即蛋白质能降低气-液界面的表面张力而帮助形成起泡的能力。泡沫稳定性是蛋白质维持泡沫稳定存在的能力。由表2可见,陈化莲籽的发泡性和泡沫稳定性均下降,发泡性和发泡稳定性分别从(245±14.80)% 和(26.22±0.60)% 下降到(226±0.29)%和(24.89±1.27)%。这一方面可能与乳化性和乳化稳定性的改变原因相似,另一方面,也与蛋白质因陈化导致分子内部的疏水基团暴露程度发生变化有关。
④胶凝性 胶凝作用是在适当条件下(如加热、酶作用和二价金属离子参与等),溶液从“溶液状态”转变成“凝胶状态”。蛋白质在加热条件下,分子间发生交联,形成空间立体网络结构[18],这种结构具有很大的网络空隙,能容纳大量的水分和油脂,具有一定的形状和弹性[19]。胶凝性的变化是蛋白质分子构象变化的一个体现,本文采用最小胶凝浓度来体现莲籽胶凝性的高低。由表2可知,陈化莲籽的胶最小胶凝浓度从6.8%下降到7.2%,说明陈化莲籽的胶凝性下降。
有研究表明,用亚硫酸钠还原大豆分离蛋白,可减少二硫键含量,降低蛋白质分子的交联程度,可使凝胶强度降低[20],说明二硫键改变对蛋白质的胶凝性存在影响,说明陈化莲籽中巯基含量降低,可能是交联形成了二硫键。纯莲籽蛋白的最小胶凝浓度为10.5%[21],大大高于本文中莲籽粉的最小胶凝浓度,这是因为莲籽中含有的淀粉影响了莲籽的胶凝性。而淀粉种类也对胶凝性有较大影响,一般来说,直链淀粉含量越高,分子越小,形成的凝胶强度越大;支链淀粉分子越小,或分子大小一定时,分支化程度越高凝胶强度越强[22]。这又与莲籽直链淀粉含量显著增加和支链淀粉含量显著降低密切相关。
3 结论
①通过对新鲜和陈化莲籽的化学成分、醇提物HPLC图谱和功能特性的对比研究发现,两种莲籽的水分、粗脂肪、蛋白质含量及醇提取物HPLC图谱相似度差异都不显著,但其他化学成分有显著差异,功能特性也体现了较大差异。陈化莲籽的脂肪酸值、直链淀粉含量显著增加,支链淀粉和巯基含量显著降低;吸水性和吸油性、乳化性和乳化稳定性、发泡性和泡沫稳定性、胶凝性等功能特性指标方面都有不同程度的下降。
②贮藏使莲籽的功能特性发生了改变,从而发生陈化。这些功能特性与莲籽各成分和内部结构,或各成分之间的相互作用有密切联系。本文研究结果表明,陈化莲籽表观性状和功能特性的改变,其根本原因可能是莲籽中蛋白质巯基交联形成二硫键、蛋白质亲水、疏水基团的暴露数量及直链、支链淀粉的含量和淀粉颗粒的变化等原因,这对莲籽陈化机制的阐明和证实指明了一定的方向和提供了一定的参考。
[1]Yen G C,Duh P D,Su H J,et al.Scavenging effects of lotus seed extracts on reactive nitrogen species[J].Food Chemistry,2006,94:596-602.
[2]Rai S,Wahile A,Mukherjee K,et al.Antioxidant activity of Nelumbo nucifera(sacred lotus)seeds[J].Journal of Ethnopharmacology,2006,104:322-327.
[3]郑宝东,郑金贵,曾绍校.我国主要莲子品种营养成分的分析[J].营养学报,2003,25(2):153-156.
[4]郑宝东,郑金贵,曾绍校.我国主要莲子品种中三种功效成分的研究[J].营养学报,2004,26(2):158-160.
[5]刘楠,乔旭光,赵艳艳.微山湖野生白莲子淀粉的性质研究[J].食品科学,2008,29(2):151-154.
[6]曾绍校.莲子淀粉品质特性的研究与应用[D].福州:福建农林大学,2007.
[7]高瑀珑,鞠兴荣,姚明兰,等.稻米储藏期间陈化机制研究[J].食品科学,2008,29(4):470-473.
[8]周显青,张玉荣,张勇.储藏玉米陈化机理及挥发物与品质变化的关系[J].农业工程学报,2008,24(7):242-246.
[9]田其英,谌卉,华欲飞.Ellman’s试剂测定脱脂豆粕中巯基含量[J].食品与生物技术学报,2008,27(6):107-110.
[10]金玉红,张开利,张兴春,等.双波长法测定小麦及小麦芽中直链、支链淀粉含量 [J].中国粮油学报,2009,24(1):137-140.
[11]Bhat R,Sridhar K R.Nutritional quality evaluation of electron beam-irradiated lotus (Nelumbo nucifera)seeds[J].Food Chemistry,2008,107:174-184.
[12]Coffman C W,Garcia V V.Functional properties and amion acid content of protein isolate from mung bean flour[J].Journal of Food Technology,1977,12(5):473-484.
[13]Neto V Q,Narain N,Silvia J B,et al.Functional properties of raw and heat processed cashew nut(Anacardium occidentaleL.)kernel protein isolate [J].Nahrung,2001,45(4):258-262.
[14]伍金娥,常超.稻谷储藏过程中主要营养素变化述评[J].安徽农业科学,2008,36(3):921-922,932.
[15]卞科,路茜玉.大米陈化过程中二硫键变化与蒸煮大米质构特性的关系[J].中国粮油学报,1992(4):38-40.
[16]邱明发,金铁成,周瑞芳,等.米谷蛋白与淀粉组分在大米陈化过程中的变化 [J].中国粮油学报,1998,13(1):12-15.
[17]齐军茹,彭志英.蛋白乳化活性与分子结构的关系[J].中国食品添加剂,2004(2):52-55.
[18]Meng G T,Ma C Y.Thermal gelation of globulin fromPhaseolus angularis(red bean)[J].Food Res Int.2002,35(4):377-385.
[19]江志伟,沈蓓英.蛋白质加工技术[M].北京:化学工业出社,2002:126-132.
[20]Petrucceli S,Anon M C.Partial reduction of soy protein isolate disulfide bonds[J].Agric Food Chem,1995,43(8):2 001-2 006.
[21]张羽.莲子中蛋白质的分离及其食品功能特性研究[D].南京:南京师范大学,2008.
