茭白膨大前后肉质茎中抗坏血酸含量变化初探
2010-11-12刘伟邓建平郭得平黄建中
刘伟,邓建平,郭得平,黄建中
(1.浙江大学原子核农业科学研究所,农业部、浙江省核农学重点实验室,浙江杭州,310029;2.缙云县农业局;3.浙江大学农业与生物技术学院)
茭白(Zizania latifoliaTurcz.)肉质茎是黑粉菌(Ustilago esculentaP.Henn.) 侵染茎尖组织并在其中大量繁殖后诱导所形成的[1~3]。植物组织受病原菌侵染后的一个早期防御反应是活性氧的积累,后者会对细胞组分产生氧化损伤,造成氧化胁迫,并有可能限制病菌侵染[4]。因此病菌侵染后,植物细胞中对活性氧进行清除的体系将相应地活跃。高等植物细胞清除活性氧体系包括抗氧化剂,如抗坏血酸和谷胱甘肽等,以及清除活性氧酶系,如超氧化物岐化酶(SOD)、抗坏血酸过氧化物酶(APX)和过氧化氢酶(CAT)等[4]。
对茭白肉质茎组织中的一些酶活力研究表明,SOD和CAT酶活力在茭白膨大期间呈持续下降趋势[5~6]。由于目前茭白植物组织与黑粉菌互作的分子机制尚未得到阐明,黑粉菌侵染植物组织后是否会引起后者的氧化胁迫并不清楚。本试验选取茭白膨大前后茎尖组织,对其MDA含量、抗坏血酸含量变化作了初步研究,并与叶片中的含量作了比较,以期从氧化胁迫角度初步探讨其对茭白膨大的影响。
1 材料与方法
1.1 试验材料
材料选用双季茭白品种浙茭991,种植于浙江大学华家池校区试验农场,常规管理。2009年9~10月在膨大期间采样,膨大天数根据已报道的方法判断[5],并于称质量后,取质量相近的3~10个茎尖(肉质茎)作为试样。叶片采自植株倒数第3叶(成熟叶),取上半部分。材料剪切成小块段后装管,立即加入液氮,再转移至-70°C低温冰箱中保存备用。
1.2 试验方法
丙二醛(MDA)含量测定采用硫代巴比妥酸法,参照朱其松等[7]的方法。抗坏血酸(AsA)与脱氢抗坏血酸(DHA)含量测定参照Gillespie等[8]人的方法。
2 结果与分析
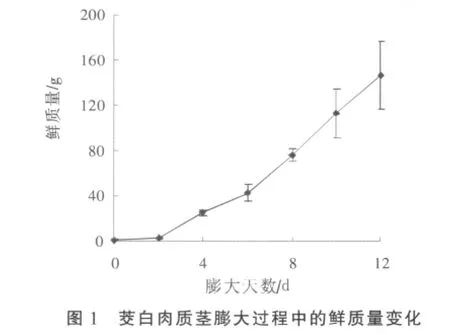
2.1 茭白肉质茎膨大期间的鲜质量变化
双季茭白品种浙茭991的单茭质量可达150 g以上,膨大开始2 d内鲜质量增加很小,但此后质量迅速增加(图1)。这种先慢后快的生长特征,与之前报道的浙茭2号[5]相似,后者在快速生长之后又变慢,符合Logistic函数。本试验没有采收膨大后期的肉质茎,故快速膨大期之后的慢速期没有观察到,不过浙茭991品种膨大12 d的肉质茎已开始显露“茭眼”。
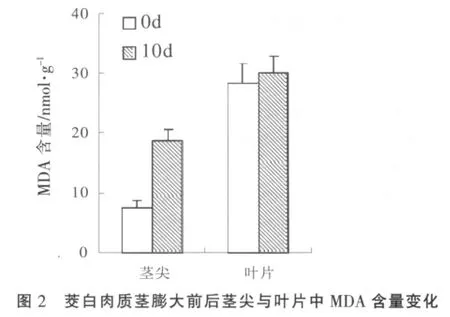
2.2 茎尖与叶片丙二醛含量变化
茭白肉质茎膨大10 d左右的茎尖MDA含量大幅度上升,是未膨大时的2倍多,而同时期叶片的MDA含量没有显著变化(图2)。
2.3 茭白肉质茎抗坏血酸含量与化学形态变化
茭白膨大后肉质茎组织中的还原型抗坏血酸(AsA)及总抗坏血酸(tAsA)含量下降至未膨大时的1/4,但氧化型抗坏血酸(脱氢抗坏血酸,DHA)占总抗坏血酸的比例显著上升(图3)。
3 讨论
茭白肉质茎的快速膨大在组织细胞水平上表现为薄壁细胞数量的增加和体积的增大,菌丝体侵染形成的粘液腔也在膨大肉质茎中占据相当体积[2,9]。虽然在菌丝体附近的薄壁组织细胞分裂可持续到膨大后期[9],从肉质茎的体积和质量变化情况分析,前期主要是细胞数目的增加,而后期以体积增大为主[5],这也与肉质茎内源激素含量的变化相符合[10]。
MDA是膜脂过氧化产物之一,茭白肉质茎膨大后MDA水平的大幅增加反映出茭白膨大期间肉质茎受到氧化胁迫。前人的研究[1~2]表明,黑粉菌并不侵入成熟叶片组织,因此膨大期间叶片并未受到病菌侵染引起的氧化胁迫,其MDA基本维持在原来水平。
抗坏血酸在植物组织中含量较高,在质外体空中以毫摩尔浓度存在,是重要的抗氧化剂。细胞通过 “抗坏血酸-谷胱甘肽循环”可以有效清除活性氧,并再生还原型抗坏血酸[4],此外,抗坏血酸也可以通过生物合成途径产生[11]。植物感病后的早期防御反应是引发氧化暴发(oxidative burst)[4],质膜上的NADPH氧化酶和胞壁POD可能是质外体活性氧的主要来源,这是原初的响应,也是抵御侵染的第一道防线,同时胞内产生的活性氧在防御反应中也发挥作用[12]。茭白肉质茎膨大后抗坏血酸含量的大幅下降可能是抵御氧化胁迫消耗的结果,同时,氧化胁迫下其氧化型抗坏血酸比例上升;另一方面抗坏血酸的生物合成可能在病菌侵染后受到抑制。

茭白植物组织在氧化胁迫下可能诱发氧化暴发,但并不能有效阻止黑粉菌的侵染,事实上,茭白黑粉菌菌丝成功地在肉质茎的薄壁细胞间、维管束等处大量繁殖,并降解胞壁入侵细胞[1,2,9]。无论是以肉质茎长度[6]还是膨大天数[5]来衡量肉质茎的发育进程,SOD和CAT的酶活力均随肉质茎的膨大而发生下降。这种现象说明茭白组织在膨大期间引起氧化胁迫的活性氧可能是与黑粉菌互作的信号。
为了较全面地了解肉质茎膨大期间的氧化胁迫状态,尚需对活性氧(如过氧化氢)水平,及其他抗氧化剂、参与“抗坏血酸-谷胱甘肽循环”酶的活力变化等进行研究。
4 结论
在茭白肉质茎膨大期间,肉质茎组织的MDA含量上升,抗坏血酸含量下降,氧化型抗坏血酸的比例上升,表明肉质茎在膨大期间受到氧化胁迫。
[1]Yang H C,Leu L S.Formation and histopathology of galls induced by Ustilago esculenta inZizania latifolia[J].Phytopathology,1978,68(11):1 572-1 576.
[2]Chan Y S,Thrower L B.The host-parasite relationship betweenZizania caducifloraTurcz.andUstilago esculentaP.Henn.I.Structure and development of the host and host-parasite combination [J].New Phytologist,1980,85(2):201-207.
[3]Terrell E E,Batra L R.Zizania latifoliaandUstilago esculenta,a grass-fungus association[J].Economic Botany,1982,36(3):274-285.
[4]Apel K,Hirt H.Reactive oxygen species:Metabolism,oxidative stress and signal transduction [J].Annu Rev Plant Biol,2004,55:373-399.
[5]程龙军,郭得平,朱祝军,等.茭白肉质茎膨大发育的生化基础研究[J].核农学报,2004,18(6):457-461.
[6]江解增,张强,曹碚生,等.茭白肉质茎膨大过程中保护酶活性变化初探 [J].扬州大学学报:农业与生命科学版,2004,25(2):68-71.
[7]朱其松,黄建中,周烨,等.除草剂对不同耐寒性水稻幼苗的氧化胁迫效应[J].核农学报,2009,23(1):145-149.
[8]Gillespie K M,Ainsworth E A.Measurement of reduced,oxidized and total ascorbate content in plants [J].Nature Protocols,2007,2(4):871-874.
[9]施国新,徐祥生.茭白黑粉菌在茭白植株内形态发育的初步研究[J].云南植物研究,1991,13(2):167-172.
[10]江解增,邱届娟,韩秀芹,等.茭白生育过程中地上各部位内源激素的含量变化 [J].武汉植物学研究,2004,22(3):245-250.
[11]Ishikawa T,Shigeoka S.Recent advances in ascorbate biosynthesis and the physiological significance of ascorbate peroxidase in photosynthesizing organisms[J].Biosci Biotech Biochem,2008,72(5):1 143-1 154.
[12]Torres M A,Jones J D G,Dangl J L.Reactive oxygen species signaling in response to pathogens [J].Plant Physiol,2006,141(2):373-378.
