酵母液泡蛋白酶的研究进展
2010-11-10刘晓杰章海锋傅明亮陈启和何国庆
刘晓杰,章海锋,傅明亮,刘 婧,陈启和,何国庆
(浙江大学食品科学与营养系,浙江杭州310029)
酵母液泡蛋白酶的研究进展
刘晓杰,章海锋,傅明亮,刘 婧,陈启和*,何国庆
(浙江大学食品科学与营养系,浙江杭州310029)
在啤酒酵母中,液泡发挥了重要的生理作用,包括pH调节和代谢控制、蛋白质降解、氨基酸以及无机离子的储存。这一系列的功能均依赖于液泡中一些特定的蛋白酶。酵母细胞内大多数酶的成熟均依赖于这些蛋白酶的加工修饰作用。近年来国外研究人员对蛋白酶的这种加工修饰作用进行了深入研究,但在国内尚不多见。本文依据国内外研究进展对啤酒酵母液泡中常见的几种蛋白酶生物特点及其生理功能进行了综述,以便更好地认识酵母蛋白酶,为进一步研究打下理论基础。
啤酒酵母,液泡蛋白酶,生物性质
在啤酒工业中,蛋白含量一直是企业及相关研究人员关注的重点。一定的蛋白质含量有助于啤酒的起泡性和稳定性,然而过多的蛋白质含量又对啤酒品质不利,比如啤酒的冷浑浊等非生物稳定性问题。啤酒酿造过程中的蛋白酶主要有三个来源。第一个来源是麦芽,在大麦发芽时会产生自然蛋白酶,它经过麦汁煮沸后被除去,不会有所残留。第二个来源便是认为添加的蛋白酶,如木瓜蛋白酶就是啤酒中应用最广的蛋白水解酶,这主要是用于控制啤酒中的高分子量蛋白质,提高啤酒的非生物稳定性。第三个来源是来自酵母,也是啤酒中蛋白酶的最主要来源,对啤酒质量起重要作用[1]。因此,从菌种的角度出发,探讨酵母蛋白酶种类及其作用,进而通过基因工程手段敲除或通过转化转导等方式使酵母获得某些蛋白酶基因成了该领域许多研究人员的重点研究对象。早在20世纪之前人们就已在酵母中发现了蛋白酶,在20世纪20年代才开始对酶特性进行研究。在20世纪70年代,发现8种酵母蛋白酶:蛋白酶A和B,羧肽酶Y和S,3种氨基态酶和一个单一的二肽酶。在80年代中期,由于生色底物技术的发展,已知的酵母蛋白酶数量已经增加到约40种[2]。其中研究比较多的有四种,它们分别是蛋白酶A、蛋白酶B、羧肽酶和氨肽酶。本文将就啤酒酵母这四种蛋白酶酶学特性及其可能对啤酒品质带来的影响加以探讨,以期对其有更加清晰的认识。
1 酵母蛋白酶A的酶学性质及其生物学功能
酵母蛋白酶A(proteinase A,简称PrA)是一种酸性蛋白酶,其特性与哺乳动物猪胃蛋白酶、组织蛋白酶D和E以及人的血管紧张肽原酶相似,由于这些酶氨基酸数目大约为327,并且序列同源性都大于40%,活性中心保守序列Asp33-Thr-Gly-Ser及Asp218-Thr-Gly-Ser中天冬氨酸侧链参与了催化作用,因此这几种酶都叫天冬氨酸蛋白酶[4]。酵母蛋白酶A[EC3.4.23.25]是一种酸性蛋白酶,位于啤酒酵母液泡中,该酶由位于酵母染色体XVI的GAL4近端的PEP4(也叫 pHO9或 PRA1)基因(2146bp)编码,PEP4基因通过转录形成1800bp的mRNA,然后翻译形成405个氨基酸残基组成的蛋白酶A前体,即前蛋白酶A原(preproproteinase A,简称preproPrA),前蛋白酶A原是由405个氨基酸残基组成的单体蛋白,包括氨基端信号肽、前肽、活性蛋白酶A三部分,分子质量约44ku[5]。前蛋白酶A原在内质网中进行糖基化修饰,其N端由22个氨基酸残基组成的信号肽也在内质网中被切除。在高尔基复合体中糖链被剪切并延伸进而形成分子量约52kDa的蛋白酶A原。蛋白酶A原经核内体最后转运到液泡,酶原在液泡中进行自动激活,由54个氨基酸残基组成的前肽通过蛋白酶A原Glu-76和Gly-77间的肽键断裂被切除[6]。酵母蛋白酶A由一条多肽链组成,有两个拓扑学相似的叶片状结构域,无四级结构。
酵母蛋白酶A能催化细胞内蛋白质水解,特别是在N缺乏、孢子形成时,蛋白酶A通过水解蛋白质为孢子新蛋白合成提供氨基酸来源。在液泡中,酵母蛋白酶A参与多种酶的转录加工和成熟过程,如蛋白酶B前体及其酶原被蛋白酶A切割后进一步对羧肽酶Y前体进行加工,蛋白酶A也可以直接切割羧肽酶Y前体并使其成熟。另外,氨肽酶I、核糖核酸酶、碱性磷酸酶、海藻糖酶的成熟激活都与蛋白酶A有关[7]。
在正常代谢途径下,蛋白酶A原应按指定路径从高尔基体运输到液泡中,而酵母在逆境条件下,如发酵后期以及高压条件下,蛋白酶A原就会从酵母活细胞内输到胞外[8]。此外发酵后期的营养饥饿导致酵母自溶也是啤酒中蛋白酶A的重要来源。
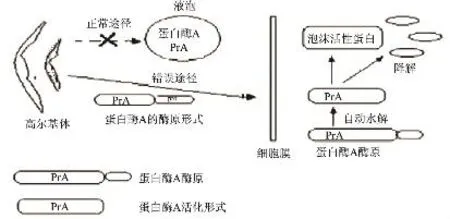
图1 酵母细胞分泌蛋白酶A到胞外和降解泡沫活性蛋白的模式
酵母蛋白酶A底物特异性小,最适作用条件为酸性。酵母活力越高,蛋白酶A分泌量越少;随着酵母活力的降低,蛋白酶A分泌量增多,活力提高,发酵终了达最大值。低氮条件下的分泌量要比氮源充足时要多。啤酒发酵过程中pH越高,蛋白酶A分泌量低;发酵结束时酵母胞液pH降低,蛋白酶A分泌量增多。后酵过程储存时间越长、温度越高,蛋白酶A分泌量越多。
王肇悦等对啤酒以及啤酒泡沫阳性蛋白进行了电泳分离并加以比较,结果发现,啤酒泡沫40和10kD两种蛋白的相对含量较高,这两种蛋白的分子量与蛋白质Z和脂肪转运蛋白(LTP)一致,而蛋白质Z与LTP正是现在公认的两种泡沫阳性蛋白。进一步将啤酒原液用盐酸调pH到2.0及3.0,加酵母蛋白酶A粗提液分别作用24、48、72h后进行电泳分析,而对照样品粗酶液在70℃水浴中保温30min。结果显示,啤酒蛋白在pH2和pH3条件下被酵母蛋白酶A作用24h后的结果相似,均为分子量为10kDa的蛋白(LTP1)条带消失。说明蛋白酶A对啤酒中的该蛋白酶有水解作用。而该蛋白恰恰是两种重要的啤酒泡沫阳性蛋白之一[5]。
2 酵母蛋白酶B的酶学性质及其生物学功能
酵母蛋白酶B(proteinase B,简称PrB)是酵母液泡中的蛋白质水解酶,属内切酶类。同植物细胞中的该蛋白酶一样,它参与氮缺乏条件下细胞内蛋白质的降解,以提供孢子形成以及子囊成熟所需的氮源。蛋白酶B是一种糖蛋白,分子量33000,包含一个糖基侧链,分子量3000、39000为蛋白质。其表达需要蛋白酶A激活蛋白酶B酶原,在蛋白酶A缺乏的条件下,分子量为42000的蛋白酶B酶原便积累下来。在细胞正常生长条件下,蛋白酶B活性很低,当碳源耗尽,酵母开始利用乙醇为碳源时酶活迅速提高。在生长受阻条件下酶活至少为细胞正常生长条件下的300倍[12]。Charles等通过对蛋白酶B基因进行研究发现,相关信使RNA由分子量为2.2kb的基因编码,该段基因可以编码分子量约为69000——大约是蛋白酶B分子量的2倍、含633个氨基酸、约含300个不可译5′和3′核苷酸。为了探究PRB1基因除了编码蛋白酶B以外是否编码其他功能性成分,实验者敲除了酵母PRB1基因上介于最左边至中间位置的ECORI之间的1.6kb的基因序列。得到了PRB-的酵母菌株。通过对菌落的比较发现工程菌与野生菌落之间没有显著差别,也因此证明PRB1基因为一个能自我复制的基因片段。结构上与枯草杆菌蛋白酶家族中的丝氨酸蛋白酶相近[14]。
3 酵母羧肽酶B的酶学性质及其生物学功能
羧肽酶B(carboxypeptidase B,CPB)是一类水解蛋白或多肽底物C端Lys或Arg的金属蛋白酶。也称为蛋白酶C。动物体内羧肽酶B由胰腺细胞分泌,起初以含信号肽及前肽的前羧肽酶原B(preprocarboxypeptidase B)形式存在,在转运至内质网的过程中被信号肽酶切除掉信号肽而形成无活性的羧肽酶原B(procarboxypeptidase B,proCPB),羧肽酶原B在小肠经胰蛋白酶特异水解剪切前肽后而被活化。成熟的鼠羧肽酶B含307个氨基酸,其前体中的信号肽和前肽分别由13个氨基酸及95个氨基酸组成。每摩尔羧肽酶B中含一个锌原子,它是羧肽酶B发挥功能活性所必须的[10]。它特异的水解肽链C端的碱性氨基酸:精氨酸、赖氨酸或鸟氨酸。由于一种新型的肿瘤靶向化疗方法——抗体导向酶-前体药物疗法(antibody—directed enzyme prodrug therapy,ADEPT)的兴起而受到相关研究人员的关注。它以抗体为靶向载体,将前体药物的专一性活化酶定位在病变部位,前体药物在病变部位局部被激活为细胞毒性药物,发挥治疗作用,增强了化疗药物的组织特异性,减少了其对正常组织的毒副作用[11]。Akio等在筛选分泌CPY的酵母菌株的基因屏幕中发现,要寻找CPY从高尔基体向液泡分泌的正确靶点至少要鉴定50Vps的分选基因。Vps38p和Vps34p是其中重要的两种,均为 3-磷脂酰肌醇激酶[13]。
4 酵母氨肽酶的酶学性质及其生物学功能
氨肽酶(aminopeptidase,Ape1)是在营养饥饿条件下细胞生长和自噬阶段通过细胞质-液泡(cytosol -to-vacuole targeting,Cvt)定向途径运输到酵母液泡中的一种cargo蛋白。然后在液泡中被加工为成熟的氨肽酶。已被纯化结晶的Ape1有两种结构,第一种空间结构属p2(1)型,晶胞参数:a=120.6,b= 219.5,c=133.1A,beta=116.5;第二种类型属R3空间结构群,晶胞参数:a=141.2,c=349.4A。自旋功能和体积与质量的比值表明,类型一和类型二的每个不对称单位中分别含有12和4个前氨肽酶原(mApe1)分子,而前酶原mApe1在两种晶形的四面体中均有存在[15]。氨肽酶属于肽链端解酶,可使氨基酸从多肽链的N-末端顺序逐个地游离出来。在许多生物中发现了各种性质的这种酶。具有代表性的是亮氨酸氨肽酶,特殊的有仅作用于N末端为脯氨酸的脯氨酸亚氨肽酶以及只作用于三肽的氨基三肽酶等。氨肽酶在液泡相关水解蛋白定位机制中的研究比较多。API没有标准的信号序列,含有氨基末端多肽链,Daniel等对该酶的生物合成今年进行了研究,以探究API向液泡的转运机制。研究发现,API同其他液泡蛋白酶一样起初以无活性的酶原形式存在,其成熟依靠蛋白酶A的修饰作用,API从前体至成熟大概要90min,经过这一加工过程后,API前体仍然留在细胞质中,并不进入分泌途径,前体不经过糖基修饰。其前肽以sec-independent方式脱除。在VPS突变体或过度表达菌株中,成熟的API及前体均不分泌到细胞外。经分泌途径的液泡水解蛋白呈现以下两个特点:一是API基因至成熟的氨肽酶转化时间延长;二是前体的大量积累。这些结果表明,API是在经过翻译后的加工过程后进入液泡的,这不同于其他液泡水解蛋白酶[16]。氨肽酶在生物机体内广泛存在,同白细胞3烯水解酶A4一样,氨肽酶在生物体内起着降解或加工无生物活性多肽的作用[17]。
[1]周建中.采用基因敲除手段降低啤酒酵母蛋白酶A表达的研究[D].新疆农业大学,2003.
[2]张俊炎.纯生啤酒泡沫稳定性的研究[D].江南大学,2003.
[3]王肇悦,何秀萍.纯生啤酒泡沫稳定性的影响因素及改善策略[J].食品与发酵工业,2006,32(3):63-66.
[4]Steffn R,Hans H,et al.Biogenesis of the yeast vacuole(lysosome)active site mutation in the vacuolaraspartate proteinase yscA blocks maturation of vacuolar proteinases[J]. Federation of European Biochemical Societies,1991,293(1):62-66.
[5]Ammerer G,Hunter C P,et al.PEP4 gene of Saccharamyces cerevisiae encodes proteinase A,a vacuolar enzyme required for processing of vacuolar precursors[J].Mol Cell Biol,1986,6(7):2490-2499.
[6]Hazel H B,Kielland-Brandt M C,et al.Autoactiviation of proteinase A initiates activation of yeast vacuolar zymogens[J]. Biochemstry,1992,207(1):277-.83.
[7]Elizabeth W Jones.Proteinase mutants of Saccharomyces cerevisiae[J].Genetics,1977,85(1):23-33.
[8]Thumma M,Egner R,et al.Isolation of autophagocytosis mutants of Saccharomyces cerevisiae[J].FEBS Letters,1994,349(2):275-280.
[9]何国庆,王肇悦,刘中山.啤酒泡沫阳性蛋白的电泳分离及其与酵母蛋白酶A关系[J].农业生物技术学报,2005,13(5):686-687.
[10]Charles M M,Martha W A,et al.Proteinase B of Saccharamyces cerevisiae:isolation and regulation of the proteinase B.Structure gene[J].Genetics,1987,115(2):255-263.
[11]王德解,苗林,陈宏.鼠羧肽酶B及其在毕赤酵母中的表达、纯化与鉴定[J].生物工程学报,2007,23(1):61-66.
[12]易静,刘家云,繆应叶.人羧肽酶A1的毕赤酵母可溶表达[J].西安交通大学学报:医学版,2006,27(4):324-327.
[13] Akio K,TakeshiN,etal.Two distinct Vps34 phosphatidylinositol 3-Kinase complexes function in autophagy and carboxypeptidase Y sorting in Saccharomyces cerevisiae[J]. The Journal of Cell Biology,2001,152(3):444-8585.
[14]Charles M Moehle,Pichard T,et al.Proteinase B of the Lyssomelike vacuole of the yeast Saccharromyces cerevisiae is homologous to the Subyilisin family of Serine proteinase[J]. Molecular and Cellular Biology,1987,7(12):4390-4399.
[15]Adachi W,Suzuki NN,et al.Crystallization of Saccharomyces cerevisiae aminopeptidase 1,the major cargo protein of the Cvt pathway[J].Acta Crystallogr Sect F Struct Biol Cryst Commun,2007,63(3):200-203.
[16]DanielJK,RosarioC,etal.AminopeptidaseIof Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway[J].The Jourmal of Cell Biology,1992,119(2):287-299.
[17]Toshimasa Y,Toshiki N,et al.Aminopeptidase Y,a New Aminopeptidase from Saccharomyces cerevisiae[J].The Journal of Biological Chemistry,1994,269(18):13644-13650.
Research progress in Saccharomyces cerevisiae vacuolar proteinase
LIU Xiao-jie,ZHANG Hai-feng,FU Ming-liang,LIU Jing,CHEN Qi-he*,HE Guo-qing
(Department of Food Science and Nutrition,Zhejiang University,Hangzhou 310029,China)
ln the yeast Saccharomyces cerevisiae,the vacuole is integrally involved in a wide array of physiological processes.These include pH and osmoregulation,protein degradation and storage of amino acids,small ions,and polyphosphate.These diverse functions necessitate the presence in the vacuole of a specific group of proteinase. The maturity of most vacuole enzyme was dependent on the processing and modification of these proteases.ln recent years,the kinds of processing and modification had been studied deeply in many foreign labs,but little had been carried out in domestic research institutions.This paper summarized the biological characteristics and their physiological functions of several common proteinase in the vacuole of Saccharomyces ceversiae based on many current research achievements both domestic and abroad.So as to get a better understand of beer yeast proteinase as well as lay a foundation for further study.
Saccharomyces cerevisiae;vacuolar proteinase;biological property
TS261.1+1
A
1002-0306(2010)12-0377-03
2009-12-03 *通讯联系人
刘晓杰(1986-),女,硕士研究生,研究方向:生物代谢工程。
国家高技术研究发展计划(863计划)(2007AA10Z315)。
