柳蒿芽黄酮抗氧化作用的研究
2010-11-10王向宏
刘 荣,董 强,王向宏
(1.东北林业大学林学院食品科学教研室,黑龙江哈尔滨150040;2.黑龙江省自然资源研究所,黑龙江哈尔滨150040)
柳蒿芽黄酮抗氧化作用的研究
刘 荣1,董 强1,王向宏2
(1.东北林业大学林学院食品科学教研室,黑龙江哈尔滨150040;2.黑龙江省自然资源研究所,黑龙江哈尔滨150040)
研究了柳蒿芽黄酮对D-半乳糖衰老模型小鼠体内抗氧化能力的影响,并采用单细胞凝胶电泳法测定柳蒿芽黄酮对H2O2引起的小鼠脾脏细胞DNA氧化损伤的防护作用。结果表明,柳蒿芽黄酮干预组小鼠比衰老模型组小鼠血清、肝脏、脑中超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)含量明显提高,丙二醛(MDA)含量明显降低,与衰老模型组比较,差异有显著性(P<0.05,P<0.01)。加入柳蒿芽黄酮组的小鼠脾脏细胞比对照组小鼠脾脏细胞DNA氧化损伤率明显降低,损伤率从83.5%分别降为62.5%、53.0%、44.5%,差异有显著性(P<0.05,P<0.01),柳蒿芽黄酮干预组DNA拖尾长度比对照组显著降低(p<0.05)。结果显示,柳蒿芽黄酮具有明显的抗氧化作用。
柳蒿芽黄酮,抗氧化,超氧化物歧化酶,谷胱甘肽过氧化物酶,丙二醛,DNA氧化损伤
柳蒿芽学名蒌蒿(Artemisin selengensis Turcz),菊科蒿属植物,又名水蒿、香艾蒿等。全草有特异香,既可食用又可药用,是一种开发前景较好的野生植物资源[1]。衰老是一种多环节的生物学过程,是机体在退化时期功能下降和紊乱的综合表现。衰老的自由基学说认为,衰老过程源于自由基对细胞及组织的损害,随着年龄增长,机体的抗氧化活性逐渐降低,对自由基危害的防御能力也逐渐降低,从而导致机体的衰老和死亡[2]。而现在又普遍认为自由基引起的DNA氧化损伤是生物变异和组织癌变的主要原因之一[3]。本研究旨在探讨柳蒿芽黄酮对D-半乳糖衰老模型小鼠体内抗氧化能力及对活性氧引起的细胞内DNA氧化损伤修复的影响,以考察柳蒿芽黄酮清除体内自由基、防护自由基对机体造成损伤的效果,以期对柳蒿芽黄酮的药物和功能性食品开发提供实验科学依据。
1 材料与方法
1.1 材料与仪器
实验用昆明小鼠 雄性,两月龄,体重20±2g,由哈尔滨医科大学实验动物中心提供;柳蒿芽干品齐齐哈尔市乌裕尔河畔;NaNO2、Al(NO3)3、NaOH沈阳沈一精细化学品公司,分析纯;芦丁对照品上海化学试剂公司;过氧化氢 天津市瑞金特化学品有限公司,分析纯;超氧化物歧化酶(SOD)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、丙二醛(MDA)测试盒 南京建成生物工程研究所;D-半乳糖、低熔点及正常熔点琼脂糖 sigma公司;DMEM培养基 Gibco公司;胰蛋白酶 Difco公司;Triton X-100 美国Becton Dickison(B.D)公司。
722s可见光分光光度计 上海精密科学仪器有限公司;二氧化碳细胞培养箱 上海力申科学仪器有限公司;DYY-Ⅲ38A型水平电泳仪 北京六一仪器厂;DMIL型荧光显微镜 Leica公司。
1.2 实验方法
1.2.1 柳蒿芽黄酮的提取 将柳蒿芽干品粉碎,过60目筛,石油醚浸泡晾干,称取25g,加入70%的乙醇1000mL,70℃水浴2h,超声波辅助提取70min,离心,取上清液,加入Sevag试剂(正丁醇∶三氯甲烷= 1∶5)除蛋白,四倍醇沉过夜除多糖,离心、浓缩、真空冷冻干燥得柳蒿芽黄酮备用[4]。
1.2.2 标准曲线的建立 准确称取芦丁标准品0.02g,加入50%的乙醇溶液定容至50mL。分别吸取芦丁标准品溶液0.0、1.0、2.0、3.0、4.0、5.0mL于25mL容量瓶中,各加入5%的NaNO2溶液1mL,摇匀,静置6min;加10%的Al(NO3)3溶液1mL,摇匀,静置6min;加入4%的NaOH溶液10mL,加入50%的乙醇溶液定容,摇匀,静置15min,在510nm处[5]测其吸光度。
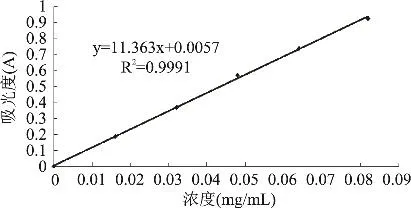
图1 芦丁浓度(X轴)对吸光值(Y轴)的线性曲线
1.2.3 柳蒿芽黄酮对D-半乳糖衰老模型小鼠体内的抗氧化作用
1.2.3.1 动物分组 雄性小鼠50只,随机均分成5组,自由摄食和饮水。衰老组皮下注射D-半乳糖200mg/kg·d bw,同时灌胃等量生理盐水;对照组给予等量的生理盐水;柳蒿芽黄酮组皮下注射D-半乳糖200mg/kg·d bw,同时分别灌胃50、100、200mg/kg·d bw柳蒿芽黄酮。实验期42d,于末次给药1h后,眼眶取血于离心管中,3000r/min离心取血清,再分别取脑、肝脏,匀浆器匀浆,-20℃保存备用。
1.2.3.2 指标测定 血清、脑和肝脏匀浆中 SOD、GSH-Px、MDA含量的测定均参照南京建成生物工程研究所生产的测定试剂盒说明书。
1.2.4 柳蒿芽黄酮对细胞内DNA氧化损伤修复的影响1.2.4.1 单细胞制备 取小鼠脾组织,加入PBS,冰浴中500~800r/min匀浆5~10s,胰蛋白酶消化,过分样筛取滤液,2000r/min离心10min去上清,加入PBS吹散沉淀于离心管底的细胞,调整细胞浓度为1× 107/mL,接种于含10%胎牛血清、100μg/mL链霉素、100U/mL青霉素的DMEM培养基中,37℃,5%CO2条件下培养。每天取出一定细胞测定细胞存活率,确定最佳实验时间。
1.2.4.2 实验分组 细胞处于对数生长期时,柳蒿芽黄酮作用组分别加入20、50、100μg/mL柳蒿芽黄酮,作用24h后与H2O2对照组同时加入40μmol/L H2O2作用30min,弃去培养液,PBS洗2遍,胰蛋白酶消化,将细胞制成悬液,调整细胞浓度为2×106/mL。
1.2.4.3 单细胞凝胶电泳 参照Singh等[6]的方法,在完全磨砂的载玻片上,滴加85μL 1%正常熔点的琼脂糖(不含Ca2+、Mg2+,50℃),盖上盖玻片,置于4℃下10min至凝;移去盖玻片,将细胞悬液与1%低熔点琼脂糖(37℃)1∶1混合共70μL作为第二层,盖上盖玻片,置于4℃下10min至凝;移去盖玻片,将75μL 0.5%低熔点琼脂糖(37℃)作为第三层,4℃下10min至凝。移去盖玻片,将载玻片浸入4℃预冷的细胞裂解液(2.5mol/L NaCl,100mmol/L Na2EDTA,10mmol/L Tris,1%十二烷基肌氨酸钠,pH10,用前加入1%Triton-100和10%DMSO)中2h。将载玻片取出,电泳液冲洗后,并列置于水平电泳槽中,电泳槽中盛有新配制的碱性电泳缓冲液(1mmol/L Na2EDTA,300mmol/L NaOH),电泳液约超过载玻片胶面0.25cm左右,放置40min,使DNA充分解螺旋。室温下电泳40min(电压25V、电流300mA)。电泳后用0.4mol/L Tris pH7.5浸洗三次,每次10min。
1.2.4.4 染色与观察 每个载玻片滴加50μL浓度为5μg/mL的溴化乙锭水溶液,染色20min。荧光显微镜下观察,从每张载玻片中随机选取100个细胞,共观察2次,对可重复结果选1次为代表,计算细胞损伤率。从每组损伤细胞中随机挑选20个细胞,测定DNA拖尾长度。
2 结果与讨论
2.1 柳蒿芽黄酮对衰老模型小鼠体内超氧化物歧化酶(SOD)含量的影响
表1显示,在D-半乳糖的作用下,衰老组小鼠与正常组比较,血清、肝脏、脑中的SOD含量明显下降,其中脑中SOD含量差异显著(P<0.05),血清和肝脏中SOD含量差异极显著(p<0.01),说明衰老模型建立成功。血清、肝脏柳蒿芽黄酮低、中剂量组与脑柳蒿芽黄酮高剂量组SOD含量显著高于衰老组(P<0.05),血清、肝脏柳蒿芽黄酮高剂量组SOD含量极显著高于衰老组(P<0.01),说明柳蒿芽黄酮可以明显提高衰老模型小鼠体内SOD的含量。
2.2 柳蒿芽黄酮对衰老模型小鼠体内谷胱甘肽过氧化物酶(GSH-Px)含量的影响
表2显示,衰老组小鼠与正常组比较,血清、肝脏、脑中的 GSH-Px含量都明显下降,差异极显著(p<0.01)。血清、脑柳蒿芽黄酮低、中剂量组GSH-Px含量显著高于衰老组(P<0.05),血清、脑、肝脏柳蒿芽黄酮高剂量组,肝脏柳蒿芽黄酮中剂量组GSH-Px含量极显著高于衰老组(P<0.01),说明柳蒿芽黄酮可以明显提高衰老模型小鼠体内GSH-Px的含量。
2.3 柳蒿芽黄酮对衰老模型小鼠体内丙二醛(MDA)含量的影响
表3显示,衰老组小鼠与正常组比较,血清、肝脏、脑中的MDA含量明显上升,其中脑中MDA含量差异显著(P<0.05),血清和肝脏中MDA含量差异极显著(p<0.01)。血清柳蒿芽黄酮低、中剂量组与肝脏、脑柳蒿芽黄酮中、高剂量组MDA含量显著低于衰老组(P<0.05),血清柳蒿芽黄酮高剂量组MDA含量极显著低于衰老组(P<0.01),说明柳蒿芽黄酮可以明显降低衰老模型小鼠体内MDA含量。
2.4 柳蒿芽黄酮对小鼠细胞内DNA氧化损伤修复的影响
表1 柳蒿芽黄酮对D-半乳糖衰老模型小鼠血清、肝脏、脑中SOD含量的影响(±s,n=10)

表1 柳蒿芽黄酮对D-半乳糖衰老模型小鼠血清、肝脏、脑中SOD含量的影响(±s,n=10)
注:a:与对照组比较,P<0.05;b:与对照组比较,P<0.01。表2、表3同。
柳蒿芽黄酮浓度(mg/kg·d) 血清(U/mL) 肝脏(U/mg prot) 脑(U/mg prot)正常组 246.81±80.37b 240.29±86.14b 138.25±68.36a衰老组 174.71±19.53 176.62±40.18 105.86±36.44 50 223.98±84.32a 205.48±80.81a 119.44±115.03 100 249.87±90.09a 217.98±54.46a 126.94±62.08a 200 275.99±113.26b 239.59±65.96b 131.28±54.26a
表2 柳蒿芽黄酮对D-半乳糖衰老模型小鼠血清、肝脏、脑中GSH-Px含量的影响(±s,n=10)

表2 柳蒿芽黄酮对D-半乳糖衰老模型小鼠血清、肝脏、脑中GSH-Px含量的影响(±s,n=10)
柳蒿芽黄酮浓度(mg/kg·d) 血清(U/mL) 肝脏(U/mg prot) 脑(U/mg prot)正常组 259.36±62.18b 434.57±91.38b 309.77±81.64b衰老组 166.24±49.27 263.22±59.49 186.51±47.38 50 187.48±51.39a 317.91±64.26b 224.97±56.78a 100 216.53±64.44a 352.65±70.18b 257.24±61.22a 200 241.64±178.68b 389.51±88.29b 293.19±75.26b
表3 柳蒿芽黄酮对D-半乳糖衰老模型小鼠血清、肝脏、脑中MDA含量的影响(±s,n=10)

表3 柳蒿芽黄酮对D-半乳糖衰老模型小鼠血清、肝脏、脑中MDA含量的影响(±s,n=10)
柳蒿芽黄酮浓度(mg/kg·d) 血清(U/mL) 肝脏(U/mg prot) 脑(U/mg prot)正常组 26.33±3.76b 36.26±15.79b 43.24±18.39a衰老组 46.56±7.97 81.37±40.28 86.66±43.47 50 40.47±5.22a 69.55±31.67 61.78±32.65 100 35.74±4.69a 57.11±34.53a 55.43±22.56a 200 28.32±4.11b 43.61±15.22a 48.97±15.32a
表4显示,柳蒿芽黄酮干预组细胞拖尾率明显低于阳性对照组,其中柳蒿芽黄酮高剂量组差异显著(P<0.05),柳蒿芽黄酮低、中剂量组差异极显著(P<0.01),柳蒿芽黄酮低、中剂量组拖尾长度显著低于阳性对照组(P<0.05),说明柳蒿芽黄酮对细胞内DNA氧化损伤有修复效果。柳蒿芽黄酮高剂量组对细胞内DNA氧化损伤的修复效果没有柳蒿芽黄酮中、低剂量组效果好,说明柳蒿芽黄酮浓度超过一定限度后会减弱对细胞DNA氧化损伤的修复效果。

表4 柳蒿芽黄酮对小鼠脾脏细胞DNA氧化损伤的修复影响
注:a:与H2O2组比较,P<0.05;b:与H2O2组比较,P<0.01。
3 结论
D-半乳糖致衰老模型的原理是由于注射D-半乳糖导致体内半乳糖浓度增高,并在醛糖还原酶的催化下,还原成半糖醇并堆积在细胞内,影响细胞的正常渗透压,导致机体衰老[7]。本研究中,D-半乳糖建立的衰老组模型小鼠血清、肝脏、脑中SOD、GSH-Px含量与正常对照组比较明显降低,MDA含量明显提高,结果具有显著性差异(P<0.05)和极显著性差异(P<0.01),这些结果与国内王少康[8]等人、王怀颖[9]等人报道的D-半乳糖老化模型小鼠体内抗氧化能力评价结果相一致,说明本研究衰老模型具有可靠性。
研究表明,SOD、GSH-Px活力与MDA含量是反映机体抗氧化能力的重要指标[10]。本研究中,柳蒿芽黄酮干预组小鼠血清、肝脏、脑中SOD、GSH-Px活力与衰老模型组比较明显偏高,MDA含量明显偏低,结果具有显著性差异(P<0.05)和极显著性差异(P<0.01),说明柳蒿芽黄酮可不同程度地提高D-半乳糖老化模型小鼠体内两种主要抗氧化酶SOD与GSH-Px的活力,降低MDA的含量,证明了柳蒿芽黄酮可以延缓由于注射D-半乳糖所导致的小鼠老化现象,提高老化模型小鼠体内抗氧化的能力。
近年来,有关活性氧的产生及其对生物分子的损伤机理研究受到各学科的普遍重视[11]。如吴文林等[12]报道茶多酚、芦丁、黄芩甙等3种黄酮类化合物对羟基自由基引发的DNA氧化损伤具有保护作用,这种保护作用表现在它们能使DNA发光强度减弱、发光峰值延迟,并能保护质粒DNA超螺旋结构的断裂。
本研究中通过单细胞凝胶电泳法考察了柳蒿芽黄酮对细胞内DNA氧化损伤的修复作用,与阳性对照组比较其抑制由于氧化损伤所造成的细胞DNA拖尾现象十分明显,最高可降低细胞拖尾率达到39%,还可明显降低氧化损伤细胞DNA的拖尾长度,效果显著(P<0.05)。以上结果证明了柳蒿芽黄酮具有较好的抑制由活性氧造成的细胞DNA氧化损伤的能力。这一结论对于柳蒿芽黄酮的开发利用及黄酮类化合物抗氧化作用机制的研究有一定参考价值。
[1]董世林.植物资源学[M].哈尔滨:东北林业大学出版社,1994:314-315.
[2]蔡东联,沈卫,曲丹.银耳多糖对D-半乳糖致衰老模型小鼠抗氧化能力的影响[J].氨基酸和生物资源,2008,30(4):52-54.
[3]Longwen,pHyllis E,Bowen DB.Diet modification affect DNA oridative damage in healthy humans[J].Free Radic Biol Med,1999,26:695.
[4]刘荣,赵福阳,李佳梅.柳蒿芽黄酮提取工艺研究[J].中国食品学报,2008,8(2):89-94.
[5]陈新,叶文峰,刘秀娟,等.蒌蒿素原粉中总黄酮的提取及含量的测定[J].江西师范大学学报,2000,24(2):164-166.
[6]Peterhans E.Oxidants and antioxidants in viral diseases[J]. Disease Mechanisms and Metabolic Regulation,1997,127(5):962-965.
[7]李艳红,刘坚,江波,等.鹰嘴豆蛋白酶解物对D-半乳糖衰老小鼠抗氧化能力的影响[J].营养学报,2008,30(2):161-164.
[8]王少康,孙桂菊,张建新,等.亚急性衰老动物模型的建立及评价[J].东南大学学报,2002,21(3):217-219.
[9]王怀颖,张玮,石少慧,等.D-半乳糖在小鼠抗氧化能力实验研究[J].军医进修学院学报,2005,26(5):397-398.
[10]康桦,匡荣.a-硫辛酸抗D-半乳糖所致小鼠衰老作用研究[J].医药导报,2008,27(8):896-898.
[11]Knight JA.Disease related to oxygen-derived free radicals[J].Ann Clin Lab Sci,1995,25:111.
[12]吴文林,胡天喜.自由基生命科学进展[M].北京:原子能出版社,1996:101-104.
Study on the antioxidant activity of flavonoid in Artemisin selengensis
LIU Rong1,DONG Qiang1,WANG Xiang-hong2
(1.Department of Food Science in Forestry College of Northeast Forest University,Harbin 150040,China;2.Natural Resource Institute of Heilongjiang,Harbin 150040,China)
The antioxidant and protective effect of flavonoids in Artemisin selengensis in aged mice caused by D-galactose and in DNA oxidative damage induced by H2O2was investigated in this research.The results indicated that the activities of SOD and GSH-Px in serum,liver and brain in aged mice of the group which treated with flavonoid in Artemisin selengensis were significantly higher and the content of MDA was significantly lower than the aged model group(P<0.05,P<0.01).The damage ratio of splenic cells of the group which treated with flavonoid in Artemisin selengensis was significantly lower than the positive control group(P<0.05,P<0.01),and was reduced from 83.5%to 62.5%,53.0%,44.5%.The comet length of the group which treated with flavonoid in Artemisin selengensis was significantly lower than the positive control group(P<0.05).The results showed that flavonoids in Artemisin selengensis had obvious antioxidant effect.
flavonoids in Artemisin selengensis;oxidation resistance;SOD;GSH-Px;MDA;DNA oxidative damage
TS201.1
A
1002-0306(2010)12-0319-04
2009-10-26
刘荣(1971-),女,博士,副研究员,研究方向:功能食品。
