产葡萄糖氧化酶黑曲霉的诱变选育及葡萄糖酸钙发酵条件的研究
2010-11-10梁静娟李筱瑜庞宗文麦志茂
梁静娟,李筱瑜,官 威,庞宗文,麦志茂
(广西大学生命科学与技术学院,广西南宁530005)
产葡萄糖氧化酶黑曲霉的诱变选育及葡萄糖酸钙发酵条件的研究
梁静娟,李筱瑜,官 威,庞宗文,麦志茂
(广西大学生命科学与技术学院,广西南宁530005)
用紫外线和钴60放射线照射对产葡萄糖氧化酶的黑曲霉菌株P-9进行诱变,以含有2-脱氧-D-葡萄糖的选择培养基进行筛选,共获得7个耐受菌株,其中产酶活性最大的U-69菌株的葡萄糖氧化酶活力是出发菌株P-9的2.5倍。研究了U-69菌株合成葡萄糖酸钙的发酵条件,结果显示,最佳发酵条件为葡萄糖150g/L,碳酸钙400g/L,硫酸铵3~4g/L,pH 5.5,250mL三角瓶装30mL发酵液,接种量10%,30~34℃发酵18h。
黑曲霉,葡萄糖氧化酶,诱变,葡萄糖酸钙
葡萄糖氧化酶(Glucose oxidase,简称GOD)能专一地将β-D-葡萄糖氧化成葡萄糖酸和过氧化氢[1],在食品、医药及生物等领域有着广泛的应用。葡萄糖酸与CaCO3等钙盐反应可生成葡萄糖酸钙,葡萄糖酸钙有助于骨质形成,能促进骨骼和牙齿的发育,用于预防和治疗缺钙症等。葡萄糖酸钙的生产主要采用黑曲霉发酵法,提高黑曲霉产葡萄糖氧化酶的能力是实现高产葡萄糖酸钙的最有效的手段。本研究通过紫外和放射诱变来获得葡萄糖氧化酶高产菌株,对高产菌株合成葡萄糖酸钙条件进行研究。
1 材料与方法
1.1 实验材料
黑曲霉P-9 由本课题组筛选并保存;筛选培养基[2](g/L) 葡萄糖80、蛋白胨3、(NH4)2HPO40.39、KH2PO40.19、Mg2SO4·7H2O 0.16、CaCO33.5、可溶性淀粉10、KI 1.7、脱氧胆酸钠0.2、琼脂20、磷酸缓冲液0.1mol/L,pH5.6;选择培养基 添加有1.5g/L的2-脱氧-D-葡萄糖的麦芽汁琼脂;发酵培养基[2](g/L)葡萄糖 80、蛋白胨 3、(NH4)2PO40.388、KH2PO40.188、Mg2SO4·7H2O 0.156、CaCO335,pH自然。
1.2 实验方法
1.2.1 诱变方法
1.2.1.1 紫外线诱变 取黑曲霉P-9的孢子,用无菌生理盐水制成108个/mL的孢子悬液。取2mL孢子悬液于无菌培养皿中,铺成一层薄层,于暗室内30W紫外灯下20cm处照射8min。取照射液进行适当稀释,涂布于选择培养基,用黑纸包裹,30℃恒温避光培养4d,待长出孢子后,将孢子点种于筛选培养基,挑选在菌落周围出现较大蓝色圈的菌株,分别进行发酵并测定葡萄糖氧化酶活力。
1.2.1.2 钴60放射诱变 取黑曲霉P-9的孢子,用无菌生理盐水制成108个/mL的孢子悬液。孢子悬液于钴60源下照射,照射剂量为1.2kGy。取处理液进行适当稀释,涂布选择培养基,30℃恒温培养4d,待长出孢子后,将孢子点种于筛选培养基,挑选在菌落周围出现较大蓝色圈的菌株,分别进行发酵并测定葡萄糖氧化酶活力。
1.2.2 葡萄糖氧化酶的制备 将黑曲霉孢子用无菌水制成2.0×109个孢子/mL左右的孢子悬浮液,于发酵培养基中接入10%(v/v)的孢子悬浮液,30℃,200r/min下发酵培养18h后,离心收集菌丝体,菌丝体反复用0.1mol/L,pH 5.0磷酸缓冲液冲洗,置于-20℃冰箱中冰冻后,研磨,离心取上清液即为葡萄糖氧化酶粗酶液。
1.2.3 产葡萄糖酸钙黑曲霉发酵条件的研究 选择影响葡萄糖酸钙发酵产量的发酵温度、pH、装液量、孢子接种量、葡萄糖浓度、碳酸钙用量等进行研究。改变一种发酵条件,其他条件不变,发酵后测定葡萄糖酸钙含量,得出单因素最佳水平。
1.2.4 葡萄糖氧化酶酶活力的测定 本研究采用分光光度计分析法测定葡萄糖氧化酶活性[4]。反应混合液含2mL 1mol/L葡萄糖(用0.1mol/L的柠檬酸钠-磷酸缓冲液配制,pH 5.0),1mL 0.1% 苯醌(benzoquinone)和100μL粗酶液,反应液于35℃下保温反应 10min,于 290nm处测定形成的氢醌(hydroquinone)量。葡萄糖氧化酶的单位(U)定义为35℃,pH 5.0下每克菌体每分钟产生1μmol氢醌的酶量。
1.2.5 葡萄糖酸钙的测定 采用钙红指示剂法[3]。
2 结果与分析
2.1 葡萄糖氧化酶产生菌的诱变选育
黑曲霉P-9经过紫外线照射处理,共获得5个耐受2-脱氧-D-葡萄糖的突变菌株,分别是U-15、U-17、U-56、U-69和U-78。经过钴60诱变处理共获得2个耐受2-脱氧-D-葡萄糖的菌株,分别是G-206和G-235。7个耐2-脱氧-D-葡萄糖突变株经蓝圈筛选和发酵测定,有4个菌株的葡萄糖氧化酶产量高于出发菌株,产酶水平最高的是U-69菌株,为28.7U/g,是出发菌株P-9的2.5倍,结果见表1。
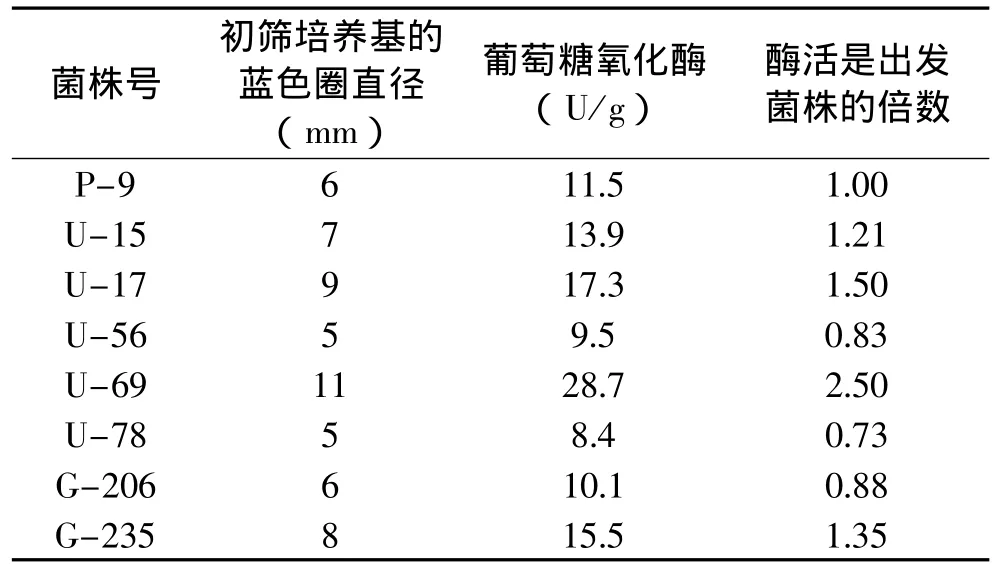
表1 经过紫外线诱变和钴60诱变所获得的突变菌株的葡萄糖氧化酶活性
2.2 葡萄糖酸钙发酵条件优化
选择葡萄糖氧化酶活力最高的突变株U-69,研究其发酵生产葡萄糖酸钙的发酵条件。
2.2.1 葡萄糖浓度对葡萄糖酸钙产量的影响 葡萄糖是合成葡萄糖酸钙的主要底物,应有足够量方可使葡萄糖酸钙达到一定产量。图1是不同葡萄糖浓度下葡萄糖酸钙的产量,从图1可以看出,最适的葡萄糖浓度为150g/L,过多的葡萄糖会抑制葡萄糖酸钙的形成。
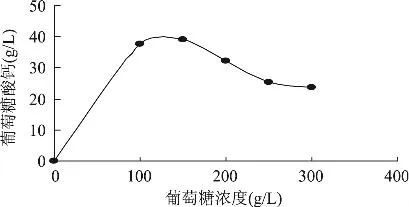
图1 葡萄糖浓度对U-69菌株合成葡萄糖酸钙的影响
2.2.2 碳酸钙浓度对葡萄糖酸钙产量的影响 碳酸钙是合成葡萄糖酸钙的另一主要底物,也应有足够的量才能使葡萄糖酸钙达到一定产量。图2是不同碳酸钙浓度下的葡萄糖酸钙产量,从图2可以看出,最适的碳酸钙浓度为400g/L,超过该浓度葡萄糖酸钙的产量变化不大。
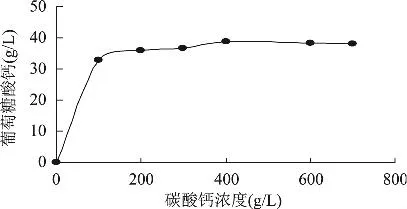
图2 碳酸钙浓度对U-69菌株合成葡萄糖酸钙的影响
2.2.3 硫酸铵浓度对葡萄糖酸钙产量的影响 硫酸铵是发酵氮源,对合成葡萄糖酸钙有很重要的影响。图3是不同硫酸铵浓度下的葡萄糖酸钙产量,从图3可以看出,最适的硫酸铵浓度为3~4g/L。
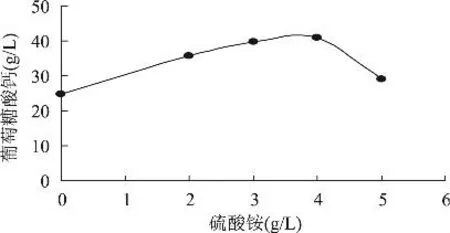
图3 硫酸铵浓度对葡萄糖酸钙产量的影响

图4 pH对U-69菌株合成葡萄糖酸钙的影响
2.2.4 培养基初始pH和发酵温度对葡萄糖酸钙产量的影响 图4是不同pH下的葡萄糖酸钙产量,图5是不同发酵温度下的葡萄糖酸钙产量,从图4和图5可以看出,培养基初始pH对U-69合成葡萄糖酸钙有很大的影响。U-69合成葡萄糖酸钙最适的pH为5.5,最适发酵温度是30~34℃,在该温度范围内,葡萄糖酸钙的产量是基本上稳定的。
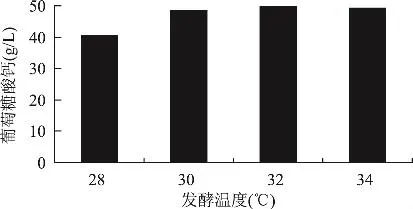
图5 温度对U-69菌株合成葡萄糖酸钙的影响
2.2.5 接种量对葡萄糖酸钙产量的影响 图6是不同接种量下的葡萄糖酸钙产量,从图6可以看出,接种量对U-69合成葡萄糖酸钙有很大的影响。U-69合成葡萄糖酸钙最佳接种量为10%,当接种量不足时,由于菌体生长慢,产生葡萄糖氧化酶能力差,葡萄糖酸钙的产量则低,当接种量过大时,由于菌体生长快,消耗过多营养,导致产生葡萄糖氧化酶能力差,葡萄糖酸钙的产量也低。
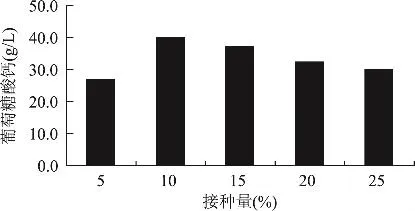
图6 接种量对U-69菌株合成葡萄糖酸钙的影响
2.2.6 发酵液装液量对葡萄糖酸钙产量的影响 图7是不同装液量下的葡萄糖酸钙产量,从图7可以看出,装液量对U-69合成葡萄糖酸钙有较大的影响。U-69合成葡萄糖酸钙最佳装液量为250mL三角瓶中装30mL发酵液,这说明U-69需要较充足的氧才能很好地合成葡萄糖酸钙。
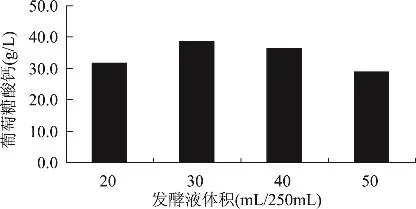
图7 装液量对U-69菌株合成葡萄糖酸钙的影响
2.2.7 发酵时间对葡萄糖酸钙产量的影响 图8是不同发酵时间的葡萄糖酸钙产量,从图8可以看出,U-69发酵10h即可大量合成葡萄糖酸钙,至18h达到了最大合成量,随着发酵时间的进一步增加,葡萄糖酸钙的产量变化不大。
从以上实验结果可知,各因素的最佳值为葡萄糖150g/L,碳酸钙400g/L,硫酸铵3~4g/L,pH 5.5,250mL三角瓶装30mL发酵液,接种量10%,30~ 34℃发酵18h。

图8 发酵时间对U-69菌株合成葡萄糖酸钙的影响
3 讨论
葡萄糖结构类似物如2-脱氧-D-葡萄糖抗性菌株的筛选已被证明可用于葡萄糖淀粉酶、纤维素酶和葡萄糖氧化酶高产菌株的筛选[5-7]。本研究采用2-脱氧-D-葡萄糖抗性菌株与产葡萄糖氧化酶活性的相关性的特性进行筛选,获得了较好的效果,所获得的7个2-脱氧-D-葡萄糖抗性菌株全部具有较高的产葡萄糖氧化酶活性。由此可以推测,增加2-脱氧-D-葡萄糖耐受性,可以是一个改善原始菌株产酶综合性能的有效手段。
蓝圈法的原理是微生物产生的葡萄糖氧化酶将培养基中的葡萄糖转化为葡萄糖酸,葡萄糖酸与KI反应将I-离子还原为I元素,I与培养基中的可溶性淀粉反应形成蓝色化合物而使菌落周围出现蓝色圈,蓝色圈的大小与葡萄糖氧化酶的产量成正相关。该方法可以作为葡萄糖氧化酶产生菌的高通量筛选方法,大大提高葡萄糖氧化酶产生菌的诱变育种效率。
[1]李艳,李静.葡萄糖氧化酶及其应用[J].食品工程,2006(3):9-11.
[2]刘峰,黄鹭强,林颖,等.从土壤中快速筛选葡萄糖氧化酶产生菌及发酵工艺的优化[J].生物技术,2007,17(3):64-68.
[3]聂芙蓉,刘庆华,杜垒,等.不同指示剂对EDTA法测定饲料中钙含量准确性影响的研究[J].饲料工业,2006,27(6):54-55.
[4]Khattab A A,Bazaraa W A.Screening,mutagenesis and protoplast fusion of Aspergillus niger for the enhancement of extracellular glucose oxidase production[ J].Microbiol Biotechnol,2005,32:289-294.
[5]Azin M,Noroozi E.Random mutagenesis and use of 2-deoxy -D-glucose as an antimetabolite for selection of α-amylaseoverproducing mutants of Aspergillus oryzae[J].World J Microbiol Biotechnol,2001,17:747-750.
[6]Adsul M G,Bastawde K B,Varma A J,et al.Strain improvement of Penicillium janthinellum NCIM 1171 for increased cellulase production[J].Bioresour Technol,2007,98:1467 -1473.
[7]Ramzan M,Mehmood T.Enhanced production of glucose oxidase from UV-mutant of UV-mutant of Aspergillus niger[J]. African J Biotechnol,2009,8(2):288-290.
Study on mutagenesis of oxidase-producing Aspergillus niger and its fermentation condition of calcium gluconate production
LIANG Jing-juan,LI Xiao-yu,GUAN Wei,PANG Zong-wen,MAI Zhi-mao
(College of Life Science and Technology,Guangxi University,Nanning 530005,China)
The glucose oxidase production capacity of Aspergillus niger P-9 was improved by mutagenesis using UV-or60Co-irradiation and selected in 2-deoxy-D-glucose agar.7 strains which were resistant to 2-deoxy-D-glucose,4 strains had higher glucose oxidase production capacity than wild-type strain P-9.The glucose oxidase activity of the best producer,strain U-69(28.7U/mL),was 2.5 times higher than strain P-9.The fermentation conditions of U-69 for calcium gluconate production were studied.The optimum fermentation conditions of U-69 to produce glucose oxidase were 150g/L glucose,400g/L CaCO4,3~4g/L(NH4)2SO4,30mL broth bottled in 250mL triangular flask,pH 5.5,inoculum size 10%,30~34℃and 18h.
Aspergillus niger;glucose oxidase;mutagenesis;calcium gluconate
TS201.3
A
1002-0306(2010)12-0218-03
2009-12-27
梁静娟(1964-),女,硕士,副教授,研究方向:微生物酶学。
