金纳米粒子比色测定细胞色素c构象变化
2010-11-06周剑章林玲玲韩楠楠林仲华
栗 娜 周剑章 林玲玲 韩楠楠 林仲华
(厦门大学化学化工学院化学系,固体表面物理化学国家重点实验室,福建厦门 361005)
金纳米粒子比色测定细胞色素c构象变化
栗 娜 周剑章*林玲玲 韩楠楠 林仲华
(厦门大学化学化工学院化学系,固体表面物理化学国家重点实验室,福建厦门 361005)
金纳米粒子(Au NPs)的颜色会随着细胞色素c(Cyt c)构象变化而发生较大的变化,作者在改变原测定流程的基础上利用这种有规律的变化研究和测定了H+和L-半胱氨酸(L-Cys)对Cyt c的构象变化.实验中分别加入pH=1-13的Cyt c,可以使Au NPs显示青、蓝、紫、红等明显不同的颜色,从而可以利用Au NPs比色快速测定不同pH值的Cyt c构象变化.在pH=7时,当附加L-Cys浓度从低浓度变化到高浓度时,Au NPs颜色逐渐从紫色变化到蓝色、青色,从而实现利用Au NPs比色测定由L-Cys所引起Cyt c构象变化.圆二色(CD)光谱证实了pH=1-13和不同浓度L-Cys下的Cyt c构象变化.借助紫外-可见吸收光谱和扫描电子显微镜(SEM)进一步明确了加入Cyt c后Au NPs的不同聚集状态与其颜色变化的关系.
Au纳米粒子; 比色测定;Cyt c构象变化;pH值;L-Cys
自从1996年Mirkin等[1]首次构筑了脱氧核糖核酸(DNA)-金纳米粒子(Au NPs)生物纳米复合体系以来,近年利用Au NPs作为光学生物传感器成为研究热点[2-4].鉴于其不同聚集状态时颜色不同,Au NPs比色测定已经广泛应用在金属离子[5-7]、DNA[8-9]、酶[10-12]、蛋白质[13-14]的检测和作用原理研究中.细胞色素c(Cyt c)是中心为血红素结构的低分子量蛋白,在细胞呼吸链中担负着传递电子的重要作用.在不同条件(如pH值、温度及氧化还原性物质共存)下, Cyt c有着不同的构象[15].研究Cyt c的构象变化对于理解其构象和其在生物分子中的功能之间的关系有着至关重要的作用.Zare等[16]利用Au NPs比色测定了不同pH时酵母菌细胞色素c(Cyt c)的构象变化,这也是第一次利用Au NPs比色测定蛋白质的构象变化.而Francoet等[17]分别研究了酵母菌和马心Cyt c在Cyt c-Au NPs复合体系中的表面性质.
然而,之前的研究需要先制备稳定的Cyt c-Au NPs复合体系(要过夜),再调节复合体系pH值[16-17].作为一种检测方法而言,这样的操作过程还是比较繁琐、耗时.我们利用蛋白质构象变化延迟性的特点[18],改变了测定流程.先将Cyt c调节到各个pH值,后加入到Au NPs中,虽然加入Au NPs后体系的最终pH值会改变,但是Cyt c构象短时间内变化很小.由此得到了一种利用Au NPs更简单,更快速(1 min内变色),pH值范围更广泛(pH为1-13,之前pH为4-11),颜色变化更多样的检测H+引起的马心Cyt c构象变化的方法.接着,我们又利用Au NPs比色成功测定了在pH=7的条件下由L-半胱氨酸(LCys)引起的马心Cyt c构象变化.
1 实验部分
1.1 试剂与仪器
氯金酸HAuCl4·4H2O和柠檬酸三钠Na3C6H5O· 2H2O购自北京化学制药厂,分析纯;L-半胱氨酸(LCys)盐酸盐C3H8ClNO2S购自吉尔生化有限公司,分析纯;三羟甲基氨基甲烷(Tris)氢氧化钠、浓盐酸、氯化钠均购自国药集团分析试剂有限公司,分析纯;马心细胞色素c(Cyt c氧化型)购自Sigma Chemical Co.,分析纯,未经任何处理,溶解在缓冲溶液(10 mmol·L-1Tris+10 m mol·L-1NaCl,pH=7)中以制备500 mg·L-1储备液.0.1 mol·L-1L-Cys储备液的制备是将适量的L-Cys盐酸盐加入缓冲溶液中,用NaOH调节至 pH=7.实验用水为去离子超纯水(Milli-Q,Millipore).
照片由日本佳能IXUS 970 IS型数码相机拍摄, pH值由美国奥立龙828精密型酸度计测量得到.紫外-可见(UV-Vis)吸收光谱由日本岛津公司 UV-2100双池紫外-可见吸收光谱仪测量,以超纯水作为参比溶液.圆二色(CD)光谱是由日本分光株式会社J-810圆二色谱仪测量.扫描电子显微镜(SEM)图是由日本日立公司Hitachi S-4800扫描电子显微镜测试得到.所有实验测试均在常温下进行.
1.2 实验过程
Au NPs的制备:利用文献方法[19]合成,在250 mL锥形瓶中分别加入150 mL超纯水,将1.815 mL质量分数为1%的氯金酸溶液回流加热煮沸后,加入4.5 mL质量分数为1%的柠檬酸三钠溶液回流加热至变为浅紫色后继续回流加热50 min,最终颜色为鲜红色.冷却至室温后,存储在冰箱(4℃),待用.
H+引起的Cyt c构象变化的比色测定及表征:首先用缓冲液稀释Cyt c储备液到50 mg·L-1,用HCl和NaOH分别调节pH值到1-6和7-13,将制备好的样品进行CD光谱测试.然后将15 μL不同pH值的Cyt c加入400 μL Au NPs中,迅速混匀后观察其颜色变化(1 min之内变色)并拍照,后直接用于UV-Vis吸收光谱检测.滴加含有Cyt c的Au NPs溶液到硅片上,1 min后,用滤纸吸干,并用超纯水洗净,静置放干,用于SEM图测试.
L-Cys引起的Cyt c构象变化的比色测定及表征:首先利用L-Cys储备液和Cyt c储备液制备含L-Cys的Cyt c,其中Cyt c浓度为50 mg·L-1,而LCys浓度分别为 0.10、0.15、0.20、0.25、0.30、0.50 mmol·L-1,用于CD光谱测试.将15 μL不同浓度L-Cys的Cyt c加入400 μL Au NPs中,迅速混匀,观察其颜色变化并拍照.同上处理后用于UV-Vis吸收光谱和SEM测试.
2 结果与讨论
2.1 Au NPs的制备与表征
图1的内插图A为Au NPs的SEM图,可看出所制备Au NPs呈规则的球形,分散性很好.图1中UV-Vis吸收光谱图表明其最大吸收峰在 521 nm处,特征吸收峰尖锐.所制备的Au NPs颜色鲜红,相当稳定(见图1内插图B).
2.2 Au NPs比色测定不同pH值下Cyt c的构象变化
图2展示了不同pH值下不含和含Cyt c的Au NPs的照片.上面一列是在Au NPs中分别加入单纯缓冲液(pH从1到13)的照片,可以看到Au NPs显示红色,说明Au NPs在此酸碱性条件下很稳定,这与文献的结果[16]一致.而下面一列是含Cyt c的Au NPs照片,可以看到加入不同pH值的Cyt c后,Au NPs逐渐显示从青色到蓝色,再到紫色,最后为红色.Cyt c的pH=1时,呈现青色;pH=2时,呈现深蓝色;pH=3-7,呈现蓝色;pH=8-10,呈现紫色;pH= 11-13时候,呈现红色.
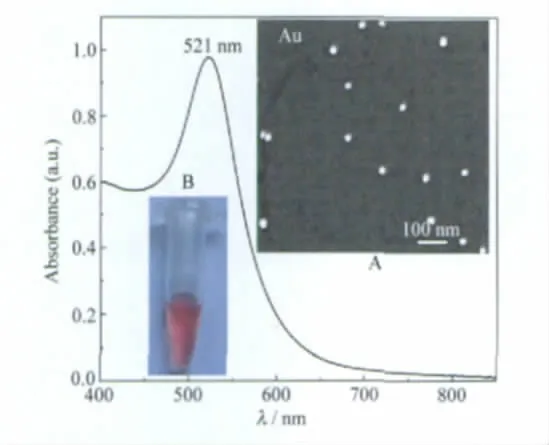
图1 Au纳米粒子(NPs)的紫外-可见吸收光谱Fig.1 UV-Vis absorption spectrum of Au nanoparticles(NPs)Insets are SEM image(A)and the photo(B)of Au NPs.
这些不同颜色体现了Au NPs不同的聚集状态,蓝(青)色为深度聚集状态,紫色为轻度聚集状态,而红色则是分散状态.图3的SEM图展示了分别加入pH值为1、4、7、11的Cyt c后Au NPs的形貌.由图可见:pH=1时,Au NPs聚集程度最强;pH=4,7时,聚集程度较弱;而pH=11时,Au NPs则处于分散状态,这与其相应的颜色变化保持着高度的一致性.
图4(A)是加入不同pH值的Cyt c后Au NPs的UV-Vis吸收光谱(由于溶液中Cyt c的最终浓度很低,其UV-Vis吸收峰被Au NPs的吸收峰所掩盖).当加入pH值从1到10的Cyt c时,Au NPs第二等离子共振吸收峰(金纳米粒子聚集后由于相邻粒子间的等离子共振偶合而出现相对520 nm红移的新的等离子共振吸收峰)的峰位对应的波长逐渐从623 nm减小到577 nm,而加入pH值从11到13的Cyt c时,Au NPs没有第二等离子共振吸收峰,只有其521 nm处的特征吸收峰.可以看出,pH=1-10时,吸收峰峰位变化较大;而pH=11-13时,对应峰位波长基本不变.为了进一步比较Au NPs等离子共振吸收峰位与pH值的关系,我们做了该峰位下波长与pH值的关系曲线(见图4(A)的内插图).可以看出,pH从1到10变化时,峰位波长随着pH值的变大而逐渐减小,而pH从11到13时,峰位变化很小,基本趋于不变.这跟其颜色从pH=1-10显示聚集态的青、蓝、紫色,而pH=11-13显示分散态的红色是很一致的.
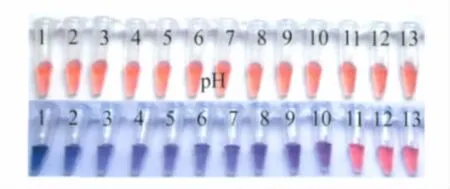
图2 不含(上列)和含(下列)Cyt c的Au NPs照片Fig.2 Photos of Au NPs without(upper)and with(lower)Cyt cpH:1-13

图3 含pH值分别为1,4,7,11的Cyt c的Au NPs的SEM图Fig.3 SEM images of Au NPs with Cyt c for pH=1,4,7,11
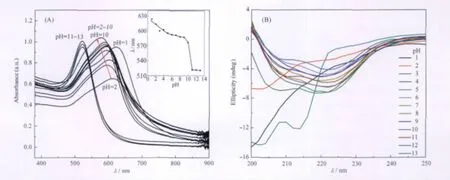
图4 含Cyt c的Au NPs的UV-Vis吸收光谱(A)和Cyt c的圆二色光谱(B)Fig.4 UV-Vis absorption spectra of Au NPs with Cyt c(A)and CD spectra of Cyt c(B)Inset:the plot between wavelengths at absorption peaks with different pH values.The arrowhead points pH values from 2 to 10.
由于马心Cyt c主要是通过静电吸附在Au NPs上[17],所以当Cyt c的pH值低于其等电点(10-10.8)时,带负电的Au NPs与带正电的Cyt c相互吸引,从而Au NPs呈现聚集状态,表现出紫色或者蓝(青)色;相反,当Cyt c的pH高于其等电点时,带负电的Au NPs与带负电的Cyt c相互排斥,从而Au NPs呈现分散状态,表现为红色.同时,在不同pH值下, Cyt c构象会发生变化.pH=0.42-2.5时,Cyt c的疏水内核打开,其为非折叠蛋白;pH=2.5-12.76时, Cyt c是折叠蛋白;而高于12.76时为另一种非折叠蛋白[15].本实验中是先将Cyt c调节到各个pH(模拟各实际情况)后加入到Au NPs中,虽然加入Au NPs后体系最终的pH值会改变,但是Cyt c构象短时间内变化很小.我们的CD光谱实验证实,加入Au NPs后,在实验测试时间内,Cyt c的构象基本保持不变.图4(B)是pH=1-13 Cyt c的CD光谱,其中208和222 nm两处负峰是Cyt c的α高螺旋结构特征峰[20].在pH=3-12时,222和208 nm处存在负峰,说明Cyt c的α螺旋结构保持,Cyt c为折叠蛋白;而pH=1-2以及pH=13时,两个负峰消失,此时Cyt c处于两种不同结构的非折叠状态.当Cyt c为pH<2.5(pH=2,1)的非折叠蛋白构象时,Cyt c带正电,Au NPs呈现深蓝色和青色;pH低于其等电点(pH=3-10)的折叠蛋白构象时,Cyt c也带正电,Au NPs呈现蓝色和紫色;pH高于其等电点(pH=11-12)的折叠蛋白构象时,Cyt c带负电,Au NPs显示红色,可见等电点前后变色尤其明显;而pH=13的非折叠蛋白构象时,Cyt c也带负电,Au NPs也显示红色.由此可见,我们可以利用Au NPs比色快速灵敏地测定pH=1-13时Cyt c的构象变化.
2.3 Au NPs比色测定L-cys引起的Cyt c构象变化
已有研究发现,Cyt c电化学研究中所采用的有些促进剂(如碘离子[21]、胱氨酸[22])可能会与Cyt c表面的赖氨酸作用进而引起Cyt c分子的构象发生微小的变化.L-Cys也是一种Cyt c电化学活性的促进剂,同时Cyt c中血红素能以共价键与蛋白链中的L-Cys相联[15],而L-Cys与Cyt c相互作用是否也会引起Cyt c构象的变化尚未见报道.我们尝试通过Au NPs比色测定与L-Cys相互作用后Cyt c构象可能出现的微小变化,并用CD光谱进行验证.图5(A)的插图是含不同浓度L-Cys的Cyt c加入Au NPs中后的照片,由图可见,在无L-Cys时,Au NPs为紫色;低浓度L-Cys时,Au NPs为深紫色、蓝色;而高浓度L-Cys时,Au NPs为青色.图5(A)是相应的UVVis吸收光谱,可见,L-Cys浓度逐渐增大时,Au NPs第二等离子共振吸收峰峰位逐渐从短波长(560 nm)向长波长(664 nm)移动.从图5(B)对应不同浓度LCys时Cyt c的CD光谱中可见,随着L-Cys浓度增加,222和208 nm处峰值逐渐增大,据此可推测Cyt c的α螺旋随之逐渐加强,在不含Cyt c的对照实验中,单纯L-Cys并不能引起Au NPs颜色变化.所以外加L-Cys所引起的Au NPs的颜色变化及UV-Vis吸收光谱的变化应来源于Cyt c的构象变化.我们认为,外加L-Cys和原来Cyt c中蛋白链上的L-Cys会竞争与血红素作用,这种竞争作用致使Cyt c发生上述构象变化,从而进一步导致Au NPs显色逐渐加深.
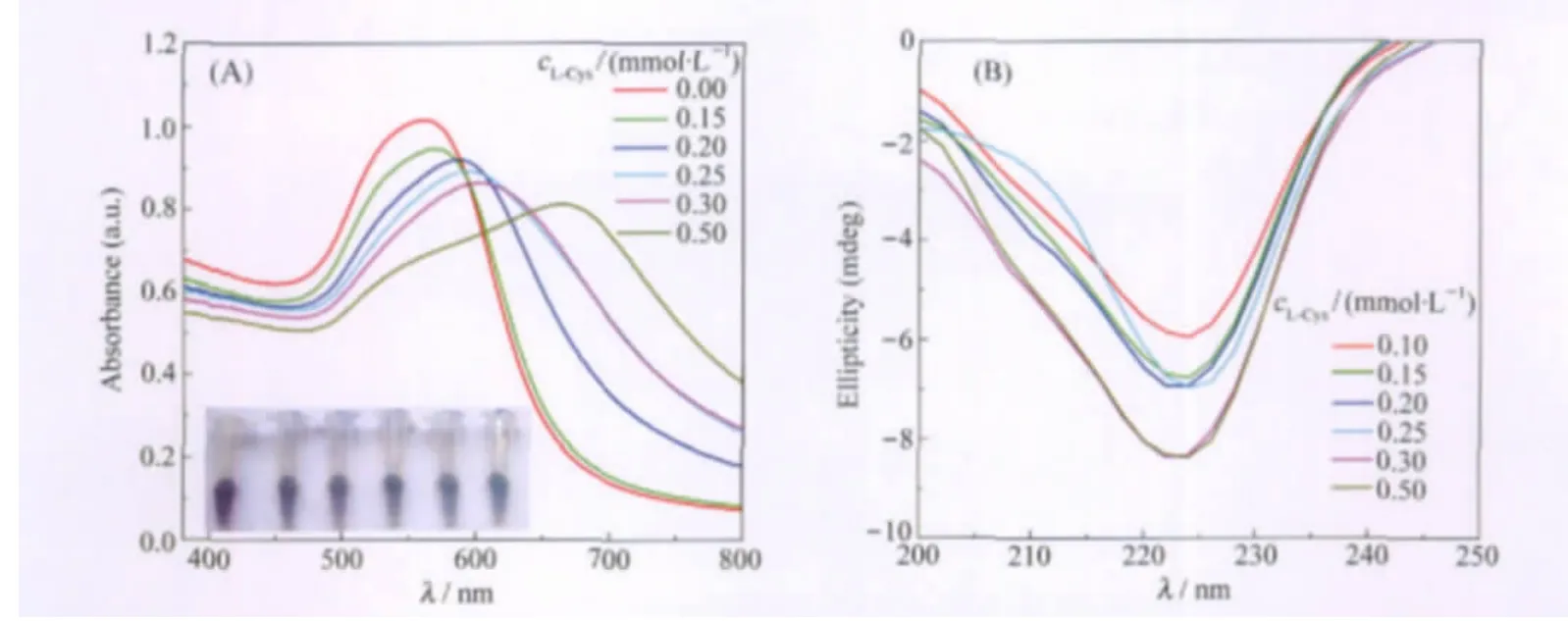
图5 含Cyt c和L-Cys的Au NPs的UV-Vis吸收光谱(A)和含不同浓度L-Cys的Cyt c的CD光谱(B)Fig.5 UV-Vis absorption spectra of Au NPs with Cyt c and L-Cys(A)and CD spectra of Cyt cwith different concentrations of L-Cys(B)Inset:photographs of Au NPs.From left to right,the concentrations of the L-Cys are 0.00,0.15,0.20,0.25,0.30,0.50 mmol·L-1,respectively.
3 结 论
根据Cyt c构象变化能够引起Au NPs的聚集状态变化从而变色这一特性,在改变原测定流程的基础上利用Au NPs比色测定了由H+和L-Cys引起的Cyt c的构象变化.加入pH值分别从1到13的Cyt c可以导致Au NPs分别显示青、蓝、紫、红等颜色;同时pH=7时,当外加L-Cys从低浓度逐渐变化到高浓度引起Au NPs颜色逐渐从紫色变化到蓝色、青色.CD光谱证实了不同浓度H+和L-Cys下Cyt c的构象变化,同时UV-Vis吸收光谱中第二等离子共振吸收峰的移动和SEM图进一步明确了加入不同构象的Cyt c后Au NPs聚集状态的变化.结果表明,可以利用Au NPs比色测定的方法简单、快速地检测其他离子或分子与Cyt c的相互作用所引起的Cyt c构象的变化.
1 Mirkin,C.A.;Letsinger,R.L.;Mucic,R.C.;Storhoff,J.J.Nature, 1996,382(6592):607
2 Katz,E.;Willner,I.Angew.Chem.Int.Edit.,2004,43(19):6042
3 Wang,Z.;Ma,L.Coordin.Chem.Rev.,2009,253(11-12):1607
4 Zhao,W.;Brook,M.A.;Li,Y.Chem.Bio.Chem.,2008,9(15): 2363
5 Li,D.;Wieckowska,A.;Willner,I.Angew.Chem.Int.Edit.,2008, 47(21):3927
6 Liu,J.W.;Lu,Y.Chem.Commun.,2007,(46):4872
7 He,X.R.;Liu,H.B.;Li,Y.L.;Wang,S.;Li,Y.J.;Wang,N.; Xiao,J.C.;Xu,X.H.;Zhu,D.B.Adv.Mater.,2005,17(23):2811
8 Sato,K.;Onoguchi,M.;Sato,Y.;Hosokawa,K.;Maeda,M.Anal. Biochem.,2006,350(1):162
9 Storhoff,J.J.;Elghanian,R.;Mucic,R.C.;Mirkin,C.A.; Letsinger,R.L.J.Am.Chem.Soc.,1998,120(7):1959
10 Guarise,C.;Pasquato,L.;Filippis,V.D.;Scrimin,P.Proc.Natl. Acad.Sci.U.S.A.,2006,103(11):3978
11 Liu,R.R.;Liew,R.;Zhou,J.;Xing,B.G.Angew.Chem.Int.Edit., 2007,46(46):8799
12 Laromaine,A.;Koh,L.L.;Murugesan,M.;Ulijn,R.V.;Stevens, M.M.J.Am.Chem.Soc.,2007,129(14):4156
13 Tsai,C.S.;Yu,T.B.;Chen,C.T.Chem.Commun.,2005,(34): 4273
14 Shang,L.;Wang,Y.;Jiang,J.;Dong,S.Langmuir,2007,23(5): 2714
15 Huang,Z.X.Metal-protein in respiratory chain-cytochrome// Wang,K.Bioinoganic chemistry.1st ed.Beijing:Tsinghua University Press,1988:121-128 [黄仲贤.呼吸链中的金属蛋白-细胞色素.王 夔.生物无机化学.第一版.北京:清华大学出版社,1988:121-128]
16 Chah,S.;Hammond,M.R.;Zare,R.N.Chem.Biol.,2005,12(3): 323
17 Gomes,I.;Santos,N.C.;Oliveira,L.M.A.;Quintas,A.;Eaton,P.; Pereira,E.;Francoet,R.J.Phys.Chem.C,2008,112(42):16340
18 Chen,C.;Song,G.T.;Ren,J.S.;Qu,X.G.Chem.Commun., 2008,(46):6149
19 Frens,G.Nat.Phys.Sct.,1973,241(1):20
20 Valu"ová,E.;Švec,P.;Antalík,M.J.Biol.Inorg.Chem.,2009,14 (4):621
21 Qu,X.G.;Jian,J.;Zhou,C.L.;Lu,T.H.;Huang,S.J.Chem.J. Chin.Univ.,1994,15(12):1854 [曲晓刚,剑 菊,周成立,陆天虹,黄绍俊.高等学校化学学报,1994,15(12):1854]
22 Jian,J.;Qu,X.G.;Lu,T.H.;Wu,Y.Spectroscopy and Spectral Analysis,1997,17(1):108 [剑 菊,曲晓刚,陆天虹,吴 越.光谱学与光谱分析,1997,17(1):108]
Au Nanoparticles Based Colorimetric Detection of Conformational Changes in Cytochrome c
LI Na ZHOU Jian-Zhang*LIN Ling-Ling HAN Nan-Nan LIN Zhong-Hua
(Key Laboratory of Physical Chemistry of Solid Surface,Department of Chemistry,College of Chemistry and Chemistry Engineering,Xiamen University,Xiamen 361005,Fujian Province,P.R.China)
The colors of Au nanoparticles(Au NPs)change along with conformational changes in cytochrome c(Cyt c). We exploited this property for the colorimetric detection of Cyt c conformational changes induced by H+and L-cysteine(L-Cys).We improved the conventional procedure for this detection.After the addition of Cyt c within different pH values,the Au NPs are either cyan,blue,purple or red.This indicates that the Au NPs can be applied to the rapid colorimetric detection of pH-induced conformational changes in Cyt c.At pH 7 the color of Au NPs changes from purple to blue and then cyan upon the addition of L-Cys,which suggests that the Au NPs can be used for the colorimetric detection of Cyt c conformational changes caused by interaction with L-Cys.The conformational changes of Cyt c were verified by circular dichroism(CD)spectroscopy.The relationship between the aggregation states and colors of the Au NPs after the addition of Cyt c was characterized by UV-Vis absorption spectroscopy and scanning electron microscopy(SEM).
Au nanoparticle;Colorimetric detection;Conformational changes of Cyt c;pH value;L-Cys
O648
Received:March 8,2010;Revised:April 22,2010;Published on Web:July 16,2010.
*Corresponding author.Email:jzzhou@xmu.edu.cn;Tel:+86-592-2189663.
The project was supported by the National Natural Science Foundation of China(20603027,20423002).
国家自然科学基金(20603027,20423002)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica
