Ni2P/TiO2-Al2O3催化剂的制备及其加氢脱硫、脱氮性能
2010-11-06郭云涛于洪坤
宋 华 郭云涛 李 锋 于洪坤
(东北石油大学化学化工学院,石油与天然气化工省重点实验室,黑龙江大庆 163318)
Ni2P/TiO2-Al2O3催化剂的制备及其加氢脱硫、脱氮性能
宋 华*郭云涛 李 锋 于洪坤
(东北石油大学化学化工学院,石油与天然气化工省重点实验室,黑龙江大庆 163318)
采用溶胶-凝胶法制备了TiO2-Al2O3复合载体,采用浸渍法制备了Ni2P/TiO2-Al2O3催化剂,并用X射线衍射(XRD)、N2吸附比表面积(BET)测定、热重-差热分析(TG-DTA)、X射线光电子能谱(XPS)等技术对催化剂的结构和性质进行了表征.催化剂加氢脱硫(HDS)和脱氮(HDN)活性评价在实验室固定床连续反应装置上,以噻吩和吡啶为模型反应物进行.考察了不同载体、Ni2P负载量、标称Ni/P摩尔比、催化剂焙烧温度对Ni2P/TiO2-Al2O3催化剂上同时进行的噻吩加氢脱硫和吡啶加氢脱氮性能的影响.结果表明,TiO2含量为80%(w)的TiO2-Al2O3复合氧化物为载体,Ni2P负载量为30.0%(w),标称Ni/P摩尔比为1/2,催化剂焙烧温度为500℃时,Ni2P/TiO2-Al2O3催化剂加氢脱硫脱氮活性最高.在360℃,3.0 MPa,氢油比800(V/V),液时体积空速1.5 h-1的条件下,噻吩HDS和吡啶HDN转化率分别为61.32%和64.43%.
磷化二镍; 二氧化钛; 三氧化二铝; 加氢脱硫; 加氢脱氮
随着原油中重组分以及氮、硫和金属等有害成分的增加,油品中的硫和氮在燃烧过程中生成的硫氧化物和氮氧化物造成的环境污染,使油品脱硫、脱氮问题受到人们广泛的关注[1].催化加氢是油品脱硫、脱氮的重要手段,多年来加氢脱硫(HDS)最受重视,然而,高氮含量重油和某些矿物燃料的加工处理已大势所趋,同时,油品中的氮化物对HDS反应有较强的抑制作用[2].因此,为了得到清洁的油品,研制同时具有HDS和加氢脱氮(HDN)性能的催化剂成为必然.
过渡金属磷化物作为一类加氢精制催化剂新材料,不仅具有很高的加氢脱氮、脱硫活性[3],而且具有良好的抗积碳、抗中毒的能力.尤其是Ni2P催化剂,不仅活性高,而且具有良好的稳定性,引起了人们的极大关注[4-7].非负载型Ni2P催化剂的比表面积非常小(小于1 m2·g-1)[6],为了提高其活性表面积,需将Ni2P负载在较高比表面积的载体上.黄晓凡等[8]以介孔分子筛SBA-15为载体制备的Ni2P含量为20%(w)的Ni2P催化剂,比表面积高达334 m2·g-1.目前,对以Al2O3、ZrO2、TiO2、SiO2等为载体的单一载体Ni2P催化剂的研究较多,而对复合载体Ni2P催化剂的研究较少[9].TiO2-Al2O3复合氧化物结合了Al2O3的高比表面积和TiO2优良的催化性能,两者结合还能产生单独氧化物所不具备的独特的物理化学性能,具有很好的工业应用前景[10],已在裂解汽油、乙烷氧化脱氢、甲醇合成、光催化、炔烃与二烯烃选择加氢等领域表现出许多特殊功能[11].本文采用溶胶-凝胶法制备了Al2O3-TiO2复合氧化物,并以它为载体制备了负载型Ni2P/TiO2-Al2O3催化剂,考察了催化剂制备条件对其同时加氢脱硫、脱氮性能的影响.
1 实验部分
1.1 载体的制备
将钛酸四丁酯(天津市福晨化学试剂厂,化学纯)溶解在无水乙醇(沈阳市华东试剂厂,分析纯)中,滴加乙醇、蒸馏水和冰乙酸(天津市津北精细化工有限公司,分析纯)的混合溶液,其体积比为5∶20∶5∶2∶2,搅拌2 h,静置陈化12 h,于120℃干燥8 h,550℃焙烧3 h,制得TiO2粉末.
将Al(NO3)3·9H2O(沈阳市华东试剂厂,分析纯)和聚乙二醇20000(上海市化学试剂站分装厂,化学纯)加入水中,配成饱和溶液.滴加质量分数为20%的氨水至pH=9.0,静置陈化12 h,干燥,于550℃焙烧即制得Al2O3粉末.
采用溶胶-凝胶法制备TiO2-Al2O3复合氧化物.将钛酸四丁酯和制得的Al2O3粉末按计量比加入到无水乙醇中,滴加乙醇、蒸馏水和冰乙酸的混合溶液(体积比为5∶2∶2),继续搅拌2 h,静置陈化12 h,于 120℃干燥8 h,再在500℃焙烧3 h,制得TiO2含量为80%的TiO2-Al2O3复合氧化物粉末,记为TA.
1.2 催化剂的制备
采用共浸渍法制备催化剂.用计量比的硝酸镍(北京双环化学试剂厂,分析纯)和磷酸二氢铵(西安化学试剂厂,分析纯)的水溶液分别浸渍TiO2和Al2O3粉末,经120℃干燥3 h,再在500℃焙烧3 h,制得Ni2P/TiO2和Ni2P/Al2O3催化剂前驱体,其标称Ni/P摩尔比为1∶2,Ni2P负载量为30%;用计量比的硝酸镍和磷酸二氢铵的水溶液浸渍TA粉末,经120℃干燥3 h,再分别在450、500、550、600℃焙烧3 h,制得不同温度焙烧的Ni2P/TA催化剂前驱体,其标称Ni/P摩尔比为1∶2,Ni2P负载量为30%;保持其他条件不变,改变Ni/P摩尔比制得标称Ni/P摩尔比分别为1∶3、1∶2、1∶1、2∶1、Ni2P负载量为30%的 Ni2P/ TA催化剂,所有样品都在500℃焙烧3 h;保持Ni/ P摩尔比为1:2等其他条件不变,改变Ni2P负载量制得Ni2P负载量分别为0、10%、20%、30%和40%的Ni2P/TA催化剂,所有样品都在500℃焙烧3 h.反应前将以上制得的催化剂前驱体样品用氢气(200 mL·min-1)还原,先以3℃·min-1升至350℃,再以1℃·min-1升至600℃还原2 h,然后降至室温,切换30 mL·min-1N2钝化处理2 h.催化剂记为Ni2P/TA (X-Y-Z),其中X为Ni2P负载量,Y焙烧温度,Z为Ni/P摩尔比.
1.3 催化剂的表征
催化剂的X射线衍射(XRD)分析在日本理学D/ max-2200PC型X射线衍射仪上进行,采用Cu Kα辐射,管电压40 kV,管电流30 mA,扫描速率10(°)· min-1,扫描范围10°-80°.催化剂比表面积是在美国康塔公司生产的NOVA2000e测定仪上进行,利用低温(-196℃)氮气吸附法测定.样品首先在100℃, 1.3 kPa预处理4 h.热重-差热分析(TG-DTA)采用美国Perkin Elmer公司生产的DuPont 2100型热分析仪,空气环境,升温速率为10℃·min-1,样品重量为0.2000 g.用英国Thermo VG Scientific公司生产的电子能谱仪(Sigma Probe),采用Mg Kα特征X射线对催化剂进行X射线光电子能谱(XPS)分析.
1.4 催化剂的评价
催化剂评价在固定床高压连续反应装置中进行.反应前催化剂在500℃通氢气(80 mL·min-1)处理2 h,再降至反应温度,测定其HDS和HDN活性.采用的模型化合物为噻吩、吡啶、十二烷烃和正辛烷的混合溶液,其含量分别为2%、2%、1%和95%.其中,正辛烷为溶剂,十二烷烃为内标物.反应条件均为360℃,3.0 MPa,氢油比800(V/V),空速1.5 h-1,反应3 h.得到的液体产物分析在日本岛津公司生产的GC-14C型气相色谱仪上进行.
2 结果与讨论
2.1 样品的XRD物相分析
2.1.1 不同载体的Ni2P催化剂的XRD分析
图1为用溶胶-凝胶法制备的不同载体的Ni2P催化剂的XRD谱.可以看出,催化剂样品均在40.7°、44.6°和47.3°处出现明显的衍射峰,这与Ni2P相的主要衍射峰(PDF:3-953)一致,说明不同载体制备的催化剂经还原后主要物相均为Ni2P;TiO2主要以锐钛矿型存在.在Ni2P/Al2O3催化剂上出现很强的Ni2P特征峰,Ni2P/TiO2催化剂上Ni2P特征峰相对较弱,而Ni2P/TA催化剂上出现很强的Ni2P特征峰介于两者之间.
2.1.2 不同Ni2P负载量的Ni2P/TA催化剂的XRD分析
不同Ni2P负载量的Ni2P/TA催化剂的XRD分析见图2.由图2可知,起始Ni/P摩尔比为1/2时, TA复合载体不同Ni2P负载量的样品经还原后物相均为Ni2P,且TiO2均以锐钛矿型存在.随着Ni2P负载量的增加,Ni2P的衍射峰强度变大;当Ni2P负载量为40%时,Ni2P的衍射峰强度最强.
2.1.3 不同标称Ni/P摩尔比Ni2P/TA催化剂的XRD分析

图1 由不同载体制得的Ni2P催化剂的XRD谱图Fig.1 XRD patterns of Ni2P catalyst with different supports(1)Ni2P/Al2O3;(2)Ni2P/TA(30-500-1/2);(3)Ni2P/TiO2.TA:TiO2-Al2O3; 30:Ni2P loading(%);500:calcined temperature(℃); 1/2:molar ratio of Ni/P

图2 不同Ni2P负载量的Ni2P/TA催化剂的XRD谱图Fig.2 XRD patterns of Ni2P/TA with various Ni2P loading(1)TA;(2)Ni2P/TA(10-500-1/2);(3)Ni2P/TA(20-500-1/2); (4)Ni2P/TA(30-500-1/2);(5)Ni2P/TA(40-500-1/2)
不同标称Ni/P摩尔比的Ni-P/TA催化剂的XRD谱图见图3.由图3可知,Ni2P负载量为30.0% (w)时,由标称Ni/P摩尔比为1/3、1/2和1/1的前驱体制备的样品只有一个物相,即Ni2P,且随着标称Ni/P摩尔比的增大,Ni2P的衍射峰强度变大,这表眀随着Ni/P摩尔比的增加,形成了更大的Ni2P晶粒,此结果与李冬燕[6]在Ni2P/TiO2上观察到的结果一致.继续增加标称Ni/P摩尔比到2/1、3/1时,谱图中观察不到Ni2P的衍射峰,但在2θ约为36.2°、41.8°、43.6°、44.5°、45.2°、46.6°、50.4°、52.0°、52.8°时出现了新的衍射峰,该新衍射峰与粉末衍射卡(PDF: 74-1384)一致,确定为Ni3P物相,表明镍含量过高时,会导致由亚稳相Ni2P转变为稳定相Ni3P.

图3 不同标称Ni/P摩尔比的Ni2P/TA催化剂的XRD谱图Fig.3 XRD patterns of Ni2P/TA obtained from various initial Ni/P molar ratios(1)Ni2P/TA(30-500-1/3);(2)Ni2P/TA(30-500-1/2);(3)Ni2P/T (30-500-1/1);(4)Ni2P/TA(30-500-2/1)(5)Ni2P/TA(30-500-3/1)
2.1.4 不同焙烧温度的Ni2P/TA催化剂XRD分析
图4为不同温度下焙烧得到的Ni2P/TA催化剂前驱体还原后的XRD谱图.由图4可知,各温度下焙烧的Ni2P/TA催化剂前驱体经还原后的物相均为Ni2P,且特征峰均较明显.当焙烧温度为450-500℃时,TiO2的晶型为锐钛矿型;焙烧温度为550-600℃时,除了较强的TiO2锐钛矿型特征峰外,在2θ约为23.2°、26.5°时出现了新的衍射峰,该新衍射峰与粉末衍射卡(PDF:18-1403)一致,确定为Ti7O13物相.
2.2 样品比表面积
表1为不同载体负载的Ni2P催化剂的比表面积.可以看出,各载体比表面积大小顺序为Al2O3>TA>TiO2,这说明TiO2的引入堵塞了Al2O3载体的部分孔道,导致样品比表面积减小;由于负载了一定量的Ni和P,以TA、Al2O3和TiO2为载体制备的Ni2P催化剂比表面积均比相应载体的有所下降,各催化剂比表面积大小顺序为Ni2P/TA>Ni2P/Al2O3>Ni2P/TiO2,说明复合氧化物载体可以分散和稳定氧化物表面的Ni2P,并对催化剂具有一定的调变作用.这与张强等[12]在W2N/TiO2-Al2O3催化剂观察到的现象一致.
2.3 Ni2P/TA催化剂的TG-DTA分析
图5为未经焙烧的Ni2P/TA(30-500-1/2)催化剂前驱体的TG-DTA表征结果.由图5可知,DTA曲线上出现了多个明显的吸热峰,且在TG曲线上皆有与之对应的失重.第一个的吸热峰出现在0-100℃之间,是催化剂前驱体中NH4NiPO4·H2O的结晶水和表面吸附水的脱除峰;在100-150℃之间的吸热峰是过量的磷酸二氢铵的分解峰[13];150-270℃之间的吸热峰是NH4NiPO4分解的峰,270-500℃之间的放热峰是NiP4O12晶化的峰,此结果与Wang等[14]通过XRD观察到的最终在500℃时转化为晶态NiP4O12相吻合.所发生的反应如下[14]:

图4 不同焙烧温度的Ni2P/TA催化剂的XRD谱图Fig.4 XRD patterns of Ni2P/TA calcinated at various temperatures(1)Ni2P/TA(30-450-1/2);(2)Ni2P/TA(30-500-1/2); (3)Ni2P/TA(30-550-1/2);(4)Ni2P/TA(30-600-1/2)

表1 载体和催化剂的比表面积Table 1 Surface area of the supports and catalysts

在100-400℃温区内,随着温度的升高,失重率先增加后迅速减少;在178.9-278.1℃温区内,失重率最大,达30.2%(w);到500℃时基本趋于稳定.
2.4 XPS结果
图6为不同载体制备的Ni2P催化剂的XPS谱图.由图6(a)可见,结合能为852.3 eV的峰可归属为Ni2P中的Ni物种,结合能为856.3 eV的峰可归属为Ni3(PO4)2中的Ni2+物种[15-16].由图6(b)可见,结合能为129.5 eV的峰为Ni2P中的P物种[17],结合能为134.3 eV的峰由133.8和134.8 eV两个峰叠加而成的,均由于Ni2P颗粒表面氧化所造成[18],这与Cecilia等[19]的结果一致,133.8 eV处的峰为Ni2P表面钝化层H2PO-3的P5+物种,而134.8 eV处的峰为Ni2P表面钝化层Ni3(PO4)2中的P5+物种.由图6(c)可以更直观了解催化剂表面各元素的原子百分含量.所有试样表面均存在较多的O元素和少量C元素.C 1s峰主要对应C—C键,说明C主要来自环境气氛污染;催化剂表面C元素原子百分比高低顺序为Ni2P/TiO2>Ni2P/TA(30-500-1/2)>Ni2P/Al2O3.在Ni2P/ TA(30-500-1/2)催化剂中,Ti 2p的结合能为458.6 eV,说明Ti主要以TiO2形式存在[20],而Ni2P/Al2O3催化剂中Al 2p的结合能为74.58 eV,表明Al主要是以Al2O3的形式存在.

图5 未经焙烧的Ni2P/TA催化剂前驱体的TG-DTA图Fig.5 TG-DTA curves for non-calcined Ni2P/TA catalyst precursor

图6 由不同载体制得的Ni2P/TiO2-Al2O3催化剂的XPS谱Fig.6 XPS spectra for the Ni2P catalyst with different supports(a)Ni 2p core level of spectra;(b)P 2p core level of spectra;(c)the survey scan spectra; (1)Ni2P/Al2O3;(2)Ni2P/TA(30-500-1/2);(3)Ni2P/TiO2
表2列出了由不同载体制得的Ni2P/TiO2-Al2O3催化剂表面元素摩尔比.由表2可见,催化剂表面Ni/P元素摩尔比高低顺序为Ni2P/TiO2>Ni2P/TA(30-500-1/2)>Ni2P/Al2O3,表明TiO2的引入可以提高表面Ni的含量.其原因一方面是在Al2O3中引入TiO2,可以减弱Ni2P和Al2O3载体间强相互作用,从而抑制表面副产物AlPO4的生成[10],使表面P含量降低;另一方面,可能是TiO2影响了Ni2P的表面组成或者配位状态.Oyama等[21]提出Ni2P中Ni可以有两种配位状态Ni(1)和Ni(2).Ni(1)中心是近似四面体结构,其周围最近处有4个P原子,次近处有8个Ni原子,而Ni(2)中心是四棱锥结构,周围最近处有5个P原子,次近处有6个Ni原子;形成的Ni(2)中心较多时相对具有较高的Ni/P,且具有较好的HDS活性.由此我们推测,TiO2的加入可能使表面具有更多的Ni(2)中心,从而提高了Ni含量.催化剂的标称Ni/P摩尔比为1∶2,但表面Ni/P远小于这个值,这是由于催化剂表面钝化层中P的高分散富集造成的.Ni2P/Al2O3催化剂表面Al/P元素摩尔比高于Ni2P/TA(30-500-1/2)催化剂的,这主要是Al含量的减少和P在表面处的富集造成.

表2 由不同载体制得的Ni2P催化剂的表面元素摩尔比Table 2 Surface elemental molar ratios of Ni2P catalyst with different supports
2.5 催化剂的催化反应性能
2.5.1 载体对Ni2P催化剂催化性能的影响
图7为由不同载体制备的Ni2P催化剂的同时HDS和HDN活性测定结果.由图7可知,在同样的反应条件下,单一载体催化剂同时加氢脱硫、脱氮活性均低于复合载体的催化活性,催化剂活性顺序为Ni2P/TA(30-450-1/2)>Ni2P/Al2O3>Ni2P/TiO2.XPS分析得出TiO2的引入可以提高表面Ni的含量,抑制表面副产物AlPO4的生成,形成更多的Ni(2)中心,有利于催化剂加氢活性提高,但比表面积分析表明TiO2含量过高会使催化剂比表面积降低,催化剂有效活性位的数目减少,不利于催化剂加氢活性提高.因此,具有较大的比表面积(见表1),且含有适量TiO2(80%(w))的Ni2P/TA(30-450-1/2)催化剂具有较高的加氢活性.
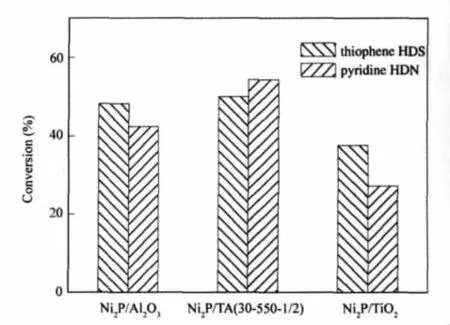
图7 载体对Ni2P催化剂活性的影响Fig.7 Influence of supports on the activity of Ni2P catalystreactionconditions:360℃,3.0MPa,V(H2)/V(oil)=800,VHSV=1.5h-1
2.5.2 Ni2P负载量对催化剂同时HDS和HDN活性的影响
图8给出了Ni2P负载量对Ni2P/TA(X-500-1/2)催化剂同时HDS和HDN活性的影响,转化率越高, HDS和HDN活性越好.由图8可以看出,当Ni2P负载量小于30%时,Ni2P/TA催化剂噻吩HDS和吡啶HDN活性随Ni2P负载量增加均逐渐增加;Ni2P负载量达到30%时,Ni2P/TA催化剂具有最佳的噻吩HDS和吡啶HDN活性;继续增加Ni2P负载量,催化剂的噻吩HDS和吡啶HDN活性均随Ni2P负载量增加而下降.这可能是负载量低时,活性组分虽然能够在载体表面得到较好的分散,但其数量较少;而负载量过高时,活性组分在载体上分散性较差,导致活性相中心Ni2P晶粒长大,因而活性下降.这与在研究Ni2P/SiO2催化剂[22]以及Ni2P/TiO2催化剂[6]时得到的实验结果一致.
2.5.3 标称Ni/P摩尔比对催化剂同时HDS和HDN活性的影响
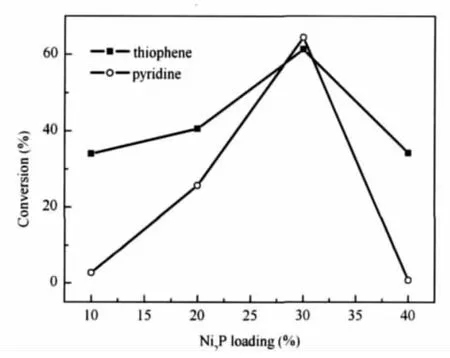
图8 Ni2P负载量对Ni2P/TA(X-500-1/2)催化剂活性的影响Fig.8 Influence of Ni2P loading on the activity of the Ni2P/TA(X-500-1/2)catalysReaction conditions are the same as those in Fig.7.
图9 给出了标称Ni/P摩尔比对Ni2P/TA(30-500-Z)催化剂活性的影响.由图9可知,在Ni/P摩尔比由1∶3增加到1∶2时,随着Ni/P摩尔比的增加,噻吩HDS和吡啶HDN活性均迅速升高,在Ni/P摩尔比为1∶2时,噻吩HDS和吡啶HDN转化率均达到最高值;继续增加Ni/P摩尔比,噻吩HDS和吡啶HDN活性均迅速降低,尤其在Ni/P摩尔比大于2∶1时,吡啶加氢转化率只有2%左右.文献报道的Ni2P/ TiO2催化剂上噻吩加氢脱硫实验表明[6],适当增加P含量,有利于减小在催化剂上Ni2P的晶粒大小,活性组分在表面的分散度高,催化剂有较好的脱硫活性,但P含量过高,易导致催化剂表面的P过剩,从而降低了脱硫活性,标称Ni/P摩尔比为1∶2时,噻吩加氢脱硫效果最好.由此认为,Ni/P摩尔比为1∶3时,活性低的原因是催化剂表面的P过剩造成的; Ni/P摩尔比由1∶2变化到1∶1时,其活性降低的原因是,活性相Ni2P晶粒变大,导致活性组分在载体上分散性较差而致;继续增大Ni/P摩尔比时,亚稳相Ni2P转变为稳定相Ni3P(见图3),因生成了大量Ni3P导致加氢活性下降.
2.5.4 催化剂焙烧温度对催化剂性能的影响
图10为焙烧温度对Ni2P/TA(30-Y-1/2)催化剂同时HDS和HDN活性的影响.由图10可知,随着催化剂焙烧温度的升高,噻吩HDS活性和吡啶HDN活性都先增加后降低,在温度为500℃时噻吩的HDS和吡啶的HDN转化率均达到最大值,分别为61.32%和64.43%,所以较适宜的焙烧温度为500℃.其原因可能是:升高焙烧温度有利于催化剂表面上活性物种的分散,所以催化剂的活性先随着焙烧温度的提高而增加;但焙烧温度过高会导致催化剂活性组分烧结,活性反而降低.此外,XRD分析中(见图4)发现,焙烧温度为600℃时,出现了Ti7O13物相,这也是过高的焙烧温度会导致催化剂的催化活性下降的原因之一.催化剂的TG-DTA分析中发现, 500℃时催化剂失重趋于基本稳定与适宜的焙烧温度为500℃的活性评价实验结果相一致.

图9 标称Ni/P摩尔比对Ni2P/TA(30-500-Z)催化剂活性的影响Fig.9 Influence of initial Ni/P molar ratio on the activity of the Ni2P/TA(30-500-Z)catalystReaction conditions are the same as those in Fig.7.

图10 焙烧温度对Ni2P/TA(30-Y-1/2)催化剂活性的影响Fig.10 Influence of calcinated temperature on the activity of the Ni2P/TA(30-Y-1/2)catalystReaction conditions are the same as those in Fig.7.
3 结 论
采用溶胶-凝胶法制备了TiO2-Al2O3复合氧化物,并采用浸渍法制备了Ni2P/TiO2-Al2O3复合载体催化剂.复合氧化物载体可以分散和稳定氧化物表面的Ni2P,并对催化剂具有一定的调变作用,与单载体负载的Ni2P/Al2O3和Ni2P/TiO2催化剂相比,复合载体制备的Ni2P/TiO2-Al2O3催化剂具有更大的比表面积和优良的HDS和HDN性能.在焙烧过程中, Ni2P/TiO2-Al2O3催化剂前驱体在150-270℃之间发生NH4NiPO4的分解,在500℃左右完成NiP4O12的晶化过程.由标称Ni/P摩尔比为1/3、1/2和1/1的前驱体制备的样品在XRD谱图中只有Ni2P物相, Ti主要以TiO2形式存在,Al主要是以Al2O3的形式存在;增加标称Ni/P摩尔比到2/1、3/1时,Ni2P的衍射峰消失,出现了Ni3P的衍射峰,此时催化剂的HDS活性较差,而HDN活性几乎为零,因此,Ni/P摩尔比不宜超过1/1.不同Ni2P负载量制得的催化剂只有Ni2P相.TiO2的引入可以提高催化剂表面Ni的含量,由于催化剂表面钝化层中P的高分散富集,表面Ni/P远小于标称Ni/P摩尔比为1∶2.
1 Abu,I.I.;Smith,K.J.Appl.Catal.A-Gen.,2007,328:58
2 Kwak,C.;Lee,J.J.;Bae,J.S.;Moon,S.H.Appl.Catal.B,2001, 35:59
3 Koranyi,T.I.;Vit,Z.;Nagy,J.B.Catal.Today,2008,130:80
4 Sawhill,S.J.;Phillips,D.C.;Bussell,M.E.J.Catal.,2003,215: 208
5 Stinner,C.;Tang,Z.;Haouas,M.;Weber,T.;Prins,R.J.Catal., 2002,208:456
6 Li,D.Y.;Yu,X.Z.;Chen,C.L.;Xu,N.P.;Wang,Y.R.J.Chem. Eng.Chin.Univ.,2006,21:825 [李冬燕,余夕志,陈长林,徐南平,王延儒.高校化学工程学报,2006,21:825]
7 Oyama,S.T.J.Catal.,2003,216:343
8 Huang,X.F.;Ji,S.F.;Wu,P.Y.;Liu,Q.Q.;Liu,H.;Zhu,J.Q.; Li,C.Y.Acta Phys.-Chim.Sin.,2008,24(10):1773 [黄晓凡,季生福,吴平易,刘倩倩,刘 辉,朱吉钦,李成岳.物理化学学报,2008,24(10):1773]
9 Wei,Y.;Liu,X.X.Petrochem.Technol.,2006,35(2):173 [韦 以,刘新香.石油化工,2006,35(2):173]
10 Song,H.;Yu,H.K.;Wu,X.C.;Guo,Y.T.Chin.J.Catal.,2010, 31(4):447 [宋 华,于洪坤,武显春,郭云涛.催化学报,2010, 31(4):447]
11 Duan,A.J.;Li,R.L.;Jiang,G.Y.;Gao,J.S.;Zhao,Z.;Wan,G.F.; Zhang,D.Q.;Huang,W.Q.;Chung,K.H.Catal.Today,2009, 140:187
12 Zhang,Q.;Li,B.S.;Sun,G.D.;Zhou,Z.J.J.Photochem.Univ., 2007,20:18 [张 强,李保山,孙桂大,周志军.石油化工高等学校学报,2007,20:18]
13 Hu,G.R.;Xiao,Z.W.;Du,K.;Peng,Z.D.;Deng,X.R.Chin.J. Nonferrous Met.,2007,17(12):2014 [胡国荣,肖政伟,杜 柯,彭忠东,邓新荣.中国有色金属学报,2007,17(12):2014]
14 Wang,R.;Smith,K.J.Appl.Catal.A-Gen.,2010,380:149
15 Guo,Y.N.;Zeng,P.H.;Ji,S.F.;Wei,N.;Liu,H.;Li,C.Y.Chin. J.Catal.,2010,31(3):329 [郭亚男,曾鹏晖,季生福,魏 妮,刘 辉,李成岳.催化学报,2010,31(3):329]
16 Kanama,D.;Oyama,S.T.;Otani,S.;Cox,D.F.Surf.Sci.Spectra, 2001,8:220
17 Bertrand,P.A.J.Vac.Sci.Technol.,1981,18:28
18 Abu,I.I.;Smith,K.J.J.Catal.,2006,241:356
19 Cecilia,J.A.;Infantes-Molina,A.;Rodríguez-Castellón,E.; Jiménez-López,A.J.Catal.,2009,263:4
20 Zhang,H.;Tan,X.;Zhao,L.;Ma,H.Q.Chemistry,2005,68: w095 [张 昊,谭 欣,赵 林,马红钦.化学通报,2005,68: w095]
21 Oyama,S.T.;Lee,Y.K.J.Catal.,2008,258:393
22 Oyama,S.T.;Wang,X.;Lee,Y.K.;Chun,W.J.J.Catal.,2004, 221:263
Preparation,Hydrodesulfurization and Hydrodenitrogenation Performance of a Ni2P/TiO2-Al2O3Catalyst
SONG Hua*GUO Yun-Tao LI Feng YU Hong-Kun
(Provincial Key Laboratory of Oil and Gas Chemical Technology,College of Chemistry and Chemical Engineering, Northeast Petroleum University,Daqing 163318,Heilongjiang Province,P.R.China)
We prepared a TiO2-Al2O3complex support by the sol-gel method.A nickel phosphide catalyst,Ni2P/ TiO2-Al2O3,was prepared by the impregnation method.The catalysts were characterized by X-ray diffraction(XRD), N2-adsorption specific surface area measurements(BET),thermogravimetry-differential thermal analysis(TG-DTA),and X-ray photoelectron spectroscopy(XPS).The catalysts were evaluated using a lab-scale continuous flow fixed-bed reactor for simultaneously hydrodesulfurization(HDS)and hydrodenitrogenation(HDN)of thiophene and pyridine. The effects of different supports,Ni2P loading,Ni/P molar ratio,and calcination temperature on catalyst activity for the HDS and HDN were studied.The catalytic activity of the Ni2P/TiO2-Al2O3catalyst with a TiO2mass fraction of 80%,a Ni2P loading of 30.0%(w),a Ni/P molar ratio of 1/2 as well as a calcination temperature of 500℃was found to be optimal.At a reaction temperature of 360℃,a pressure of 3.0 MPa,a hydrogen/oil ratio of 800(V/V),and a liquid hourly space velocity of 1.5 h-1,the conversion of thiophene HDS and pyridine HDN were 61.32%and 64.43%,respectively.
Nickel phosphide; Titanium dioxide; Aluminium trioxide;Hydrodesulfurization; Hydrodenitrogenation
O643;TE624;TQ426
Received:March 30,2010;Revised:May 22,2010;Published on Web:August 3,2010.
*Corresponding author.Email:songhua@dqpi.edu.cn;Tel:+86-459-6503167.
The project was supported by the Heilongjiang Science and Technology Agency,China(2009G0947-00).
黑龙江省科技厅(2009G0947-00)资助项目
ⒸEditorial office of Acta Physico-Chimica Sinica
