RBP4对游泳训练大鼠脂肪细胞IR和IRS-1蛋白表达和磷酸化的影响
2010-11-06张明军
张明军
RBP4对游泳训练大鼠脂肪细胞IR和IRS-1蛋白表达和磷酸化的影响
张明军
目的:观察视黄醇结合蛋白4(RBP4)对大鼠脂肪细胞IR和IRS-1蛋白表达和磷酸化的影响。方法:RBP4孵育8周游泳运动组和安静对照组大鼠(8周龄SD)脂肪细胞,检测脂肪细胞葡萄糖摄取、IR和IRS-1蛋白表达和磷酸化。结果:RBP4孵育后,运动组大鼠脂肪细胞基础和胰岛素刺激状态下葡萄糖摄取率显著高于安静对照组,游泳运动组和安静对照组大鼠脂肪细胞IR蛋白表达、磷酸化和IRS-1蛋白表达变化无统计学差异。RBP4孵育后,运动组大鼠脂肪细胞IRS-1磷酸化程度较安静对照组显著增加。结论:8周游泳运动能够增加RBP4孵育后的大鼠脂肪细胞葡萄糖摄取和IRS-1磷酸化程度,改善RBP4诱导的脂肪细胞胰岛素抵抗。
游泳运动;视黄醇结合蛋白4;胰岛素抵抗;胰岛素受体;胰岛素受体底物
胰岛素受体(IR)与胰岛素结合后酪氨酸残基发生自磷酸化,为下游的船坞蛋白(docking protein)提供结合位点,这些下游蛋白随后发生一系列的磷酸化,将胰岛素信号向下游传导,调节细胞的葡萄糖摄取和其他代谢功能,胰岛素受体底物(IRS)即是这种蛋白中的一类。胰岛素信号传导缺陷是胰岛素抵抗发生的主要原因,为了顺利传导胰岛素信号,胰腺β细胞分泌更多的胰岛素,最终β细胞功能失代偿,出现2型糖尿病。胰岛素抵抗细胞的受体、受体底物数量和磷酸化程度会随着细胞外胰岛素浓度的改变而发生相应变化,以适应胰岛素浓度的增加[1],在一定程度上维持胰岛素功能的正常发挥。
视黄醇结合蛋白4(RBP4)是一个新发现的导致胰岛素抗性的脂肪因子,在胰岛素抗性发展中起到一个关键作用,具有胰岛素抗性的小鼠和患有肥胖和2型糖尿病的病人体内,血清RBP4的水平是升高的[2]。前期研究发现:2型糖尿病大鼠附睾脂肪中RBP4mRNA和蛋白表达增加,循环RBP4水平升高,出现胰岛素抵抗,8周游泳运动能够降低2型糖尿病大鼠附睾脂肪中RBP4mRNA、蛋白表达和循环RBP4水平,缓解胰岛素抵抗[3]。为探讨运动如何通过影响RBP4而改善胰岛素抵抗,本研究对运动大鼠脂肪细胞进行培养,在体外观察RBP4对脂肪细胞葡萄糖转运以及对IR和胰岛素受体底物1(IRS-1)蛋白表达和磷酸化的影响,探索运动改善胰岛素抵抗的新机制。
1 研究材料与方法
1.1 材 料
胰岛素、2-Deoxy-D-[I-3H]-glucose购自Biogenesis(Poole,UK);抗胰岛素受体(IR)、胰岛素受体底物1(IRS1)抗体,抗IR磷酸化(Y1355)和IRS-1(Ser 307)磷酸化抗体均购自Sigma-Aldrich(St.Louis,MO,USA),相应的Ⅱ抗体均购自北京中杉金桥公司,其余试剂为国产分析纯。
1.2 方 法
1.2.1 大鼠脂肪细胞的分离和活性检测 SD雄性大鼠,8周龄,体重180~210 g,上海斯莱克实验动物公司提供,许可证号:SCXK(沪)2003-0003。随机分为游泳运动组和安静对照组,每组12只。运动组按照Ploug方法[4]训练8周,每周训练5天,每天无负重游泳60 min。安静对照组大鼠浸水后捞出。第8周末运动后断头处死大鼠,参照Rodbel[5]方法分离24只大鼠附睾脂肪细胞,分别配制成24份1×106个/mL的细胞悬液,0.4%台盼蓝1∶9与细胞悬液混合,3 min内计数活脂肪细胞(未着色细胞)占总脂肪细胞数百分比,结果显示存活率大于99%。
1.2.2 脂肪细胞培养、RBP4孵育和葡萄糖摄取率的检测 取计数的24份大鼠脂肪细胞悬液0.5 mL,分别加入聚丙烯培养管中37℃、5%CO2的培养箱培养20 h,贴壁后,12份运动大鼠细胞分为等数的2组,分别加入40 μg/L+25 mmol·L-1D葡萄糖,胰岛素刺激状态下葡萄糖摄取组加入10 U·L-1胰岛素,基础状态下葡萄糖摄取组不添加胰岛素。12份安静大鼠细胞分组方式与运动组相同。继续培养24 h,冰硅油终止反应,离心除去下层培养液,液闪计数仪测定脂肪细胞葡萄糖摄取率。各组内同比重复2次,实验共重复5次。
1.2.3 脂肪细胞胰岛素刺激状态下IR和IRS-1蛋白表达的检测 取运动组和安静对照组胰岛素刺激状态下脂肪细胞,分别经PBS洗2次,使用细胞溶解液消化1 h,离心15 min(4℃、12 000ⅹg),采取上清液放入-80℃中保存备用。West bloting法测定IR和IRS-1蛋白表达,100 ug细胞溶解物SDS-PAGE蛋白分离,然后转移至硝酸纤维素膜。在室温用5%低脂奶粉PBS液封膜3 h。加入抗IR或抗IRS-1抗体(工作浓度1∶4 000)4℃孵育过夜,洗涤后加入相应辣根过氧化酶标记的Ⅱ抗(工作浓度1∶5 000)分别孵育1 h,洗膜方法同前。充分洗涤后与ECL(增强化学发光剂,英国Amersham)反应,即刻与KadakX-Omat底片曝光洗片后用LeicaQ550-IW图像分析仪(德国)进行扫描,测定光密度,进行定量分析。
1.2.4 脂肪细胞IR和IRS-1磷酸化的检测 免疫沉淀检测IR和IRS-1的磷酸化程度:细胞内总蛋白的提取及浓度测定方法同前;各取100 μg总蛋白,分别加入抗IR和IRS-1抗体(工作浓度1∶2 000),4℃孵育轻摇过夜,加入100 μL10%A-Sepharose进行沉淀,洗涤免疫沉淀复合物后加入50 μL2×SDS上样缓冲液煮沸5 min;离心3 min,取上清,按前述方法电泳、转膜、封闭过夜,加抗磷酸酪氨酸抗体(工作浓度1∶1 000),洗膜,加辣根过氧化物酶标记的Ⅱ抗(工作浓度1∶5 000);曝光,洗片,其分析方法同上。
1.3 统计学处理
所有数据以SPSS11.0版进行统计,数据以均数±标准差表示,方差齐性采用Levene检验,运动组与安静对照组进行独立样本T检验,双侧检验,P<0.05为差异具有统计学意义,P<0.01为差异具有显著统计学意义。
2结 果
2.1 脂肪细胞葡萄糖摄取的变化
RBP4孵育后,与安静组脂肪细胞相比,运动组脂肪细胞基础状态下(未添加胰岛素)和胰岛素刺激状态下的葡萄糖摄取率显著增加(P<0.01)(见表1)。
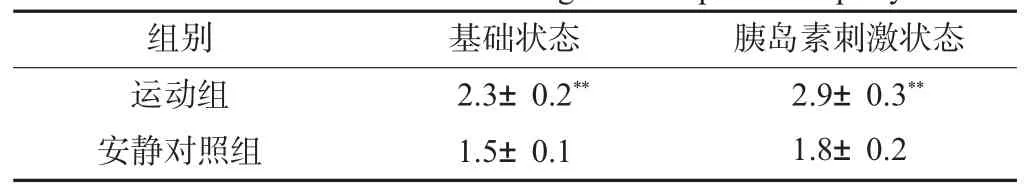
表1 RBP4对脂肪细胞葡萄糖摄取率的影响Table 1 Effects of RBP4 on glucose uptake in lipocyte
2.2 脂肪细胞IR、IRS-1蛋白表达和磷酸化变化
RBP4孵育后,胰岛素(10U·L-1)刺激状态下,运动组和安静对照组脂肪细胞IR蛋白表达和磷酸化程度差异无统计学意义(P>0.05);运动组和安静对照组脂肪细胞IRS-1蛋白表达差异无统计学意义(P>0.05)。与安静对照组相比,运动组脂肪细胞IRS-1磷酸化程度显著增加(P<0.01)(见图1-图3)。



3讨 论
RBP4是最近发现的一种脂肪因子,与胰岛素抵抗的关系密切。Graham和Qin Yang发现RBP4与胰岛素抗性的发生存在某种联系,通过运动而改善了胰岛素敏感性的人和小鼠,其血清中RBP4水平也降低[6]。脂肪细胞是对胰岛素敏感的靶细胞之一,常作为胰岛素抵抗机制的研究模型,其对胰岛素敏感性的改变表现为胰岛素刺激状态下葡萄糖转运能力的改变[7]。胰岛素刺激的脂肪细胞葡萄糖转运是通过IR、IRS、磷脂酰肌醇3激酶(PI3K)和葡萄糖转运子(GLUT)等一系列信号传导过程完成的,胰岛素信号转导通路中的任何一个环节异常均可以引起胰岛素抵抗。
为研究运动如何通过影响RBP4而改善胰岛素敏感性,我们在体外复制了高RBP4生理环境,建立脂肪细胞模型,诱导脂肪细胞出现胰岛素抵抗,观察运动组和安静对照组大鼠脂肪细胞葡萄糖摄取率变化情况。研究结果显示,RBP4对运动组大鼠脂肪细胞基础和胰岛素刺激状态下葡萄糖转运的抑制程度明显比安静对照组轻,表明运动组脂肪细胞耐受RBP4的能力高于安静对照组,运动组脂肪细胞胰岛素敏感性高于安静对照组,提示运动能够改善RBP4诱导的脂肪细胞胰岛素抵抗,但其作用机制尚不清楚。
胰岛素作用于脂肪细胞,将胰岛素信号通过胰岛素受体实现跨膜传递,IR通过膜外部分与胰岛素结合,使包括IR、IRS在内的一系列物质磷酸化,胰岛素信号得以传入细胞内,发挥调节细胞生长、繁殖、分化及代谢的生理功能。高RBP4水平能够诱导大鼠脂肪细胞出现胰岛素抵抗,表现出葡萄糖转运效率下降,而8周游泳运动则能够改善大鼠脂肪细胞葡萄糖摄取率,提高胰岛素敏感性,提示与胰岛素信号传递有关的信号蛋白表达量发生变化或功能得到改善。为了观察高RBP4状态下,运动大鼠脂肪细胞IR蛋白表达变化情况,探索运动改善RBP4诱导的胰岛素抵抗的机制,给予大鼠脂肪细胞RBP4孵育后,我们检测了胰岛素刺激后大鼠脂肪细胞IR蛋白表达和磷酸化的变化,结果显示,RBP4同等程度地抑制了运动组和安静对照组大鼠脂肪细胞IR蛋白表达和磷酸化。IR是细胞膜受体,与胰岛素结合后激活亚基内的受体酪氨酸蛋白激酶,再通过磷酸化细胞内的底物如IRS-1和PI3K等介导包括葡萄糖转运,糖原合成等信号传递途径。Danielsson A等[8]研究显示,无论是RBP4孵育正常人或糖尿病者的脂肪细胞后,并没有影响IR的磷酸化而改变胰岛素敏感性。提示RBP4引起的胰岛素信号传导链缺陷并不是发生在IR环节。本研究结果也提示:与安静对照组相比,8周游泳运动没有增加RBP4孵育后的大鼠脂肪细胞IR蛋白表达和磷酸化,运动改善RBP4诱导的胰岛素抵抗机制与IR变化无关,推测IR的下游信号蛋白IRS的变化可能在这一调节机制中扮演重要角色。
为进一步确定运动改善RBP4诱导的胰岛素抵抗的作用位点,本研究选择IRS-1蛋白作为研究对象,观察RBP4对大鼠脂肪细胞IRS-1蛋白表达和磷酸化的影响,结果显示,RBP4同等程度地抑制了安静对照组和运动组大鼠脂肪细胞IRS-1蛋白表达,但RBP4对运动组大鼠脂肪细胞IRS-1蛋白磷酸化的抑制程度显著低与安静对照组,提示RBP4孵育后,运动大鼠脂肪细胞IRS-1在胰岛素刺激后的磷酸化程度高于安静对照组,其作用位点和Anita Ost等[9]对人脂肪细胞研究的结果一致。IRS是IR酪氨酸激酶的底物,也是胰岛素信号传递的中介,IRS家族系列中,IRS-1在胰岛素信号传递过程发挥重要作用。IRS-1表达量和磷酸化程度的改变都对胰岛素抵抗产生影响,研究证明:IRS-1基因剔除小鼠均表现出胰岛素抵抗症状[10]。脂肪组织是胰岛素作用的主要外周靶组织之一,肥胖患者的脂肪细胞IRS-1表达降低,胰岛素作用减弱,出现胰岛素抵抗[11],在一些多囊卵巢综合征合并胰岛素抵抗患者子宫内膜IRS-1蛋白的表达也明显降低[12]。所以,IRS-1mRNA稳定性降低、表达的减少和编码区变异导致的IRS功能减弱,都可以引起胰岛素抵抗。随后对2型糖尿病病人的研究也证实了IRS-1磷酸化和胰岛素抵抗的关系,在骨骼肌被注射胰岛素以后,IRS-1酪氨酸磷酸化程度显著低与正常人[13]。本研究显示,RBP4孵育后,运动组与安静对照组大鼠脂肪细胞IRS-1蛋白表达量无显著性差异,而胰岛素刺激下的葡萄糖摄取率却显著增加,推测脂肪细胞IRS-1蛋白表达量的变化没有在运动改善RBP4诱导的胰岛素抵抗机制中发挥作用,而脂肪细胞IRS-1磷酸化程度的增加则合理的解释了运动改善RBP4诱导的胰岛素抵抗的作用机制。
综上所述,8周游泳运动后,大鼠脂肪细胞对RBP4诱导的胰岛素抵抗的耐受能力提高,表现为脂肪细胞葡萄糖摄取率增加,脂肪细胞IRS-1磷酸化程度增加,提示8周游泳运动能够通过增加脂肪细胞IRS-1磷酸化来改善RBP4诱导的胰岛素抵抗。本研究不足在于仅仅分析了脂肪细胞的葡萄糖摄取和胰岛素信号转导,对于葡萄糖转运的其他重要部位,如骨骼肌、肝细胞的情况未做探讨,而且体外实验研究也不能完全模仿体内胰岛素作用的生理环境,所以研究结果存在局限性。至于运动干预后,RBP4是否还会影响其他胰岛素信号蛋白和酶的活性,则有待进一步研究。
[1]Danielsson A,Nystrom F H,Str覽lfors P.Phosphorylation of IRS1 at serine 307 and serine 312 in response to insulin in human adipocytes[J]. Biochem Biophys Res Commun,2006,(342):1 183-1 187.
[2]Qin Yang,TimothyE,Graham T E,et al.Serum retinol binding protein 4 contributes to insulin resistance in obesity and type 2 diabetes[J].Nature,2005,436:356-362.
[3]Zhang Mingjun.Effect of swimming on RBP4mRNA and protein expression in adipose tissue of male Diabetes rats[A].2008ICSEMIS OrganizingCommittee[C].Beijin:People,Sports Publish House,2008:86.
[4]Ploug T,Stallknecht B M,Pedersen,et al.Effect of endurance training on glucose transport capacityand glucose transporter expression in rat skeletal muscle[J].Am J Physiol,1990,259E:778-784.
[5]Maitin Rodbel.Metabolism of isolated fat ceHs I.Efects of hormones on glucosemetabolismandlipolysis[J].J Biol Chem,1964,239(2):375-380.
[6]Graham T E,Yang Q,Bluher M,et al.Retinol-binding protein 4 and insulin resistance in lean,obese,and diabetic subjects[J].N Engl Med,2006,354:2 552-2 563.
[7]李伟,张龙江,林汉华.重组人白细胞介素6对SW872脂肪细胞葡萄糖代谢和胰岛素敏感性的影响及其机制 [J].实用儿科临床杂志,2007,22(8):576-578.
[8]Danielsson A,Ost A,Lystedt E.Insulin resistance inhuman adipocytes downstream of IRS1 after surgical cell isolation,but at the level of phosphorylationofIRS1intype2diabetes[J].J FASEB,2005,272:141-151.
[9]Anita Ost,Anna Danielsson,Martin Lide.Retinol-binding protein-4 attenuates insulin-induced phosphorylation of IRS1 and ERK1/2 in primaryhuman adipocytes[J].J FASEB,2007,25:3 696-3 704.
[10]H Tamemoto,T Kadowaki,K Tobe,et al.Insulin resistance and growth retardation in mice lacking insulin receptor substrate-1[J].Nature,1994,372:182-186.
[11]Withers D J,Gutierrez J S,Towery H,et al.Disruption of IRS-2 cause type 2 diabetes in mice[J].Nature,1998,391:900-904.
[12]盛慧,刘义,吕立群.多囊卵巢综合征合并胰岛素抵抗患者子宫内膜胰岛素受体底物1、2蛋白的表达及酪氨酸磷酸化[J].华中科技大学学报(医学版),2008,37(4):473-476.
[13]M Bjornholm,Y Kawano,M Lehtihet.Insulin receptorsubstrate-1 phosphorylation and Phosphatidy linositol 3-kinase activity in skeletal muscle from NIDDM subjects after in vivo insulin stimulation[J]. Diabebes,1997,46:524-527.
Effects of RBP4 on Protein Expression and Phosphorylation of IR and IRS-1 in Swimming Rats Lipocyte
ZHANG Mingjun
(School of Sports Sciences,Fujian Normal University,Fuzhou 350007,China)
Objective:To observe the influence of RBP4 on protein expression and phosphorylation of IR and IRS-1 in rats'lipocyte.Methods:Rats lipocyte (eight weeks SD)of eight weeks swimming rats and control rats were incubated by RBP4.Glucose uptake,protein expression and phosphorylation of IR and IRS-1 in lipocyte were measured.Results:The insulin-stimulated glucose uptake and noninsulin-stimulated glucose uptake increased more in exercise rats than in control rats after RBP4 incubation,respectively.There was no difference between protein expression of IR,IRS-1 and phosphorylation of IR in exercise rats and control rats.Phosphorylation of IRS-1 increased more in exercise rats than in control rats after RBP4 incubation.Conclusion:Eight weeks swimming could increase glucose uptake and phosphorylation of IRS-1 in rat lipocyte after RBP4 incubation respectively,and improve RBP4-induced insulin resistance.
swimming;retional-binding protein-4;insulin resistance;insulin receptor;insulin receptor substrate1
G 804.2
A
1005-0000(2010)01-0038-03
2009-07-27;
2009-09-10;录用日期:2009-09-11
福建省教育厅科技项目(项目编号:JB08221)
张明军(1968-),男,安徽滁州人,莆田学院讲师、医师,福建师范大学在读博士研究生。
莆田学院体育系,莆田351100。
