4周低氧运动对骨骼肌mTOR/p70S6K通路的时程影响
2010-11-04曾凡星
赵 华,曾凡星,张 漓
4周低氧运动对骨骼肌mTOR/p70S6K通路的时程影响
赵 华1,2,曾凡星2,张 漓3
目的:研究4周低氧运动中mTOR/p70S6K通路的时程变化特征,以探讨低氧训练中的蛋白合成代谢情况。方法:以12周龄雄性SD大鼠为研究对象,分为常氧安静对照组(NS组)、常氧耐力运动组(NE组)、低氧安静对照组(HS组)和低氧耐力运动组(HE组)。采用动物跑台训练,低氧刺激为常压低氧(氧浓度13.6%,相当于3 500 m海拔)。检测大鼠趾长伸肌的总蛋白含量及mTOR、p70S6K和p70S6K(Thr389)磷酸化表达。结果:在第3天时,低氧因素对mTOR(P<0.05)和p70S6K(P<0.05)有显著抑制效应。在第7天时,运动显著促进mTOR(P<0.01),而低氧显著抑制 mTOR(P<0.01)和p70S6K(P<0.01)。在第14天时,低氧显著抑制mTOR(P<0.01)和p70S6K(Thr389)磷酸化(P<0.01),而运动显著促进p70S6K(P<0.01)。在第28天时,低氧显著抑制mTOR(P<0.05)和p70S6K(Thr389)磷酸化(P<0.01),而运动显著地促进了 mTOR(P<0.01)和p70S6K(P<0.05)。结论:耐力运动促进mTOR/p70S6K通路的表达,进而促进肌肉蛋白合成;单纯低氧暴露可通过抑制mTOR/ p70S6K表达,而抑制肌肉蛋白合成;低氧耐力运动可削弱低氧对 mTOR/p70S6K表达的抑制作用。低氧运动对mTOR及p70S6K的影响有时程变化,且有时程差异。
低氧运动;蛋白合成;mTOR;p70S6K;鼠;动物实验
低氧训练在现代的训练中使用越来越广泛,但低氧训练本身是有利有弊的。高原训练后骨骼肌蛋白丢失,肌纤维横径缩小、肌肉萎缩,且肌细胞凋亡加剧。在超过一定海拔高度进行训练时,低氧因素对机体的刺激占主要地位[4,5]。肌纤维为应对低氧来增强其利用氧的速度,常变得纤细,从而造成肌肉形态上一定程度的萎缩。肌肉质量丢失比较大,造成力量的丢失,影响运动能力的发挥。而目前对于低氧运动中蛋白丢失的机制仍不清楚。
近些年来的一些研究为解决这些问题提供了良好思路。现在发现细胞内有许多条通路调控蛋白代谢,如 Ras/ MAPK通路、PI3 K-Akt-mTOR通路、Calcineurin/NFAT通路、MEK/ERK/p90RSK、AMPK通路等,它们在细胞内部构成一个调控网络结构,互相影响。在这些调控肌肉蛋白合成信号通路中起着核心作用的,就是雷帕霉素靶蛋白 (themammalian target of rapamycin,mTOR)通路[12,13,16,17,29,31,34],对mTOR通路的抑制能阻断95%的肌肉肥大效应[13]。近来被认为是骨骼肌蛋白合成生物标志物的,即mTOR信号通路中一个重要构成——p70核蛋白S6激酶(p70 ribosomal S6 kinase,p70S6K)[15,19,22-24]。本研究从主要的蛋白合成通路mTOR/p70S6K通路在低氧运动中的时程变化特征,研究低氧训练中蛋白合成情况。
1 材料与方法
1.1 实验动物与分组
SPF级9周龄雄性 SD鼠,体重220±20 g,由北京维通利华实验动物技术有限公司提供。国家标准啮齿类动物饲料,分笼饲养,自由饮食,温度维持在23℃~25℃,相对湿度40%~60%。
动物在常氧条件下适应性喂养3天后,再进行17天的水平跑台递增负荷适应性训练,强度从20 m/min逐渐过渡到35 m/min,每天递增1~2 m/min。将体重过重和过轻、力竭运动能力太好和太坏及有伤病的大鼠剔除,然后挑选出130只实验大鼠进行正式训练。
130只SD鼠共分为13个组(表1),每组10只,各组体重无显著性差异。随机分为常氧安静对照组(NS)、低氧安静对照组(HS)、常氧耐力运动组(NE)和低氧耐力运动组(HE)。实验中使用的低氧发生设备为国家体育总局体育科学研究所低氧试验室的CTDY-200型高温高湿低氧训练系统。低氧组大鼠在该系统的动物低氧室内模拟低氧(常压低氧:氧含量13.6%,模拟海拔高度3 500 m)条件下生活训练。
1.2 实验安排
正式实验的动物训练安排如表2所示。

表1 本研究动物分组一览表Table 1. Animal G rouping
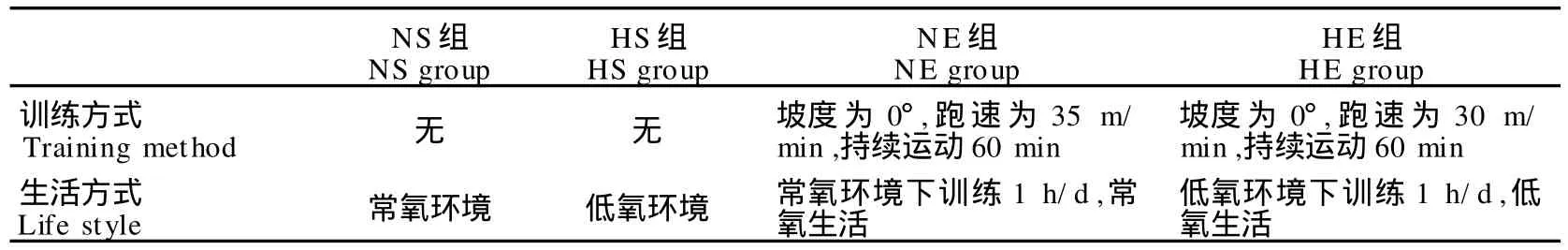
表2 本研究动物训练计划一览表Table 2. The Training Plan of Animals
1.3 仪器设备和试剂
1.3.1 仪器设备
Gel Doc XR凝胶成像系统(Bio-Rad公司),Ultra Bacis pH Meter(UB-7)型pH计(Sartorius公司),AL104型精密天平(Mettler T oledo公司),GS-15R低温高速离心机(Beckman公司),Mini-PROTEAN电泳槽(Bio-Rad公司), DYY-6C型电泳仪(北京六一仪器厂),DYCZ-40C型碳板转移电流槽(北京六一仪器厂),CTDY-200型高温高湿低氧训练系统等。其他仪器如磁力搅拌器、恒温振荡器、真空泵、752型分光光度计、培养箱等均为国产。
1.3.2 试剂
NC膜购自 GE公司;Tris、SDS、过硫酸胺、溴酚兰购自Sigma公司;丙烯酰胺、Tween-20购自 Genview公司;亚甲双丙烯酰胺、考马斯亮兰(R-250)购自USB公司;TEMED购自Amersco公司;L-甘氨酸购自Japan公司;蛋白彩色预染Marker(7-175 kDa)购自NEB公司;RIPA裂解液、PMSF购自碧云天公司;SuperSignal○RWest Pico Chemiluminescent Substrate购自 Pierce公司;蛋白酶抑制剂、蛋白磷酸酶抑制剂购自 Roche公司;mTOR、p70S6K和p70S6K(Thr389)磷酸化抗体均购自Cell Signaling公司,内参actin(I-19)-R购自Santa Cruz公司。二抗[IgG、Fc、X-Adsorbed(HRP)]购自USBiological公司。其余试剂均为国产。
1.4 指标检测
1.4.1 体重指标测试
体重的测试于实验前、实验第4天、7天、14天、28天测试。测试前禁水、禁食12 h,均于当天清晨进行测试。
1.4.2 动物组织提取
取材前禁水、禁食12 h,以0.3 ml/100 g为剂量,腹腔注射10%水合氯醛麻醉。麻醉后腹主动脉取血,然后速取后肢趾长伸肌(EDL肌)。接着用生理盐水将其洗净,剔除肌腱及筋膜组织,用干净滤纸将其吸干,用锡纸将其包裹后迅速投入液氮,而后置于-80℃冰箱保存待测。
1.4.3 提取蛋白
匀浆缓冲液的配制:取RIPA裂解液100 ml,分别加入蛋白酶抑制剂和蛋白磷酸酶抑制剂各10片,最后取100 mM PMSF 1 000μl加入。PMSF于临用前数分钟加入。于匀浆前新鲜配制。
用精密天平称取趾长伸肌(EDL肌)120 mg,用眼科剪迅速剪碎,按1∶10比例向玻璃匀浆器中加入预冷的裂解液,再在冰水浴中进行匀浆,直至没有肉眼可视的悬浮物。将组织匀浆液倒入1.5 ml EP管中,静置10 min。于4℃, 12 000 g,10 min离心,取上清液,分装后保存于-80℃待测。
1.4.4 蛋白浓度测试(Bradford法)
配制Bradford工作液:按照《精编分子生物学实验指南》[1]配制。
标准曲线制备:用1 mg/ml BSA标准蛋白分配制0、10、20、40、60、80、100μg梯度。加入 5 ml Bradford工作液,用旋涡混匀器混匀后静置5 min。测A595nm。制作标准曲线后,再分批次测试样品浓度。
1.4.5 Western Blot测试
Tris-甘氨酸电泳缓冲液、上样缓冲液、电转液、堆积胶和分离胶的配制均参照《Current Protocols in Protein Science》[13],TBS、TBST、封闭液按照Cell Signaling抗体说明书的要求配制。
取60μg总蛋白配制上样缓冲体系,置100℃沸水中5 min。配制6%的分离胶(mTOR)或8%的分离胶[Actin、p70S6K、p70S6K(Thr389)]。上胶用80 V恒压,下胶换 120 V恒压电。再用半干转将蛋白转到NC膜上,以恒压20 V 90 min电转。封闭90 min后用一抗孵育,不同抗体稀释比例分别为actin(购自Santa Cruz公司)为1∶1 000,mTOR (购自 Cell Signaling公司)为 1∶1 000,p70S6K抗体(购自Cell Signaling公司)为1∶1 000,Phospho-p70S6K(Thr389) (购自Cell Signaling公司)为1∶1 200,孵育过夜。次日晨在用 TBST洗膜后用二抗(1∶16 000)孵育60 min。用ECL发光试剂反应,曝光底片用Gel Doc XR凝胶成像系统用透光拍照,用Quantity One图像分析系统分析。将每个条带与相应样品的Actin条带光密度值进行比较,计算出目的条带的相对含量值。
1.5 数据处理
对实验检测结果的数据处理运用 SPSS 13.0软件。组间比较采用双因素方差分析(UNIANOVA)和单因素方差分析(One-Way ANOVA)。对观测点的组间多重比较(Post Hoc)采用LSD或 Tamhane’s T2方法分析。显著性检验水平以 P<0.05表示具有显著性差异,P<0.01表示具有非常显著性差异。
2 结果
2.1 低氧运动对大鼠体重的影响
分别于实验前、第3天、7天、14天、21天、28天给大鼠称重(表3),称重前禁水、禁食12 h,称重后立即恢复饮食。
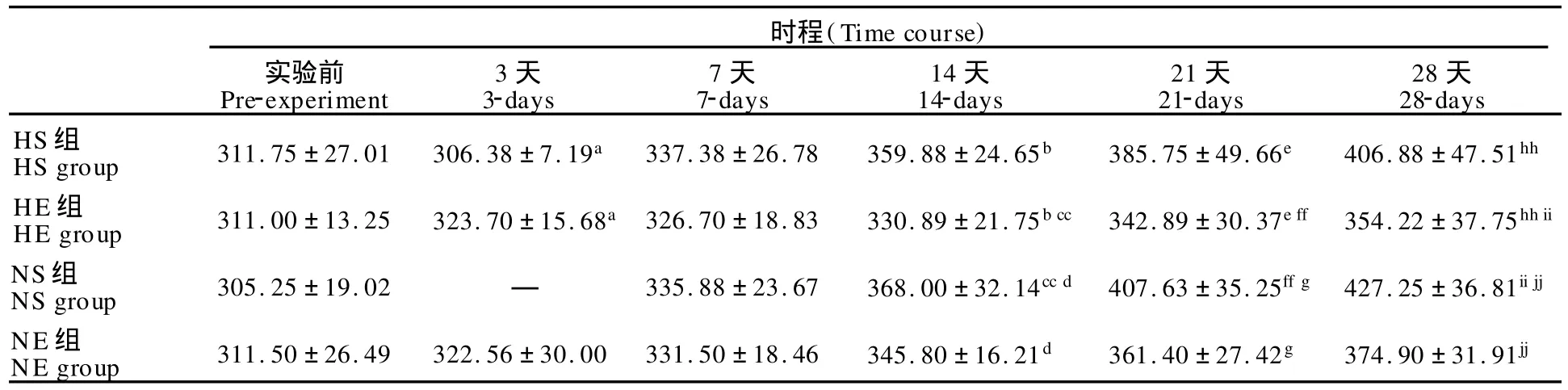
表3 本研究大鼠体重不同时程低氧运动的变化一览表 (g)Table 3. Change of Body Weight of Rat at Different Time Course of Hypoxic Training
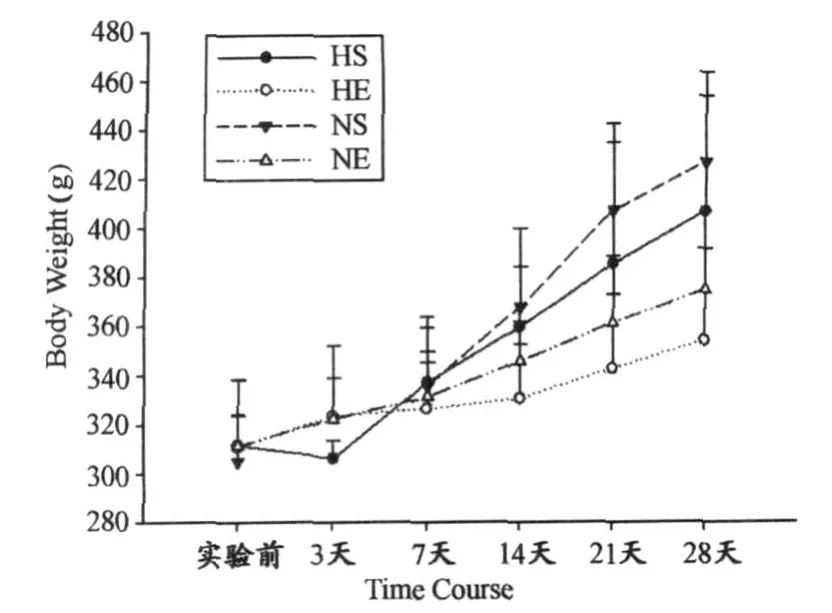
图1 本研究大鼠体重时程图Figure 1. Time Course Diagram of Body Weight of Rat
体重总体趋势(图1):各组别大鼠体重随时程变化而逐渐增加。其中,HS组在第3天时有体重降低的现象,而随后其一直保持增加。总的来说,NS组最高,其次为 HS组,再次为NE组,最后为 HE组。在第7天后,这种趋势尤为明显。在总体上就运动和低氧两个因素而言,运动因素(P<0.01)对体重有显著性减少作用,而低氧因素(P> 0.05)对其也有抑制,但未达到统计学上的显著性差异。
实验前,各组大鼠体重间无显著差异(P>0.05);第3天时,HE组显著高于 HS组(P<0.05);第7天时,各组间体重无显著性差异(P>0.05);第14天时,HE组最低,显著低于NS组(P<0.01)和 HS组(P<0.05),而NS组(P <0.05)显著高于NE组;第21天时,各组间关系与第14天一致;第28天时,NS组最高,非常显著高于NE组(P< 0.01)和 HE组(P<0.01),HS组也非常显著高于NE组(P<0.01)和 HE组(P<0.01)。在第28天时,HE组比NS组低17.1%,NE组比NS组低12.3%,HS组比NS组低4.8%。
2.2 第 3天时体重、蛋白含量、mTOR、p70S6K和 p70S6K(Thr389)磷酸化指标的变化
在第3天时,运动和低氧对体重的影响均未达到显著性差异(P>0.05),但运动有促进趋势,低氧有抑制趋势。HS组体重显著低于 HE组(94.6%,P<0.05)。运动和低氧对蛋白含量的影响未达到显著性差异(P>0.05),但运动有促进趋势,低氧有抑制趋势。低氧(P<0.05)显著抑制mTOR,运动未达到显著性差异(P>0.05),但有促进的趋势。NE组mTOR蛋白表达显著高于 HS组(108.7%,P <0.05)和 HE组(111.3%,P<0.05)。低氧(P<0.05)显著抑制p70S6K,运动未达到显著性差异(P>0.05),但有促进的趋势。NE组p70S6K蛋白表达非常显著高于 HS组(120.2%,P<0.01),显著高于 HE组(114.0%,P< 0.05)。低氧和运动对p70S6K(Thr389)磷酸化的影响未达到显著性差异(P>0.05),运动有促进的趋势,低氧有抑制的趋势。NE组p70S6K(Thr389)磷酸化显著高于 HS组(126.8%,P<0.05;图2)。
在第3天时,低氧因素对 mTOR(P<0.05)和p70S6K(P<0.05)有显著抑制效应,而对p70S6K(Thr389)未达到显著性差异(P>0.05)。运动因素对这3个信号蛋白分子都没有产生显著影响(P>0.05),但有促进的趋势。而低氧因素和运动因素对蛋白含量和体重的影响均未达到显著效应。
2.3 第 7天时体重、蛋白含量、mTOR、p70S6K和 p70S6K(Thr389)磷酸化指标的变化
在第7天,低氧和运动对体重的影响仍未达到显著性差异(P>0.05),但均表现出抑制的趋势。低氧因素(P< 0.01)显著抑制蛋白含量,运动因素(P>0.05)虽没有显著影响蛋白含量,但有促进的趋势。NE组蛋白含量非常显著高于 HS组(109.7%,P<0.01)和 HE组(111.6%, P<0.01)。运动因素(P<0.01)和低氧因素(P<0.01)对mTOR的影响均达到非常显著性差异,运动显著促进mTOR,低氧显著抑制mTOR。NE组mTOR蛋白表达非常显著高于 HS组(128.2%,P<0.01),显著高于 HE组(111.4%,P<0.05),HE组非常显著高于 HS组(115.1%,P<0.01)。低氧因素(P<0.01)非常显著抑制p70S6K,运动因素(P>0.05)对p70S6K的影响虽未达显著性,但有促进的趋势。NE组p70S6K蛋白表达显著高于 HS组(113.2%,P<0.05),非常显著高于 HE组(125.1%,P <0.01)。运动(P>0.05)和低氧(P>0.05)均未显著影响p70S6K(Thr389)磷酸化,但运动有促进趋势,低氧有抑制趋势(图3)。

表4 本研究第3天时大鼠各指标值一览表Table 4. Time Course Change of Protein Content,mTOR,p70S6Kand p70S6K(Thr389)at 3rd day
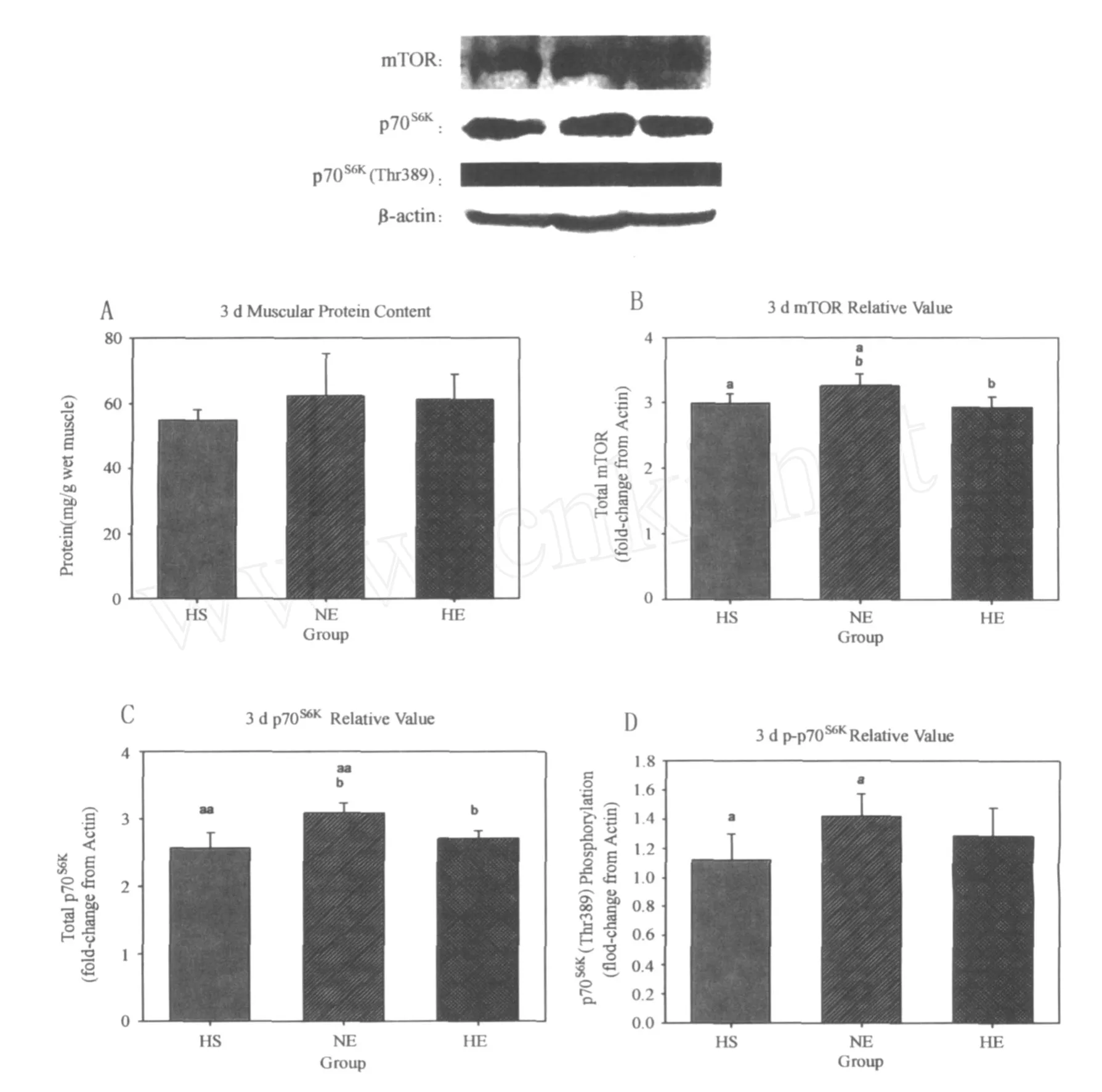
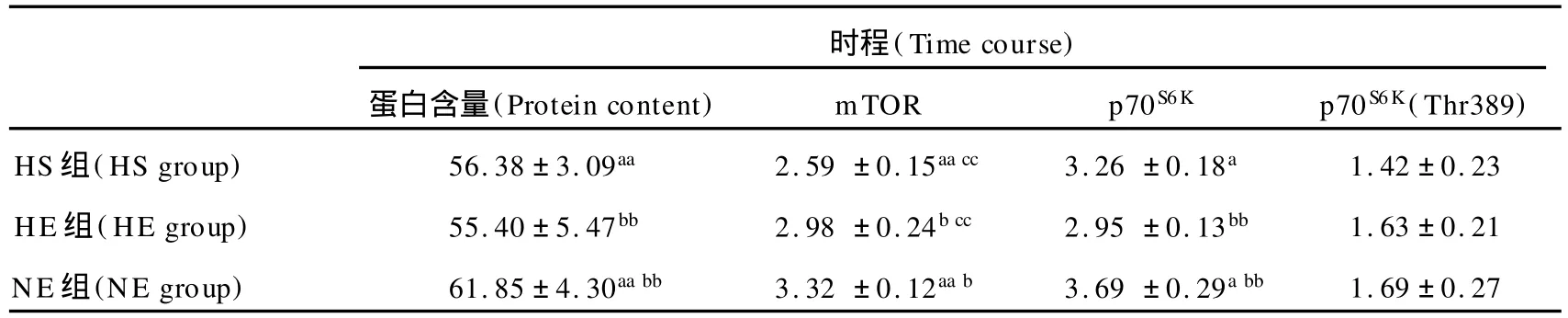
表5 本研究第7天时各指标值一览表Table 5. Time Course Change of Protein Content,mTOR,p70S6Kand p70S6K(Thr389)at 7th day
在第7天时,运动非常显著促进mTOR的表达(P< 0.01),低氧对 mTOR的抑制仍具有显著性(P<0.01)。低氧也对p70S6K有显著抑制(P<0.01),而运动只表现出促进的趋势(P>0.05)。低氧和运动对p70S6K(Thr389)的影响还未达显著差异(P>0.05)。就蛋白含量来说,低氧对其有非常显著的抑制(P<0.01),而运动对其影响不显著(P>0.05)。低氧和运动对蛋白含量和体重的影响均未达到显著效应。
2.4 第14天时体重、蛋白含量、mTOR、p70S6K和p70S6K(Thr389)磷酸化指标的变化
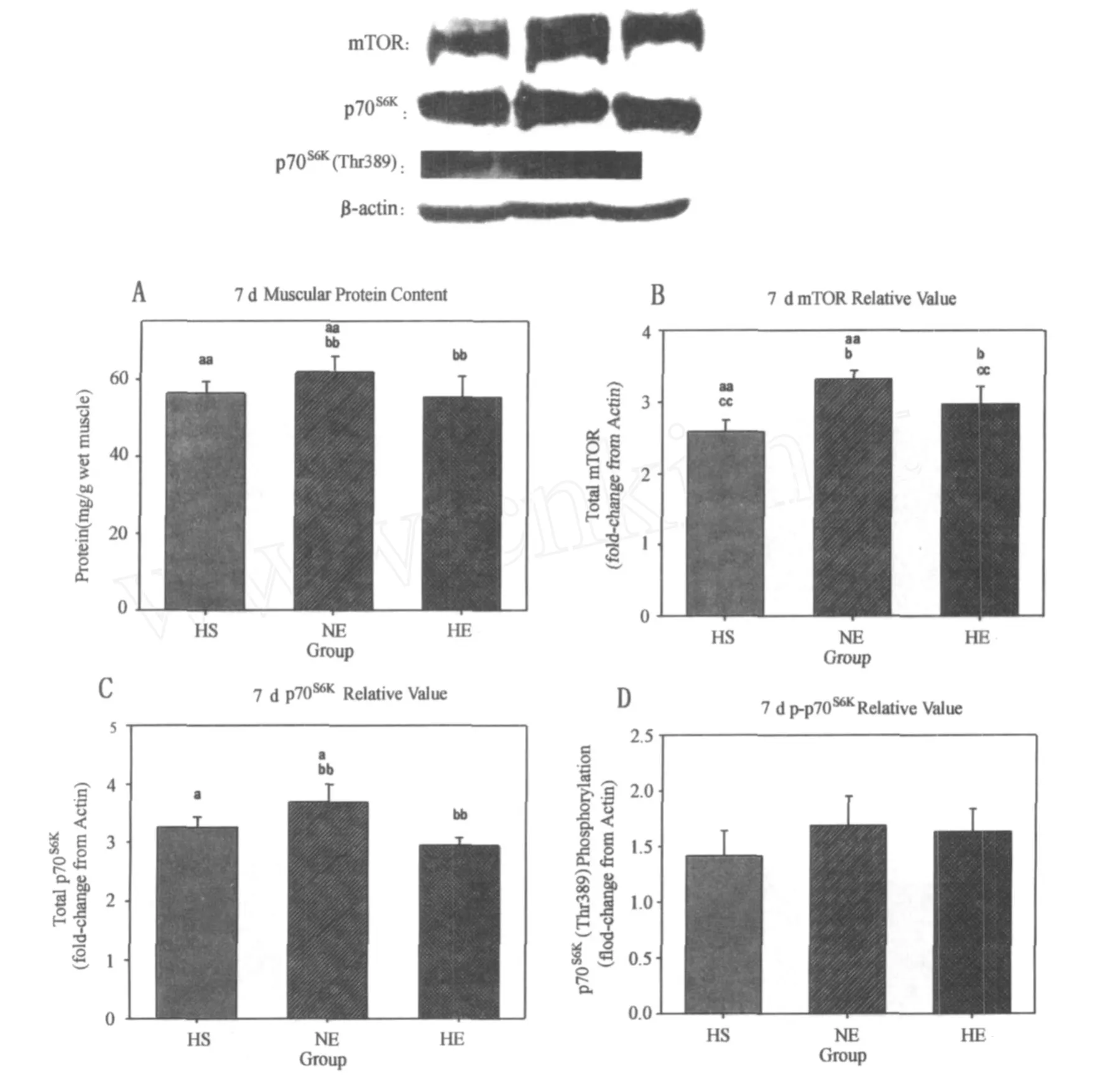
图3 第7天观测点各指标组间比较图Figure 3. Comparison on Diagram of Indexes of Each G roup at 7th Day
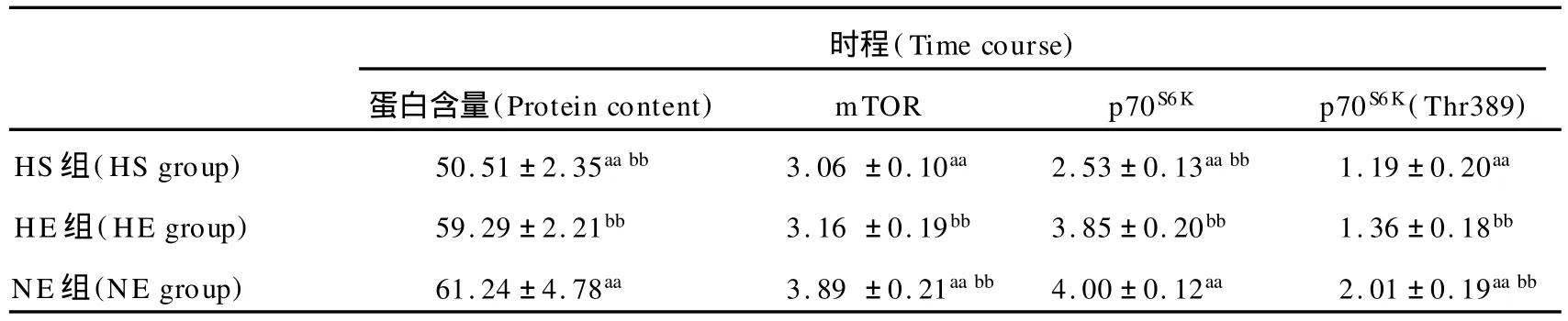
表6 本研究第14天时各指标值一览表Table 6. Time Course Change of Protein Content,mTOR,p70S6Kand p70S6K(Thr389)at 14th day
在第14天,运动因素(P<0.01)显著抑制体重,低氧因素(P>0.05)对体重的影响虽未表现出显著性,但有抑制趋势。HE组体重显著低于 HS组(91.9%,P< 0.05)。运动因素(P<0.01)非常显著地促进蛋白含量性差异,低氧因素(P>0.05)虽未达到显著性差异,但有抑制趋势。NE组 (121.2%,P<0.01)和 HE组 (117.4%,P<0.01)蛋白含量均显著高于 HS组。低氧因素(P<0.01)显著抑制mTOR,运动因素(P>0.05)对mTOR的影响虽未表现出显著性,但有促进趋势。NE组mTOR蛋白表达非常显著高于 HS组(127.1%,P< 0.01)和 HE组(123.1%,P<0.01)。运动因素(P< 0.01)显著促进 p70S6K,低氧因素(P>0.05)对 p70S6K的影响虽未表现出显著性,但有抑制趋势。NE组(158.1%,P<0.01)和 HE组(152.2%,P<0.01)p70S6K蛋白表达均非常显著高于 HS组。低氧因素(P<0.01)显著抑制p70S6K(Thr389),运动因素(P>0.05)对p70S6K(Thr389)的影响虽未表现出显著性,但有促进趋势。NE组 p70S6K(Thr389)磷酸化均非常显著高于 HS组(168.9%,P<0.01)和 HE组(147.8%,P<0.01;图4)。
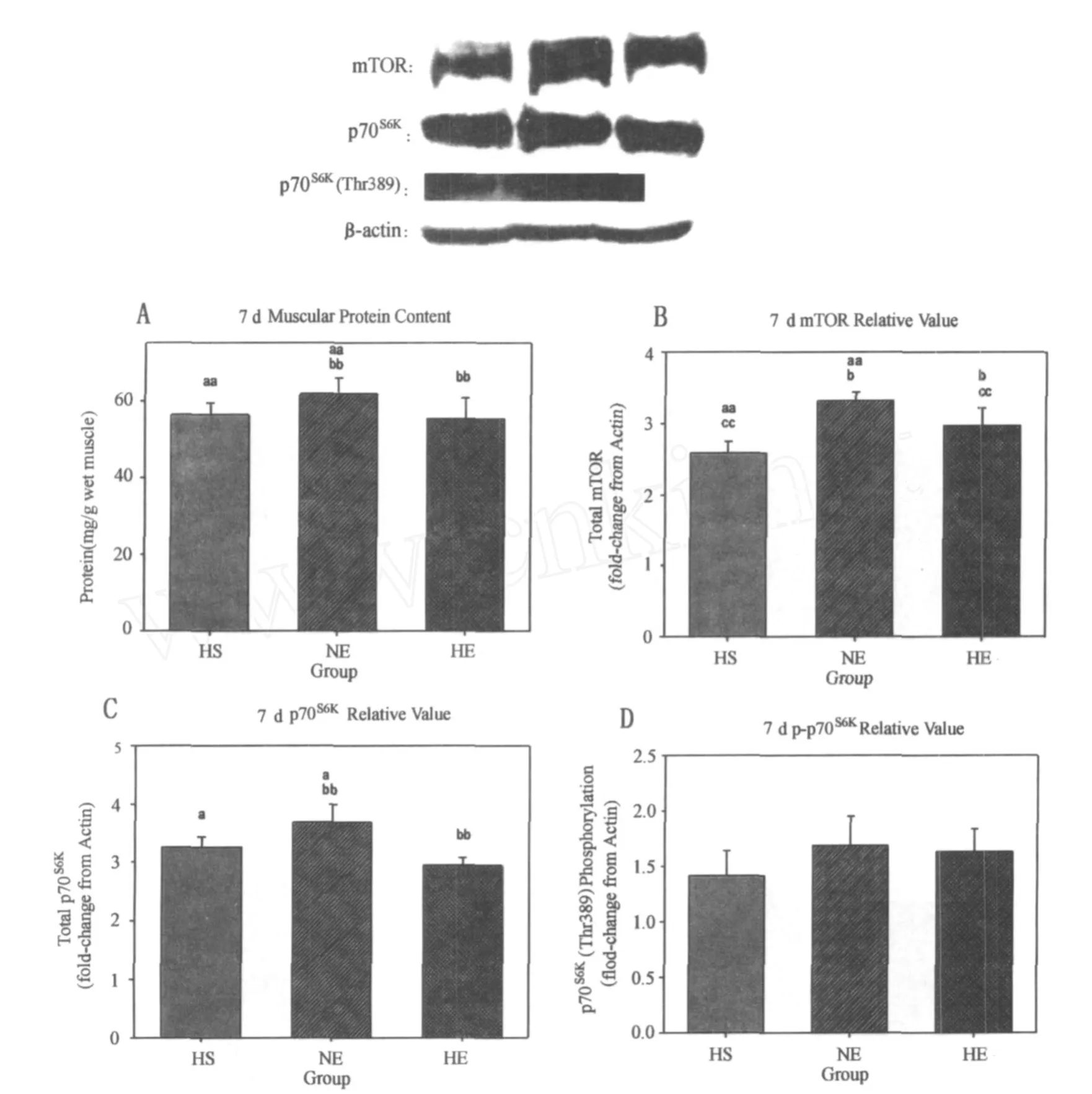
在第14天时,低氧非常显著抑制mTOR蛋白表达(P <0.01)和p70S6K(Thr389)磷酸化(P<0.01),而运动非常显著促进p70S6K蛋白表达(P<0.01)。对于蛋白含量,运动非常显著促进了它的增加(P<0.01),低氧对其影响不明显(P>0.05)。运动因素对体重的抑制表现出非常显著性(P<0.01),而低氧未表现出显著性差异(P>0.05)。
2.5 第28天时体重、蛋白含量、mTOR、p70S6K和p70S6K
在第28天,运动因素(P<0.01)非常显著抑制体重,低氧因素(P>0.05)对体重的影响虽未表现出显著性,但有抑制趋势。NE组(87.7%,P<0.01)和 HE组(82.9%,P<0.01)体重均非常显著低于NS组,HE组显著低于 HS组(92.1%,P<0.01)。运动因素(P<0.05)显著促进蛋白含量增加,低氧因素(P>0.05)对其影响虽未达到显著性,但表现出抑制的趋势。运动因素和低氧因素对mTOR的影响明显,运动因素(P<0.01)非常显著地促进mTOR,而低氧因素(P<0.05)显著地抑制mTOR。NE组(128.5%,P<0.05)和 HE组(120.6%, P<0.05)mTOR蛋白表达均显著高于 HS组。运动因素(P<0.01)非常显著地促进p70S6K蛋白表达,低氧因素(P>0.05)对p70S6K的影响没有达到显著性,但有抑制的趋势。NE组 p70S6K蛋白表达非常显著高于 NS组(141.0%,P<0.01)和 HS组(141.8%,P<0.01),显著高于 HE组(110.9%,P<0.05),HE组非常显著高于HS组(127.9%,P<0.01)和 NS组 (127.1%,P< 0.01)。低氧因素(P<0.01)显著地抑制 p70S6K(Thr389)磷酸化,运动因素(P>0.05)对p70S6K(Thr389)磷酸化的影响没有达到显著性,但有促进的趋势。NE组p70S6K(Thr389)磷酸化非常显著高于 HS组(141.1%,P<0.01),显著高于 HE组(118.6%,P<0.05),NS组非常显著高于HS组(149.5%,P<0.01)和 HE组(125.7%,P<0.01),HE组显著高于 HS组(118.9%,P<0.05;图5)。
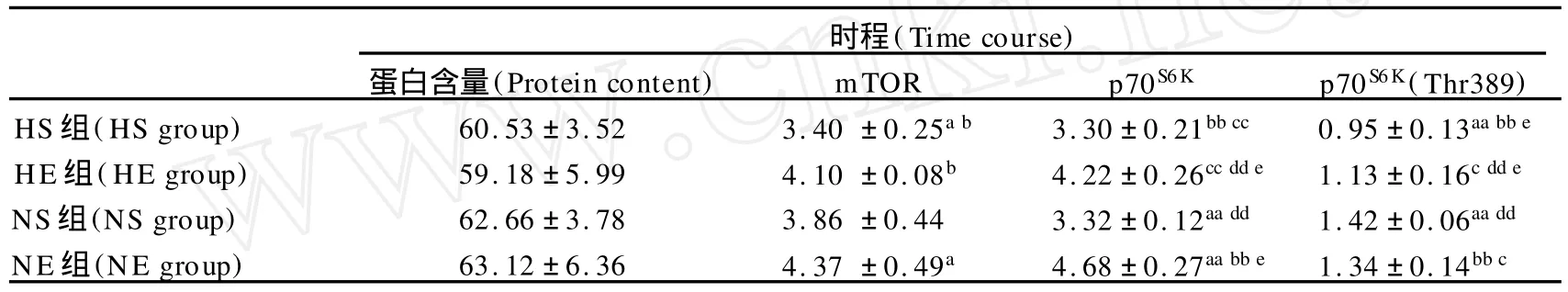
表7 本研究第28天时各指标值一览表Table 7. Time Course Change of Protein Content,mTOR,p70S6Kand p70S6K(Thr389)at 28th day
在第28天时,低氧显著抑制 mTOR蛋白表达(P< 0.05)和p70S6K(Thr389)磷酸化(P<0.01),而运动非常显著地促进了 mTOR蛋白表达(P<0.01)和显著地促进p70S6K(P<0.05)。对于蛋白含量,运动显著地促进了它的增加(P<0.05),低氧对其影响不明显(P>0.05)。运动因素对体重的抑制达到非常显著性(P<0.01),而低氧未表现出显著性差异(P>0.05)。
3 讨论
3.1 低氧运动抑制体重的增加
本研究结果表明,低氧和运动两个因素对体重都有很强的抑制效应。这与贺道远[2]、黄徐根[3]等的研究一致。在第28天后,NS组大鼠的体重高于 HS组,而 HE组和NE组与NS组相比,则都是非常显著减少了体重,其中, HE组的变化更为显著。在第28天时,HE组和NE组体重显著低于NS组(分别为82.9%和87.7%),HE组显著低于 HS组(92.1%)。说明低氧能加强运动对体重抑制效应。在实验的第3天时,HS组有个突然的降低现象(-1.7%),而随后的时间里一直保持增加的势头。这可能是由于刚暴露于低氧环境时,低氧对机体的负面刺激比较大,可能会引起内分泌一定的紊乱,造成机体的分解代谢加强。刘晔(2000)[4]在大鼠模拟4 000 m高原中,发现1周后比平原对照组睾酮低了58.5%,而2周后回升,但仍比平原低。同时基础代谢也增强,造成了体重的下降。而同时程的 HE组大鼠体重却表现出增加了4.1%,之后一直保持缓慢增加,但增加的幅度没有 HS组多。HE组此时体重的增加可能与运动引起机体一些内分泌的调整,抵消了部分的分解代谢反应,提高了机体对食物和水的摄取有关。
低氧运动抑制体重,主要是由于低氧引起能量物质的大量消耗及其对AMPK的激活。低氧本身则因为造成了能量应激,进一步加剧运动对AMPK的激活。而后者的表达可显著增强机体对脂肪酸的氧化。Steinberg(2006)[27]发现,AMPK在调控脂肪酸、甘油三酯和胆固醇的调控中起着核心作用。AMPK能通过ACC增强脂肪酸的氧化,通过 HMGR影响胆固醇的合成,通过 GPAT影响甘油三酯的合成。Lee(2006)[20]观察到,AMPK的激活能显著增加骨骼肌脂肪酸的氧化,短期内是通过肌肉内乙酰CoA的浓度来达到的,而在AMPK的长期激活对减少机体的脂肪中,主要是由于AMPK激活了PPARαmRNA和PGC-1 mRNA的基因表达。此外,低氧环境中机体的呼吸活动加强,呼吸的加快引起体内水的排出增加,这也可能是引起体重减轻的原因之一。
3.2 低氧运动对蛋白合成及mTOR/p70S6K通路的效应
运动具有很强的促肌肉蛋白合成效应,但在运动的过程中,蛋白合成相关的信号一般都被抑制,致使蛋白合成过程处于劣势,而在运动后蛋白的合成才增加。在抗阻练习过程中AMPK的激活和mTOR通路蛋白磷酸化的减少是抑制蛋白合成的主要原因。但是,在运动后1~2 h时,骨骼肌蛋白合成由于Akt、mTOR、p70S6K和eEF2的激活而迅速增加。运动的促合成效应都能持续到运动后数天[14]。Hernandez(2000)[18]对一次急性力量练习后1 h、3 h、6 h、12 h、24 h时间点进行了研究,同样发现腓肠肌蛋白合成在运动后一段时间内一直处于抑制,而直到运动后12 h才逐渐增加,且这种增加在24 h仍保持增加。而长期运动后,蛋白合成效应能产生一种积累效应。不管是抗阻力量练习,还是耐力练习,均能有效改善肌肉状态,促进肌肉生长发育。Short(2004)[26]在 16周的耐力练习后肌肉蛋白合成增加了22%,并且这种效应不受年龄和性别的影响。Baar(1999)[9]对Wistar大鼠用高频电刺激持续6周,结果发现 EDL肌重量增加了 13.9%,TA肌增加了14.4%。
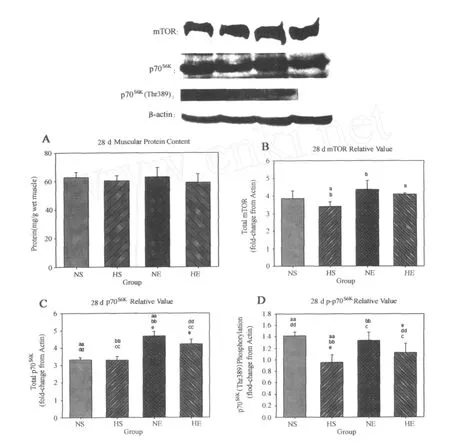
图5 第28天观测点各指标组间比较图Figure 5. Comparison on Diagram of Indexes of E ach G roupat 28th Day
低氧中氧供减少,氧化磷酸化过程抑制,ATP生成减少,造成机体的能荷降低,激活 AMPK。而后者会激活TSC1/TSC2复合体的活性,进而抑制mTOR通路,引起蛋白合成的明显抑制。在机体氧供减少时,机体的“氧气稳态调节子”——HIF激活后,刺激 REDD1的表达,由后者激活 TSC1/TSC2复合体,而后者对mTOR是起抑制作用的。
在本研究中,运动因素显著促进蛋白含量,而低氧因素对蛋白含量却有显著的抑制。在第3天,NE组和 HE组均高于 HS组,但没有显著性差异;第7天时NE组非常显著高于 HS组和 HE组。而在第14天时,HE组和NE组均非常显著高于HS组。在第28天时,各组蛋白浓度间差异不显著。通常是NE组最高,其次为 HE组,HS组最低。说明长期的低氧抑制蛋白含量,而长期运动能部分抵消低氧因素对蛋白含量的抑制。
在本研究中也发现,低氧明显抑制了 mTOR信号通路。在低氧暴露的第3天时,mTOR蛋白表达和p70S6K蛋白表达均发生了显著的抑制,而运动的促进效应还不明显,它对mTOR通路各信号分子只是有促进的趋势,但未达到统计学上的显著性差异。表明此阶段低氧对机体的刺激尤为明显,机体动员内部以抵抗氧供不足对机体的负面影响。此时,运动因素和低氧对蛋白含量都没有产生显著性的影响,各组间的蛋白含量值差不多。这表明信号分子的变化到引起肌肉形态上的变化需要一段时间。
而在第7天时,低氧非常显著性地抑制了蛋白含量,表明此阶段低氧对蛋白合成的负面效应已经表现为形态上的变化,引起蛋白含量的显著减少。但由于机体仍处于低氧适应的早期,低氧对机体的刺激仍非常明显。低氧非常显著性地抑制了mTOR蛋白表达和p70S6K蛋白表达,而同时运动对机体蛋白合成的促进效应开始显现。虽然运动因素虽未明显促进蛋白含量的增加,但仍保持促进的趋势。运动对mTOR蛋白表达的促进达到非常显著性差异。运动因素对p70S6K蛋白表达和p70S6K磷酸化仍保持促进的趋势。
低氧暴露14天时,机体对低氧有了相当的适应。低氧对蛋白含量的抑制效果未达到显著性差异,它对机体蛋白合成的抑制不像先前那么明显,但却仍表现出对mTOR的抑制效应。此阶段,运动因素对机体蛋白合成的促进效果非常明显,它对蛋白含量的影响达到非常显著性差异,表明此阶段运动因素的促合成效应已经超过低氧因素的抑制效应。同时,它对p70S6K蛋白表达的促进效应有显著性差异。运动因素对mTOR和p70S6K(Thr389)磷酸化表达的促进效应虽未达到显著性差异,但仍保持促进的趋势。
低氧暴露28天对机体来说是个适应期的中后期,低氧对蛋白含量的抑制效果未达到显著性差异,它对机体蛋白合成的抑制不像先前那么明显,但却仍表现出对mTOR蛋白表达和p70S6K(Thr389)磷酸化的抑制效应。而与此同时,运动因素表现为显著地促进蛋白含量的增加,而低氧因素对蛋白含量的影响未达到显著性效应,表明此阶段运动因素的促合成效应跟第14天的效应一样,仍保持超过低氧因素的负面效应。此阶段中,运动因素对mTOR蛋白表达和p70S6K蛋白表达表现出非常显著性的促进,而对于p70S6K(Thr389)磷酸化仍保持促进的趋势。
在实验的整个时程里,运动因素对mTOR蛋白表达、p70S6K蛋白表达及其磷酸化三者都表现出促进的效应,而低氧因素对这三者都表现为抑制效应。只不过在不同的阶段,低氧因素和运动因素二者所起作用的程度略有不同而已。
3.3 低氧运动对mTOR/p70S6K通路表达的时程效应
在实验的整个时程里,运动因素对蛋白合成和mTOR通路表现出促进的效应,而低氧因素表现为抑制效应。在不同的时程中,这两个因素所起作用的程度略有不同。在低氧适应的早期,低氧对机体的抑制效应占优势,而在中后期,运动因素的促合成效应表现得尤为明显。所以,最终表现为低氧因素明显地抑制了蛋白合成,而运动则显著地促进了蛋白合成。
在本研究中发现,低氧明显抑制了mTOR信号通路,尤其是在低氧暴露早期阶段。此时,运动对该通路促进效应的表现还不明显。表明机体在此阶段可能是低氧的应激对机体的影响占主要地位。机体的降解过程、细胞凋亡过程可能比较强。低氧情况下能增强机体 HIF的活性[25],通过作用于BNIP3等因子,促进机体的细胞凋亡过程[8,28]。HIF还能通过刺激 REDD1的表达,增强 TSC1/ TSC2的活性,进而抑制mTOR的活性,影响mRNA的翻译。低氧也造成一种能量应激,通过加强AMPK的活性,后者通过作用于 TSC1/TSC2而抑制mTOR活性。
而到了中后期时,机体对低氧逐渐产生了适应,低氧对机体造成的影响随之降低。虽然低氧对mTOR仍有相当的抑制,但运动的促合成效应逐渐表现出来。表现为运动明显促进mTOR和p70S6K的蛋白表达,而低氧对这两个信号分子的由于抑制而显得较低。HE组对mTOR的蛋白表达在中后期时,始终高于 HS组,在第28天时达到显著差异。而对p70S6K的蛋白表达,HE组即已非常显著高于 HS组。运动可增强低氧环境中mTOR的活性,部分抵消低氧对该通路的抑制效应,从而促进蛋白合成。
3.4 4周低氧运动中mTOR与p70S6K的表达有时程差异
在本研究中,运动因素对mTOR通路表现出促进的效应,而低氧因素表现为抑制效应。但在许多阶段中,mTOR蛋白表达、p70S6K蛋白表达及其磷酸化三者与蛋白表达的表现有不平行的地方。mTOR蛋白表达刚开始时升高并不显著,但在第7天后一直保持升高的趋势。p70S6K蛋白表达基本保持升高的趋势,其中,HS组为先升高、再降低、后又升高,HS组和 HE组的p70S6K是第7天左右即开始下降,而NE组是在第14天时才下降。这表明p70S6K的激活似乎受到了其他因素的影响。
有研究发现,p70S6K也受到 PDK[7]、MAPK通路的影响。Wang(2001)[30]在对培养细胞施加 ERK直接下游信号MEK的抑制剂时,发现p70S6K的活性受到影响。而当MEK持续激活时,p70S6K也表现出持续激活。而在运动中,MAPK通路是处于被激活的状态。Williamson (2006)[33]观察在一次较大强度的运动后一段时间内,蛋白合成受到抑制,同时,mTOR也明显受到抑制,但却仍有一些特异mRNA翻译增强的情况。发现p70S6K的活性并未随着mTOR的抑制而受到强烈的抑制,而是MAPK通路中 ERK1/2信号的激活下,表现出磷酸化的增强。Widegren(1998)[32]发现,ERK1/2在运动后即刻是有急剧的升高,达到安静值的31±8倍,而随后慢慢下降。这说明运动后p70S6K的活性也会受到ERK的影响,这可能会造成mTOR和p70S6K表现不一致。
p70S6K(Thr389)磷酸化是开始均先升高,后下降至最低值,其时程变化与mTOR蛋白表达和p70S6K蛋白表达的反应有较大的差异。但相比运动对它的影响,低氧对它的影响似乎更大些,尤其在第14天和第28天表现为非常显著的抑制。这可能与p70S6K(Thr389)磷酸化较为敏感有关。Parkington(2003)[21]发现,肌肉收缩活动后,Pla肌p70S6K的磷酸化起先变化比较温和(0.4±0.1倍),但在恢复期的6 h点,Pla肌p70S6K的磷酸化增加了1.4±0.4倍。Baar(1999)[10]也有相似的发现。这些研究表明,p70S6K的激活具有明显的时程变化,即运动后其磷酸化由于受到抑制,变化不明显。而后抑制因素渐渐解除,p70S6K的活性增强,并于运动后6 h左右达峰值,之后再慢慢下降,甚至能持续到运动后36 h,它具有明显的时程性。而相对来说,其蛋白表达就不够敏感。在运动后第2天时,它的磷酸化可能就已经开始回落了,而它的蛋白表达却仍能继续增强。在安静的时候,低氧因素对它磷酸化的抑制效应相对来说影响就更强些。
4 结论
1.耐力运动促进mTOR/p70S6K通路的表达,进而促进肌肉蛋白合成。
2.单纯低氧暴露可通过抑制mTOR/p70S6K表达,而抑制肌肉蛋白合成。
3.低氧耐力运动可削弱低氧对 mTOR/p70S6K表达的抑制作用。低氧运动对mTOR及p70S6K的影响有时程变化,且有时程差异。
[1]奥斯伯.新编分子生物学实验指南[M].北京:科学出版社, 2005:80-250.
[2]贺道远.低氧运动对骨骼肌PKB/mTOR信号通路的影响[D].北京:北京体育大学博士学位论文,2007.
[3]黄徐根,冯连世,徐建方,等.低氧训练过程中大鼠体重及能量代谢的变化[J].体育科学,2007,27(10):61-68.
[4]刘晔,刘桂华,陈珑.模拟海拔4000米高原训练1~3周对大鼠骨骼肌蛋白质代谢和血清睾酮的影响[J].北京体育大学学报, 2000,23(1):41-44.
[5]刘晔,刘桂华,陈珑.模拟海拔2000米和3000米高原训练不同时程对大鼠骨骼肌蛋白质代谢的影响[J].北京体育大学学报, 2002,25(2):191-193.
[6]赵鹏.低氧训练对大鼠运动机能的影响及机体适应机制[D].上海:上海体育学院博士学位论文,2005.
[7]ALESSI D R,KOZLOWSKI M T,WENG Q P,et al.3-Phosphoinositide-dependent protein kinase 1(PDK1)phosphorylates and activates the p70 S6 kinase in vivo and in vitro[J].Curr Biol,1998,8(2):69-81.
[8]AZAD M B,CHEN Y,HENSON E S,et al.Hypoxia induces au-tophagic cell death in apoptosis-competent cells through a mechanism involving BNIP3[J].Autophagy,2008,4(2):195-204.
[9]BAAR K,ESSER K.Phosphorylation of p70S6kcorrelates with increased skeletal muscle mass following resistance exercise[J]. Am J Physiol,1999,276(1 Pt 1):C120-127.
[10]BEDFORD T G,TIPTON C M,WILSON N C,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol,1979,47(6):1278-1283.
[11]BERVEN L A,CROUCH M F.Cellular function of p70S6K:a role in regulating cell motility[J].Immunol Cell Biol,2000,78 (4):447-451.
[12]BODINE S C,STITT T N,GONZALEZ M,et al.Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo[J].Nat Cell Biol,2001, 3(11):1014-1019.
[13]COLIGAN J E,DUNN B M,SPEICHER D W,et al.Current Protocols in Protein Science[M].Washington:John Wiley& Sons,Inc,2003:1403-1540.
[14]DREYER H C,FUJ ITA S,CADENAS J G,et al.Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle[J]. J Physiol,2006,576(Pt 2):613-624.
[15]ERIKSON R L.Structure,expression,and regulation of protein kinases involved in the phosphorylation of ribosomal protein S6 [J].J Biol Chem,1991,266(10):6007-6010.
[16]FINGAR D C,BLENISJ.Target of rapamycin(TOR):an integrator of nutrient and growth factor signals and coordinator of cell growth and cell cycle progression[J].Oncogene,2004,23 (18):3151-3171.
[17]FINGAR D C,SALAMA S,TSOU C,et al.Mammalian cell size is controlled by mTOR and its downstream targets S6K1 and 4EBP1/eIF4E[J].Genes Dev,2002,16(12):1472-1487.
[18]HERNANDEZ J M,FEDELE M J,FARRELL P A.Time course evaluation of protein synthesis and glucose uptake after acute resistance exercise in rats[J].J Appl Physiol,2000,88 (3):1142-1149.
[19]KIMBALL S R,O’MALLEY J P,ANTHONY J C,et al.Assessment of biomarkers of protein anabolism in skeletal muscle during the life span of the rat:sarcopenia despite elevated protein synthesis[J].Am J Physiol Endocrinol Metab,2004,287 (4):E772-780.
[20]LEE W J,KIM M,PARK H S,et al.AMPK activation increases fatty acid oxidation in skeletalmuscle by activating PPARalpha and PGC-1[J].Biochem Biophys Res Commun, 2006,340(1):291-295.
[21]PARKINGTON J D,SIEBERT A P,LEBRASSEUR N K,et al.Differential activation of mTOR signaling by contractile activity in skeletal muscle[J].Am J Physiol Regul Integr Comp Physiol,2003,285(5):R1086-1090.
[22]PENDE M.mTOR,Akt,S6 kinases and the control of skeletal muscle growth[J].Bull Cancer,2006,93(5):E39-43.
[23]RUVINSKY I,SHARON N,LERER T,et al.Ribosomal protein S6 phosphorylation is a determinant of cell size and glucose homeostasis[J].Genes Dev,2005,19(18):2199-2211.
[24]SAKAMOTO K,GOODYEAR L J.Invited review:intracellular signaling in contracting skeletal muscle[J].J Appl Physiolm, 2002,93(1):369-383.
[25]SEMENZA G L.Hydroxylation of HIF-1:oxygen sensing at the molecular level[J].Physiology(Bethesda),2004,19:176-182.
[26]SHORT K R,VITTONE J L,BIGELOW M L,et al.Age and aerobic exercise training effects on whole body and muscle protein metabolism[J].Am J Physiol Endocrinol Metab,2004,286 (1):E92-101.
[27]STEINBERG G R,MACAULAY S L,FEBBRAIO M A,et al. AMP-activated protein kinase--the fat controller of the energy railroad[J].Can J Physiol Pharmacol,2006,84(7):655-665.
[28]VENKATESH B,GOBE G,MORGAN T J,et al.Relationship between tissue hypoxia and apoptosis:a preliminary observational study[J].Crit Care Res,2007,9(2):129-136.
[29]VIGANO A,RIPAMONTI M,DE PALMA S,et al.Proteins modulation in human skeletal muscle in the early phase of adaptation to hypobaric hypoxia[J].Proteomics,2008,8(22): 4668-4679.
[30]WANGL,GOUT I,PROUD C G.Cross-talk between the ERK and p70 S6 kinase(S6K)signaling pathways.MEK-dependent activation of S6K2 in cardiomyocytes[J].J Biol Chem,2001, 276(35):32670-32677.
[31]WANG X,PROUD C G.The mTOR pathway in the control of protein synthesis[J].Physiology(Bethesda),2006,21:362-369.
[32]WIDEGREN U,J IANG X J,KROOK A,et al.Divergent effects of exercise on metabolic and mitogenic signaling pathways in human skeletal muscle[J].FASEB J,1998,12(13): 1379-1389.
[33]WILLIAMSON D L,KUBICA N,KIMBALL S R,et al.Exercise-induced alterations in extracellular signal-regulated kinase 1/2 and mammalian target of rapamycin(mTOR)signalling to regulatory mechanisms of mRNA translation in mouse muscle [J].J Physiol,2006,573(Pt 2):497-510.
[34]WULLSCHLEGER S,LOEWITH R,HALL M N.TOR signaling in growth and metabolism[J].Cell,2006,124(3):471-484.
Time Course Effects of 4-weeks Hypoxic Exercise on mTOR/p70S6KSignaling Pathway in Skeletal Muscle
ZHAO Hua1,2,ZENG Fan-xing2,ZHANG Li3
Objective:The purpose of this paper was to study the change of mTOR/p70S6Kpathway in 4-weeks hypoxic exercise.Methods:Adult male Sprague-Dawley rats(12-weeks-old) were randomly divided into four groups:NS,NE,HS and HE.The hypoxia circumstance was normal pressure hypoxia,and oxygen concentration is 13.6%,equivalently 3500m above sea level.Total protein content,mTOR and p70S6Ktotal protein,p70S6K(Thr389)phosphorylation of extensor digitorum longus(EDL)muscle were determined by Bradford and Western blot. Results:Hypoxia significantly inhibited mTOR(P<0.01)and p70S6Ktotal protein(P< 0.05)after 3rd day.Exercise promoted mTOR total protein significantly(P<0.01),but hypoxia inhibited it significantly(P<0.01).After 14 days,hypoxia inhibited mTOR total protein significantly(P<0.01)and p70S6K(Thr389)phosphorylation(P<0.01),but exercise promoted p70S6Ktotal protein very significantly(P<0.01).After 28 days,hypoxia inhibited mTOR total protein significantly(P<0.05)and p70S6K(Thr389)phosphorylation(P< 0.01),but exercise significantly promoted mTOR(P<0.01)and p70S6Ktotal protein(P< 0.05).Conclusions:1)Endurance exercise improved muscular protein synthesis through elevated mTOR/p70S6Kpathway.2)Hypoxia exercise inhibited muscular protein synthesis through attenuated mTOR/p70S6Kpathway.3)Endurance exercise in hypoxia attenuated the depression effect of hypoxia on mTOR/p70S6Kpathway.Hypoxic exercise had of time course effective on mTOR and p70S6K.
hypoxic exercise;protein synthesis;m TOR;p70S6K;rat;animal ex periment
G804.2
A
1000-677X(2010)01-0051-11
2009-11-09;
2009-12-25
国家自然科学基金资助项目(30671013);国家体育总局体育科学研究所基本科研业务课题(06-20)。
赵华(1981-),男,湖北荆州人,讲师,在读博士研究生,研究方向为运动适应的内分泌机制研究,E-mail:zhaohua_ bsu@hotmail.com。
11天水师范学院体育学院,甘肃天水741001;21北京体育大学研究生院,北京100084;31国家体育总局体育科学研究所,北京100061
11Physical Education Department,Tianshui Normal University,Tianshui 741001,China;21Beijing Sport University,Beijing 100084,China;31National Institute of Sport Science, Beijing 100061,China.
