卡托普利对博莱霉素致小鼠肺纤维化的防治作用及其机制探讨
2010-11-03彭张哲朱玉娴陶立坚宁旺斌
彭张哲,朱玉娴,陶立坚,王 菱,宁旺斌
(1.中南大学湘雅医院 肾内科,湖南 长沙 410078;2.中国人民解放军第二军医大学长征医院 肾内科,中国 上海 200003)
特发性肺间质纤维化(idiopathic pulmonary interstitial fibrosis,IPF)是一种以细胞外基质(extracellular matrix,ECM)的过度合成和沉积为主要特征的、具有严重破坏性的肺部疾病。IPF导致正常肺结构的破坏,包括肺泡间隔增宽,功能性毛细支气管腔塌陷,最终出现严重的肺功能不全,目前尚无切实有效的治疗方法[1]。
在肺间质纤维化的病理过程中,局部血管紧张素系统(renin-angiotensin system,RAS)起到了非常重要的作用,该系统中的主要效应因子血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)可以通过多种机制参与肺纤维化的发生和发展。如诱导肺泡上皮细胞凋亡,刺激肺成纤维细胞产生细胞外基质,刺激促纤维化细胞因子的释放等[2~4]。因此,血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)或AngⅡ受体拮抗剂可能为肺纤维化的治疗提供新的手段。
本研究首先通过尾静脉分次小剂量注射博莱霉素建立稳定的肺间质纤维化模型。通过进一步观察卡托普利对小鼠肺纤维化的保护作用,初步探讨其可能的机制。
1 材料和方法
1.1 主要试剂及仪器
博来霉素系日本化药株式会社产品。卡托普利为中美上海施贵宝制药有限公司产品。蛋白浓度测定试剂盒购自美国Bio-Rad公司。CTGF抗体购自Abcam公司。β-actin单克隆抗体购自Sigma公司。ECL发光试剂盒购自Amersham Life Science公司(Little Chalfont,UK)。Trizol购自 Invitrogen公司,荧光实时定量PCR试剂盒购自日本TaRaKa公司。逆转录试剂盒购自Fermentas(MBI)公司。7900荧光定量PCR仪为美国ABI公司产品。图像分析系统采用HPIAS-1000高清晰度彩色病理图文分析系统(华中科技大学同济医学院清屏影像公司)。
1.2 实验动物分组及处理
1.2.1 造模 45只清洁级ICR小鼠,雄性、7~10周龄、体重约28~39 g,由上海斯莱克实验动物有限责任公司提供(许可证号:SCXL[沪]2003-0003),小鼠在动物实验室内适应性饲养一周后,随机分为三组:即正常对照组(15只)、卡托普利组(15只)和模型组(15只)。卡托普利组、模型组均给予尾注射10 mg/kg博来霉素持续14 d[5]。正常对照组按5mL/kg给予生理盐水尾静脉注射,持续14 d。
1.2.2 给药方案正常对照组小鼠按5mg/(kg·d)给予0.5%CMCNa溶液灌胃;卡托普利组小鼠按12.5mg/(kg·d)给予卡托普利灌胃;模型组小鼠按5 mg/(kg·d)给予0.5%CMCNa溶液灌胃。所有灌胃给药均从造模前1 d开始给予,持续28 d。
1.3 标本处理、形态学观察及纤维化评分
各组小鼠均于造模开始后第28天处死,采用腹腔内注射10%水合氯(3.5~4.0)mL/kg深度麻醉法处死,留取血清及双侧肺脏。左侧肺脏用4%甲醛固定、石蜡包埋、制成4μm厚切片,做HE染色及Masson染色。参照SZAPIEL[6]观察肺泡炎(0~3分)和肺纤维化(0~3分)。
1.4 Western blot测定CTGF蛋白表达
取肺组织匀浆,蛋白定量后行10%SDS-聚丙烯酰胺凝胶电泳,转膜,5%脱脂牛奶封闭后加入CTGF一抗(1︰1 000),4℃过夜后加入1︰10 000稀释的二抗,室温孵育60min,加入ECL液后于暗室中胶片显影曝光。内参照为β-actin。对实验结果进行扫描之后,采用Bio-Rad公司的图形分析软件Quantity One对特异性条带进行灰度分析。以CTGF/β-actin的光密度值表示CTGF的相对表达量。
1.5 RNA抽提、cDNA合成与实时荧光定量PCR检测
应用Trizol抽提小鼠肺脏中的总RNA,逆转录合成cDNA后再进行Real-time PCR反应。引物序列设计通过Primer3软件完成,各目的基因引物如下:CollagenⅠ上游引物序列5'-CCCAGAGTGGAACAGC GATTAC-3';下游引物序列5'-TGTCTTGCCCCATTC ATTTGTC-3'。CollagenⅢ上游引物序列:5'-CCTCAG GGTATCAAGGGTG-3';下游引物序列5'-GATCCAG GGTTTCCATCC-3'。TGF-β1上游引物序列:5'-AG GCGGTGCTCGCTTTGT-3';下游引物序列5'-TGTTG CGGTCCACCATTAGC-3'。CTGF上游引物序列5'-GTGTGTGACGAGCCCAAGGA-3';下游引物序列5'-AGTTGGGTCTGGGCCAAATGT-3'。GAPDH 上游引物序列5'-AAATGGTGAAGGTCGGTGTG-3';下游引物序列5'-TGTTGCGGTCCACCATTAGC-3'。反应条件为:①变性95℃ 10 s;②PCR反应95℃5s,60℃ 30 s,40个循环;③溶解曲线95℃ 15 s,60℃15 s,95℃ 15 s。最后根据ΔΔCt方法对样品的mRNA含量进行定量分析[7]。
1.6 统计学处理
2 实验结果
2.1 大体形态观察
正常对照组:双肺呈粉红色,表面光滑,弹性良好。模型组:双肺呈灰白色,或苍白色,表面有出血点和坏死灶,质地较硬,体积缩小。卡托普利组:部分肺叶暗红色或灰白色,表面有出血点和坏死灶,部分肺叶表面光滑。
2.2 光镜观察
正常对照组未出现明显病变,模型组大量炎性细胞浸润,同时出现肺纤维化病变,部分肺泡腔消失,为大量胶原纤维、成纤维细胞、淋巴细胞所占据。卡托普利治疗组可见肺泡间隔增厚程度稍减轻,炎性细胞较少,可见中量胶原纤维。卡托普利治疗组的肺泡炎及肺纤维化程度较模型组有减轻的趋势,但半定量评分结果无统计学意义(图1,图2,表1)。
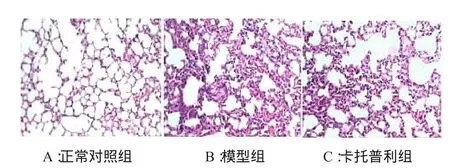
图1 三组小鼠肺组织病理改变(HE×100)
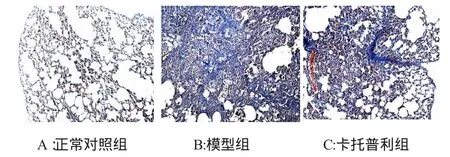
图2 三组小鼠肺组织病理改变(Masson×100)
表1 三组小鼠肺组织肺泡炎、肺纤维化半定量评分结果(±s)

表1 三组小鼠肺组织肺泡炎、肺纤维化半定量评分结果(±s)
注:†与对照组比较,P<0.01
组别 鼠数(只) 肺泡炎评分 肺纤维化评分对照组 15 1.22±0.44 0.33±0.52模型组 15 3.00±0.00† 3.00±0.00†卡托普利组 15 2.71±0.48† 2.33±0.82†
2.3 Real-time PCR检测各组小鼠肺组织中CollagenⅠ、CollagenⅢmRNA水平
Ⅰ型胶原:与正常组比较,造模后两组的Ⅰ型胶原mRNA水平均显著升高(P<0.01);与模型组比较,卡托普利组能下降Ⅰ型胶原mRNA水平(P<0.01)。Ⅲ型胶原:与正常组比较,造模后两组的Ⅲ型胶原均显著升高(P<0.01);卡托普利组的Ⅲ型胶原mRNA水平与模型组相比并无明显差别(表2)。
表2 肺组织I、III型胶原m RNA水平比较(±s)

表2 肺组织I、III型胶原m RNA水平比较(±s)
注:1)与对照组比较,P<0.01;2)与模型组比较,P<0.01
组别 鼠数(只) I型胶原mRNA III型胶原mRNA对照组51.08±0.08 1.23±0.37模型组53.51±0.161) 4.41±0.301)卡托普利组52.79±0.221)2) 4.30±0.201)
2.4 Real-time PCR检测各组小鼠肺组织中TGFβ1、CTGF mRNA 的表达
相对于正常对照组,博莱霉素尾静脉注射14 d后小鼠肺组织中TGF-β1表达增高4.86倍,CTGF的mRNA表达量在模型组小鼠肺组织中也增高了3.62倍。经过卡托普利治疗28d之后,TGF-β1mRNA与CTGF mRNA表达量明显降低(P<0.01)(表3)。
2.5 Western-blot检测CTGF蛋白表达
Western-blot检测结果显示:相对于正常对照组,模型组小鼠肺组织中CTGF蛋白表达显著增高(P<0.01),经过卡托普利治疗28 d之后,小鼠肺组织 CTGF的表达明显下调(P<0.01)(图 3)。

图3 各组小鼠CTGF蛋白表达
表3 肺组织TGFβ1、CTGF m RNA表达水平比较(±s)
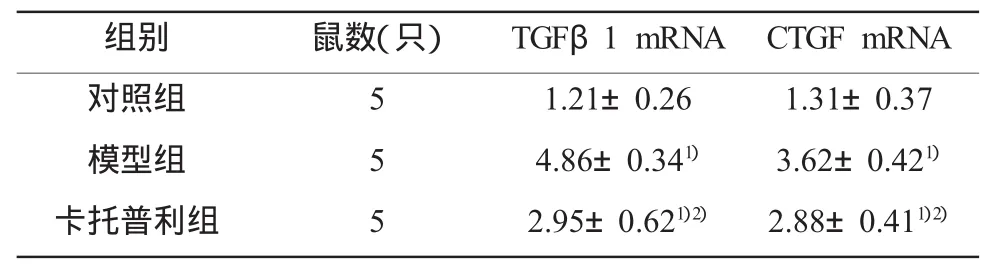
表3 肺组织TGFβ1、CTGF m RNA表达水平比较(±s)
注:1)与对照组比较,P<0.01;2)与模型组比较,P<0.01
组别 鼠数(只) TGFβ1 mRNA CTGF mRNA对照组51.21±0.26 1.31±0.37模型组54.86±0.341) 3.62±0.421)卡托普利组52.95±0.621)2) 2.88±0.411)2)
3 讨论
博莱霉素是一种细胞毒性药物,具有致肺纤维化的作用,是目前应用最为广泛的建立肺纤维化动物模型的方法。目前,在国内用博莱霉素复制肺纤维化动物模型,多应用气管内滴入法。该造模方法需要进行暴露气管的手术,方法比较繁琐,且有一定感染的危险性。该方法形成的组织病理改变主要集中在细支气管的周围,不符合IPF的病理变化[8],不利于观察药物疗效。本文参考国外文献[5],通过尾静脉多次注射小剂量博莱霉素的方法形成了广泛而稳定的肺间质纤维化改变,这些病理改变主要分布于胸膜下及血管周围,这与IPF的病理变化相似,并且该方法操作简单,减少了感染及气管切开带来的手术风险。本文的研究显示,通过尾静脉注射博莱霉素的造模方法在一定程度上优于气管内给药的方法。
Ⅰ型和Ⅲ型胶原构成肺组织基质的主要成分,其中Ⅰ型胶原的含量最为丰富,主要见于支气管树和血管树的周围即肺泡周间质,仅有少量的散布于肺泡间质内。Ⅲ型胶原则主要见于肺泡间质内,包括肺泡壁、小叶间隔,构成了肺间质的主要胶原成分。在肺间质纤维化的早期,主要以Ⅲ型胶原的增多为主,慢性及终末期则以Ⅰ型胶原增长为主[9,10]。本文的试验结果显示:14 d博莱霉素所致小鼠肺纤维化模型Ⅰ、Ⅲ型胶原mRNA水平都显著增高,但Ⅲ型胶原mRNA水平较一型胶原mRNA增高更为明显。结合对肺组织病理切片的观察我们认为:14 d博莱霉素尾静脉注射小鼠肺纤维化模型的肺部病变仍属肺间质纤维化的早中期,以Ⅲ型胶原的增多为主。本文进一步证实卡托普利能够显著降低肺纤维化组织中升高的Ⅰ型胶原mRNA水平,而对Ⅲ型胶原mRNA水平无明显影响。本文同时发现,卡托普利治疗组对于模型组有减轻肺间质纤维化的趋势,但无统计学意义,这可能与卡托普利只降低了Ⅰ型胶原的mRNA水平而对Ⅲ型胶原mRNA水平无明显影响相关。这可能提示卡托普利对早中期的肺间质纤维化程度影响不大,而当纤维化进入晚期以Ⅰ型胶原沉积为主时,才能够通过干扰胶原合成起到抗肺间质纤维化的作用。
有国外文献报道,血管紧张素转化酶抑制剂卡托普利能通过抑制肺泡上皮细胞凋亡抗肺间质纤维化[11,12]。另有学者也证明,卡托普利抗放射性肺纤维化的机制与下调转化生长因子 1(TGF-β1)、α-SMA水平有关[13]。TGFβ1是组织生长、修复炎症的重要细胞因子,TGFβ1的激活和异常表达总是伴随着肺实质的病变,包括肺间质纤维化以及其它的气道疾病。在博莱霉素导致肺纤维化的模型中,总是能观察到TGFβ1的过度表达、活化以及其下游的信号传导途径激活[14~17]。用各种方式阻断或下调TGFβ1的过度表达,能够明显缓解肺间质纤维化的发生、发展[18,19]。结缔组织生长因子(CTGF)是目前得到公认TGF-β1的下游效应介质,与TGF-β1一起参与了众多组织的细胞增殖及ECM的合成。CTGF主要介导 TGF-β1的促纤维化效应,而TGF-β1的其它效应却不由CTGF介导,所以CTGF的生物学行为更为专一,具有更强的靶向性[20~23]。本文的研究显示,卡托普利不但能够降低肺纤维化组织中TGFβ1的mRNA水平,还能同时降低其下游的CTGF的mRNA和蛋白表达。这说明抑制激活的TGFβ1/CTGF通路是卡托普利抑制Ⅰ型胶原mRNA表达,进而实现抗肺间质纤维化的重要机制之一。
4 致谢
(本实验均在医学遗传学国家重点实验室完成,真挚感谢医学遗传学国家重点实验室提供的技术支持以及仪器设备等硬件支持)。
[1]CRYSTAL RG,BITTERMAN PB,MOSSMAN B,et al.Future research directions in idiopathic pulmonary fibrosis:summary of a national heart,lung,and blood institute working group[J]. Am J Respir Crit Care Med,2002,166:236-246.
[2]WANG R,ZAGARIYA A.AngiotensinⅡinduces apoptosis in human and rat alveolar epithelial cells[J].Am J Physiol Lung Cell Mol Physiol,1999,276:L885-L889.
[3]MARSHALL RP,GOHLKE P,CHAMBERS RC,et al.AngiotensinⅡand the fibroproliferative response to acute lung injury[J].Am J Physiol Lung Cell Mol Physiol,2004,286(1):L156-164.
[4]WANG R,ZAGARIYA A,ANG E,et al.Fas-induced apoptosis of alveolar epithelial cells requires ANGⅡgeneration and receptor interaction[J].Am J Physiol,1999,277 (6 Pt 1):L1245-1250.
[5]T.KAKUGAWA,H.MUKAE,T.HAYASHI,et al.Pirfenidone attenuates expression of HSP47 in murine bleomycin-induced pulmonary fibrosis[J].Eur Respir J,2004,24:57-65.
[6]SZAPIEL SV,ELSON NA,FULMER TD,et al.Bleomycin-induced interstitial pulmonary disease in the Nude,Athymic mouse[J].Am Rev Respir Dis,1979,120:893-899.
[7]WINER J,JUNG CK,SHACKEL I,et al.Development and validation of real-time quantitative reverse transcriptase?polymerase chain reaction for monitoring gene expression in cardiac myocytes in vitro[J].Anal Biochem,1999,270:41-49.
[8]CHUA F,GAULDIE J,LAURENT GJ,et al.Pulmonary fibrosis:searching for model answers[J].Am J Respir Cell Mol Biol,2005,33(1):9-13.
[9]GERRIETS JE,REISER KM,LAST JA.Lung collagen cross-links in rats with experimentally induced pulmonary fibrosis[J].Biochim Biophys Acta,1996,1316(2):121-131.
[10]ZHANG K,REKHTER MD,GORDON D,et al.Myofibroblast and their role in lung collangen gene expression during pulmonary fibrosis;a combined immunohistochemical and insituhybridization study[J].Am J Pathol,1994,145(2):114-125.
[11]WANG R,IBARRA-SUNGA O,VERLINSKI L,et al.Abrogation of bleomycin-induced epithelial apoptosis and lung fibrosis by captopril or by a caspase inhibitor[J].Am J Physiol Lung Cell Mol Physiol,2000,279(1):L143-151.
[12]CANDAN F,ALAGOZLU H.Captopril inhibits the pulmonary toxicity of paraquat in rats[J].Hum Exp Toxicol,2001,20(12):637-641.
[13]MOLTENI A,WOLFE LF,WARD WF,et al.Effect of an angiotensinⅡreceptor blocker and two angiotensin converting enzyme inhibitors on transforming growth factor-beta(TGF-beta)and alpha-actomyosin(alpha SMA),important mediators of radiation-induced pneumopathy and lung fibrosis[J].Curr Pharm Des,2007,13(13):1307-1316.
[14]KHALIL N,PAREKH TV O'CONNOR RN,GOLD L et al.Differential expression of tansforming growth factor-β type ⅠandⅡreceptors by pulmonary cells in bleomycin-induced lung injury:correlation with repair and fibrosis[J].Exp Lung Res,2002,28:233-250.
[15]ZHAO J,SHIW,WANG YL,et al.Smad3 deficiency attenuates bleomycin-induced pulmonary fibrosis in mice[J].Am J Physiol Lung Cell Mol Physiol,2002,282:L585-L593.
[16]GAULDIE J.Pro-inflammatory mechanisms are a minor component of the pathogenesis of idiopathic pulmonary fibrosis[J].Am J Respir Crit Care Med,2002,165:1205-1206.
[17]KEANE MP,STRIETER RM.The importance of balanced pro-inflammatory and anti-inflammatory mechanisms in diffuse lung disease[J].Respir Res,2002,3:5.
[18]GAULDIE.TGFβand Smad3 link inflammation to regressive fibrosis[J].International Congress Series,2007,1302:103-113.
[19]BONNIAUD P,MARTIN G,MARGETTS PJ,et al.CTGF is crucial to induce a profibrotic environment in‘fibrosis resistant alb/c mouse lungs’[J].Am J Respir Cell Mol Biol,2004,31(5):510-516.
[20]XU YD,HUA J.Release of biologically active TGF-β1 by alveolar epithelial cells results in pulmonary fibrosis[J].Am J Physiol Lung Cell Mol Physiol,2003,285:L527-539.
[21]DUNCAN MR,FRAZIER KS,ABRAMSON S,et al.Connective tissue growth factor mediates transforming growth factor beta-induced collagen synthesis:down-regulation by cAMP[J].FASEB J,1999,13:1774-1786.
[22]HISIKAWA K,NAKAKI T,FUJII T,et al.Transforming growth factor-beta1 induces apoptosis via connective tissue growth factor in human aortic smooth muscle cells[J].Eur J Pharmacol,1999,385:287-290.
[23]M.M.CHEN,A.LAM,J.A.ABRAHAM,et al.CTGF Expression is induced by TGF-βin cardiac fibroblasts and cardiac myocytes:a potential role in heart fibrosis[J].Journal of Molecular and Cellular Cardiology,2000,32:1805-1819.
