紫杉醇对人绒癌细胞增殖及凋亡的影响
2010-11-03曹兰琴刘惠宁
曹兰琴,黎 欣,刘惠宁,易 红,李 岑
(中南大学湘雅医院 妇产科,湖南 长沙 410008)
人绒毛膜癌(绒癌)为恶性滋养叶细胞肿瘤,是发生于生育年龄妇女的常见肿瘤。临床上以化疗为治疗绒癌的主要方法,化疗对这一恶性程度很高、病情凶险的妇科肿瘤可以取得根治性的效果[1]。现有的资料表明,低危绒癌的治愈率可达100%,高危绒癌的生存率也可达85%以上[2]。但是,近年来随着难治性特别是耐药患者的增多,常常导致化疗失败[3]。难治性绒癌的治疗很棘手,既要寻找难治的发生机制,又要不断寻找新药和新的化疗方案来改善患者的预后。紫杉醇作为新一代植物碱类抗肿瘤药物,现已作为卵巢癌的一线化疗药物,该药对绒癌是否也有效有待于研究。本实验通过检测紫杉醇对绒癌细胞增殖及凋亡的影响,为临床上应用紫杉醇来治疗难治性绒癌提供理论依据。
1 材料与方法
1.1 材料
①细胞株:人绒毛膜癌细胞系JEG-3购自北京中国科学院动物研究所计划生育及生殖生物学国家重点实验室。②主要试剂:紫杉醇(多西他赛)系江苏恒瑞医药股份有限公司产品;PRMI1640、胰酶、EDTA、DMSO均为美国Gibco产品;四甲基偶氮唑蓝(MTT)为美国Sigma公司产品;D-Hanks液、双抗小牛血清均由湘雅医院中心实验室提供。
1.2 实验方法
1.2.1 细胞培养 将JEG-3细胞培养于含15%胎牛血清的PRMI1640培养液内,置于37℃、饱和湿度、含5%二氧化碳恒温培养箱内培养。1~2 d更换培养液一次或根据培养液的颜色换液。待细胞长满瓶底70%~80%后,胰酶消化传代。取生长状态稳定,对数生长期的细胞进行实验。
1.2.2 实验分组 实验中将细胞分成两组。对照组:只加RPMI1640培养液;加药组:加入含紫杉醇浓度分别为:0.001μg/mL、0.01μg/mL、0.1μg/mL、1μg/mL、10μg/mL及100μg/mL的RPMI1640培养液。
1.2.3 MTT实验 将JEG-3细胞按5×104个/孔密度接种于96孔培养板上,24h吸出原培养液,加药组加入含紫杉醇浓度分别为 0.001、0.01、0.1、1、10及100μg/mL的RPMI1640培养液200μL,设培养液中不加药物(加相同浓度的DMSO)为对照组,另设空白对照。每组设3个复孔。继续培养24 h,每孔加入MTT溶液20μL,培养4 h后终止培养。小心吸出各孔内的培养基及药物溶液,每孔加入DMSO液150μL溶解,振荡10min,于酶标仪上以测定波长为630 nm,参考波长为490 nm,测定其吸光度(A)。48 h及72 h后,同法处理96孔板。根据下面公式计算出抑制率并绘制抑制率曲线,细胞生长增殖抑制率(%)=(1-给药组细胞A值/对照组细胞A值)×100%。以上实验重复三次。
1.2.4 流式细胞仪检测细胞凋亡和细胞周期0.001μg/mL、0.01μg/mL及 0.1μg/mL三种浓度紫杉醇作用于JEG-3细胞24 h和48 h收集细胞,制成1×106/mL细胞悬液,用PBS溶液洗两遍,加入预冷的70%乙醇固定,送检。测定前用PBS洗去乙醇,加入PI染液,避光染色30min后,流式细胞仪进行细胞凋亡和细胞周期的检测。细胞凋亡和细胞周期的检测各重复三次。
1.3 统计学处理
本实验数据资料采用SPSS11.5统计软件进行分析,计量数据以均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05认为有统计学意义。
2 实验结果
2.1 紫杉醇对JEG-3细胞增殖的影响
分别用终浓度为 0.001、0.01、0.1、1、10 及100μg/mL的紫杉醇处理JEG-3细胞24、48和72 h,同一浓度紫杉醇作用下,随着作用时间的延长,细胞增殖抑制率增加,P<0.05,有统计学意义。细胞增殖抑制率与作用时间具有直线相关线,相关系数r均>0.8,P<0.05;同一时间作用下,随着紫杉醇浓度的增加,细胞增殖抑制率增加,P<0.05,有统计学意义。细胞增殖抑制率与紫杉醇浓度具有直线相关性,相关系数 r均 >0.8,P<0.05。紫杉醇作用 24、48及72 h的 IC50分别为 99.8μg/mL,3.1μg/mL,0.1μg/mL。详见表1及图1。
表1 不同浓度紫杉醇作用24、48、72h后的JEG-3细胞增殖抑制率(%,n=3,±s)

表1 不同浓度紫杉醇作用24、48、72h后的JEG-3细胞增殖抑制率(%,n=3,±s)
注:按α=0.05水准,同一浓度不同时间组与对照组增殖抑制率比较,P<0.05,具有统计学意义;同一时间不同浓度组与对照组增殖抑制率比较,P<0.05,具有统计学意义
紫杉醇浓度(μg/mL)0.00±0.00 0.00±0.00 0.00±0.00 0.001 11.33±0.27 13.71±0.21 20.11±0.15 0.01 15.37±0.42 26.19±0.74 33.66±0.26 0.1 18.61±0.34 34.03±0.52 50.33±0.43 1 30.83±0.55 44.99±0.37 66.22±0.51 10 39.81±0.47 60.27±0.28 79.53±0.38 100 50.41±0.62 87.67±0.46 97.12±0.22作用时间24 h 48 h 72 h 0

图1 紫杉醇不同浓度-时间增殖抑制率曲线图
表2 不同浓度紫杉醇作用24、48h后的JEG-3细胞凋亡率(%,n=3,±s)
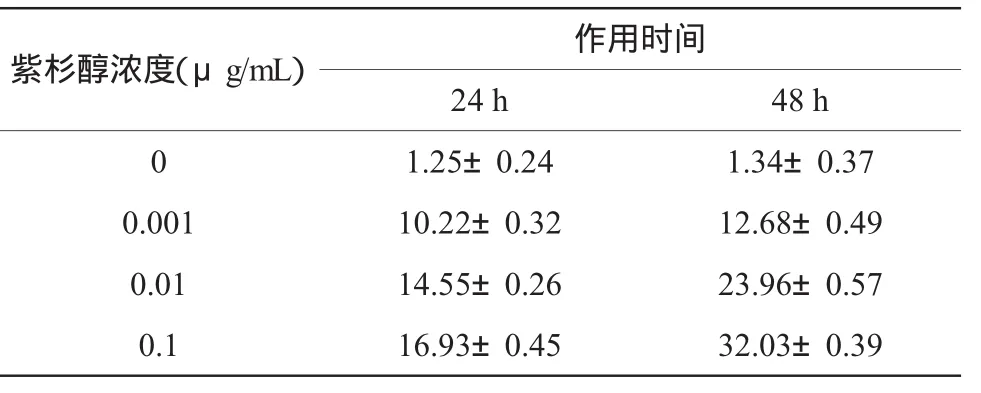
表2 不同浓度紫杉醇作用24、48h后的JEG-3细胞凋亡率(%,n=3,±s)
注:按α=0.05水准,同一浓度不同时间组与对照组凋亡率比较,P<0.05,具有统计学意义;不同时间组间比较,P<0.05,具有统计学意义;同一时间不同浓度组与对照组凋亡率比较,P<0.05,具有统计学意义;不同浓度组间两两比较,P<0.05,具有统计学意义
紫杉醇浓度(μg/mL) 作用时间24 h 48 h01.25±0.24 1.34±0.37 0.001 10.22±0.32 12.68±0.49 0.01 14.55±0.26 23.96±0.57 0.1 16.93±0.45 32.03±0.39
2.2 流式细胞仪检测JEG-3细胞凋亡率和细胞周期
2.2.1 细胞凋亡率 分别用终浓度为0.001、0.01及0.1μg/mL的紫杉醇处理JEG-3细胞24 h和48 h,随着紫杉醇作用浓度的增加和药物作用时间的延长,细胞凋亡率逐渐增大。各组比较差异均有显著性,见表2及图 2、3。
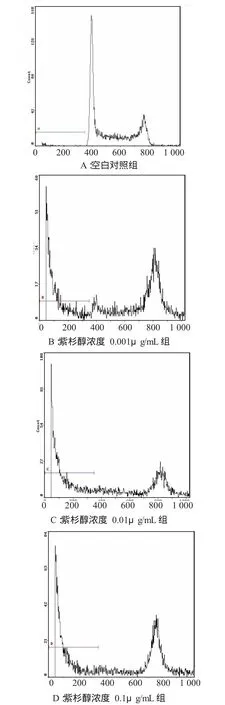
图2 不同浓度紫杉醇作用24h后JEG-3细胞凋亡图
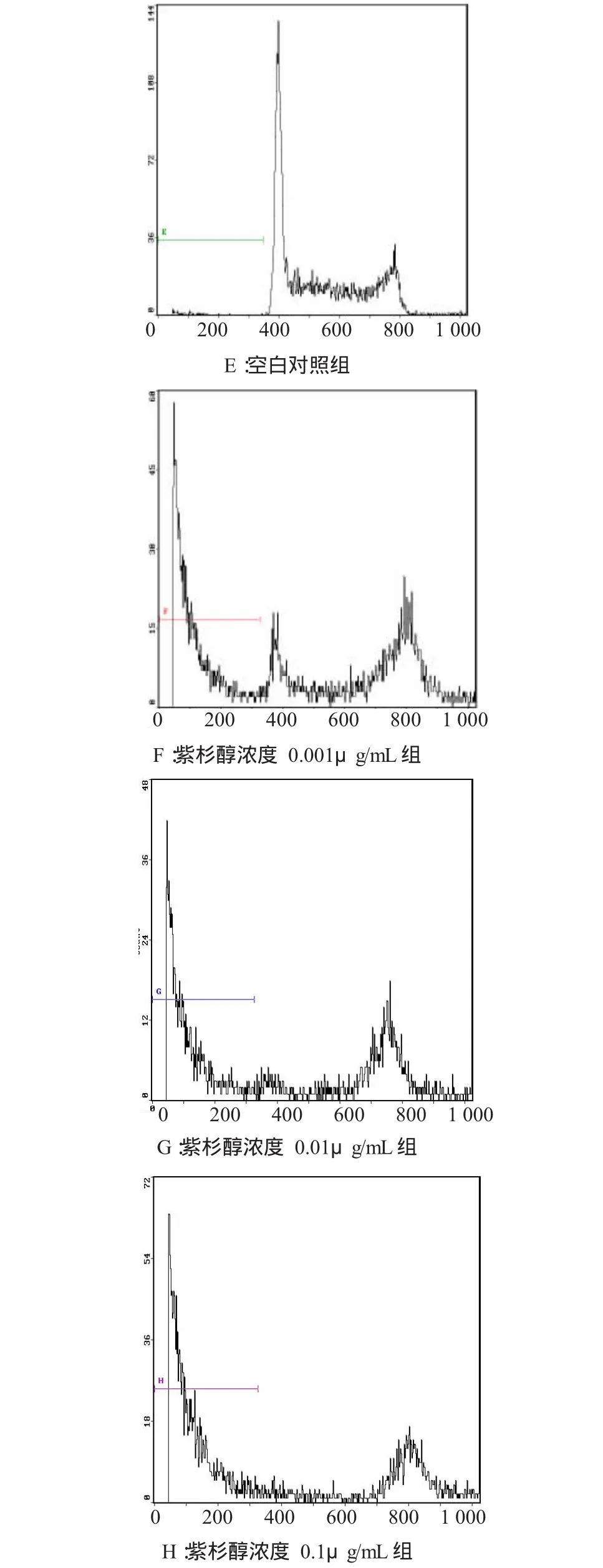
图3 不同浓度紫杉醇作用48h后JEG-3细胞凋亡图
2.2.2 细胞周期分析 分别用终浓度为0.001、0.01及0.1μg/mL的紫杉醇处理JEG-3细胞24 h和48 h,同一时间,随着紫杉醇浓度的增加,G2/M期细胞百分比增加,P<0.05,有统计学意义,见表3及图4、5。
表3 不同浓度紫杉醇处理JEG-3细胞24和48h后的细胞周期百分比(%,n=3,±s)
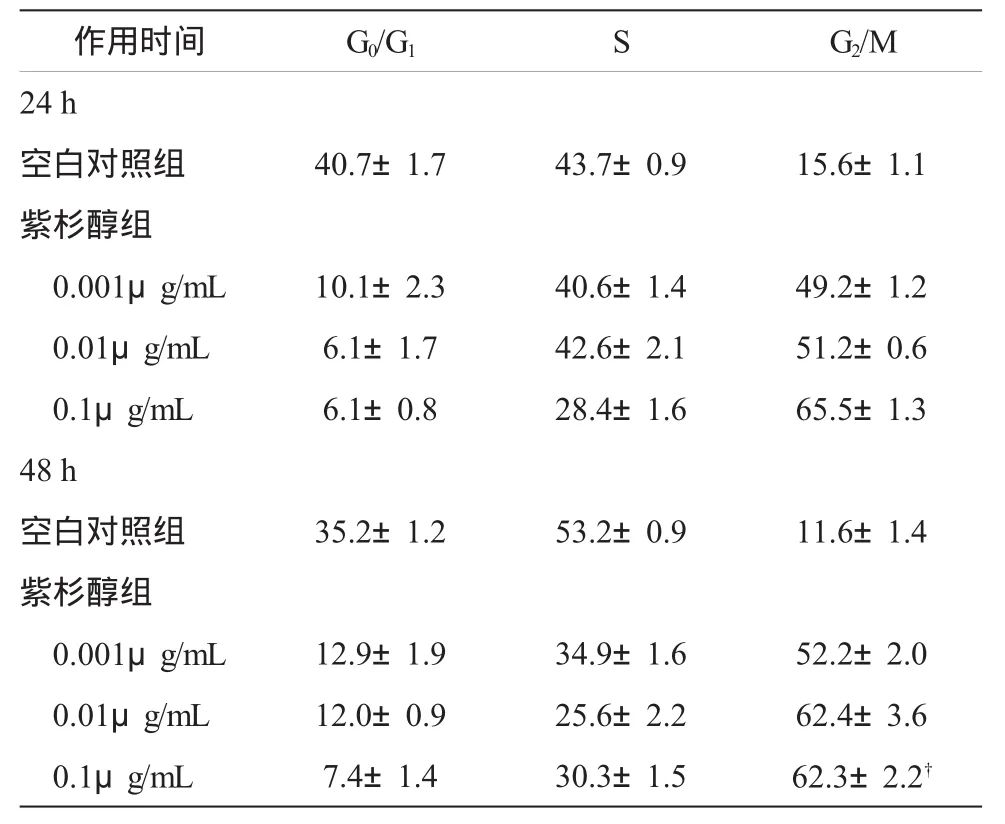
表3 不同浓度紫杉醇处理JEG-3细胞24和48h后的细胞周期百分比(%,n=3,±s)
注:按α=0.05水准,同一时间不同浓度组G2/M期细胞百分比均大于对照组,P<0.05,具有统计学意义。†为实验误差
作用时间 G0/G1SG2/M 24 h空白对照组 40.7±1.7 43.7±0.9 15.6±1.1紫杉醇组0.001μg/mL 10.1±2.3 40.6±1.4 49.2±1.2 0.01μg/mL 6.1±1.7 42.6±2.1 51.2±0.6 0.1μg/mL 6.1±0.8 28.4±1.6 65.5±1.3 48 h空白对照组 35.2±1.2 53.2±0.9 11.6±1.4紫杉醇组0.001μg/mL 12.9±1.9 34.9±1.6 52.2±2.0 0.01μg/mL 12.0±0.9 25.6±2.2 62.4±3.6 0.1μg/mL 7.4±1.4 30.3±1.5 62.3±2.2†
3 讨论
自发现一系列有效化疗药物后,绒癌的治愈率明显提高,使其成为能单用化疗得以治愈的实体肿瘤之一。绒癌常用的化疗药物是氟尿嘧啶、更生霉素及氨甲喋呤等。然而,有部分绒癌患者对这些常用的化疗药物不敏感,治疗后病情仍进展,需改用二线或三线化疗[4]。为解决这一棘手的临床问题,寻找有效的化疗药及其它有效治疗方法如手术等具有重要的临床意义[5]。
紫杉醇是一种细胞周期特异性抗肿瘤药物,它作用的主要靶点是微管系统,它能促进微管聚合,抑制微管降解,使细胞分裂阻滞在G2/M期,最终导致细胞死亡,紫杉醇对G2/M期的阻滞作用是诱导细胞凋亡的重要机制[6]。由于紫杉醇诱导细胞凋亡的作用,故对多种恶性肿瘤具有显著的疗效。紫杉醇在卵巢癌的治疗中已积累了大量的临床经验,目前已成为卵巢癌化疗的一线药物。紫杉醇在滋养细胞肿瘤的临床应用报道较少,对耐药性滋养细胞肿瘤的治疗虽然也有成功的报道,但多为个案或少数病例,其确切疗效尚有待进一步临床验证。JONES等[7]在2例对EMA-co和DDP耐药的绒癌治疗中,使用紫杉醇或结合卡铂均有效。体外实验证实,紫杉醇能诱导人绒癌JAR细胞的凋亡[8]。王华斌等[9]研究了紫杉醇、顺铂对绒癌更生霉素耐药细胞株和非耐药细胞株的抑制作用,结果发现两种细胞株对紫杉醇和顺铂均具有敏感性。

图4 不同浓度紫杉醇作用24h后JEG-3细胞周期图
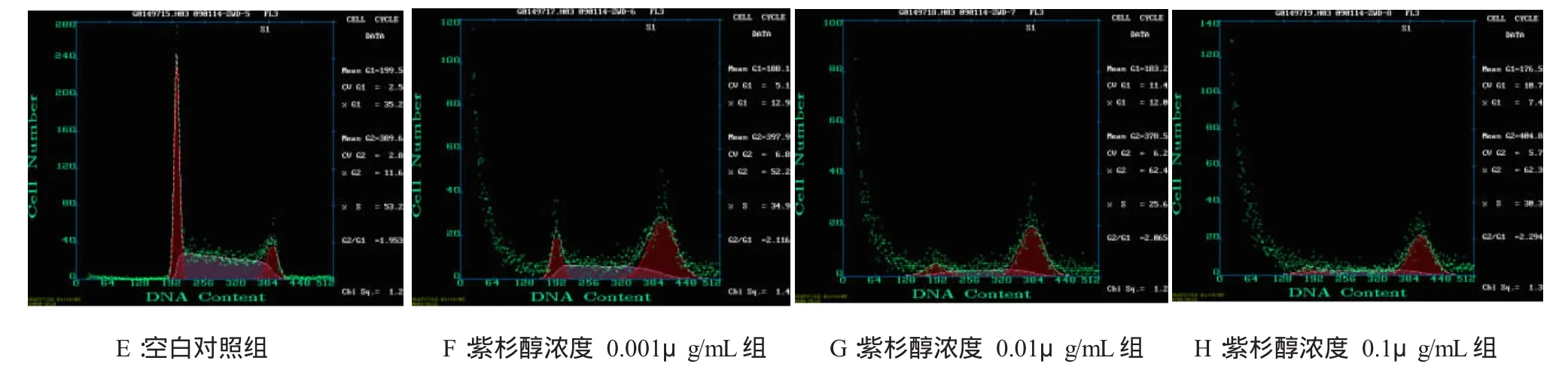
图5 不同浓度紫杉醇作用48h后JEG-3细胞周期图
本研究通过MTT法测定了紫杉醇对绒癌细胞生长的抑制作用,发现随着紫杉醇浓度的加大和作用时间的延长,细胞存活率逐渐下降,表明紫杉醇对绒癌细胞的杀灭作用呈时间和剂量依赖关系。通过计算发现紫杉醇作用于绒癌细胞72 h的IC50为0.1μg/mL,和目前临床上对紫杉醇敏感肿瘤的IC50值基本相当[10]。
紫杉醇是细胞阻断剂,能够诱导多种癌细胞的凋亡,它的抗癌效果与其诱导细胞凋亡的能力密切相关。本实验通过流式细胞仪检测发现不同浓度紫杉醇作用24 h和48 h后,各紫杉醇作用组细胞凋亡率均大于对照组,且随着紫杉醇浓度的增加,细胞凋亡率增加;同一浓度紫杉醇作用下,随着作用时间的延长,细胞凋亡率也增加。
G2/M期是细胞周期的两个重要检查点之一,是细胞增殖的重要阶段。多种DNA损伤剂(射线、化学药物等)均可引起G2/M`期阻滞,由于G2/M期阻滞在抑制细胞增殖和促进细胞凋亡中的作用,因此G2/M期阻滞与抑制多种肿瘤的发生、发展关系密切。余志英等[11]在研究紫杉醇诱导卵巢癌细胞凋亡及细胞周期改变时发现,随着药物作用时间的延长,G2/M期阻滞逐渐明显。本研究发现,紫杉醇作用于绒癌细胞后随着药物浓度的增加,G2/M期细胞的百分比明显增加。但DZIADYK等[12]认为,紫杉醇诱导的凋亡和G2/M期细胞阻滞无关,而是通过NF-KB/IKB途径诱导肿瘤细胞凋亡的。本实验的结果不支持此观点,倾向于认为紫杉醇通过将绒癌细胞周期阻滞在G2/M期,从而诱导绒癌细胞的凋亡。
[1]LURAIN JR,NEJAD B.Secondary chemotherapy for high-risk gestational trophoblastic neoplasia[J].Gynecol Oncol,2005,97:618-623.
[2]向 阳.高危及耐药性滋养细胞肿瘤的化疗[J].中国实用妇科与产科杂志,2008,24(9):657-659.
[2]XIANG Y.The chemotherapy of high risk and drug-resistant gestational trophoblastic neoplasia[J].Chinese Journal of Practical Gynecology and Obstetrics,2008,24(9):657-659.Chinese
[3]ATKINSON DE,GREENWOOD SL,SIBLEY CP,et al.Role of MDR1 and MRP1 in trophoblast cells,elucidated using retroviral gene transfer[J].Am J Physiol Cell Physiol,2003,285:C584-591.
[4]MATSUI H,IITSUKA Y,SUZUKA K,et al.Salvage chemotherapy for high-risk gestational trophoblastic tumor[J].J Reprod Med,2004,49:438-442.
[5]FENG FZ,XIANG Y,CAO Y,et al.Efficacy of surgical management combined with chemotherapy in the treatment of drug-resistant gestational trophoblastic neoplasm[J].Chinese Journal of Obstetrics and Gynecology,2008,43(10):728-731.Chinese
[6]ROUSSEL E,BELANGER MM,COUEL J.G2/M blockade by paclitaxel induces caveolin-1 expression in A549 lung cancer cells:caveolin-1 as a marker of cytotoxicity[J].Anticancer Drugs,2004,15(10):961-967.
[7]JONES WB,SCHNEIDER J,SHAPIRO F,et al.Treatment of resistant gestational choriocarcinoma with taxol:a report of two cases[J].Gynecol Oncol,1996,61:126-130.
[8]CHEN HZ,SHI YF,ZHENG W.Paclitaxel induces apoptosis of choriocarcinoma cell line JAR[J].Chinese Journal of Obstetrics and Gynecology,1999,34(2):121.Chinese
[9]王华斌,郑 伟.紫杉醇,顺铂对绒癌耐药细胞抑制作用的观察[J].齐齐哈尔医学院学报,2002,23(9):963-965.
[9]WANG HB,ZHENG W.Effects of Paclitaxel and Cisplatin on drug resistant human choriocarcinoma cell line JAR/KSM in vitro[J].Journal of Qiqihaer medical college,2002,23(9):963-965.Chinese
[10]JUDSON PL,WATSON JM,GERHRING PA,et al.Gisplatin inhibits paclitaxel-induced apoptosis in cisplatin-resistant ovarian cancer cell lines:possible explanation for failure of combination therapy[J].Cancer Res,1999,59:2425-2432.
[11]余志英,李丽文,杜 静,等.紫杉醇诱导卵巢癌细胞凋亡及细胞周期改变的研究[J].中国医师杂志,2006,18(3):322-324.
[11]YU ZY,LI LW,DU J,et al.Study on apoptosis and changes of cell cycle in ovarian cells induced by paclitaxel[J].Journal of Chinese Physician,2006,18(3):322-324.Chinese
[12]DZIADYK J M,SUI M,ZHU X,et al.Paclitaxel-induced apoptosis may occur without a prior G2/M-Phase arrest[J].Anticancer Res,2004,24(1):27-36.
