苦石莲化学成分及药理活性研究进展△
2010-11-03黄明堦陈燕丹魏道智
黄明堦,陈燕丹,魏道智*
(1.福建农林大学生命科学学院,福建 福州 350002;2.福建农林大学材料工程学院,福建 福州 350002)
综 述
福建省自然科学基金(2008J0037)、福建省青年人才创新基金(2007F3009)、福建农林大学青年教师科研基金(08B09)项目
*魏道智,E-mailhmj7921@163.com
苦石莲化学成分及药理活性研究进展△
黄明堦1,陈燕丹2,魏道智1*
(1.福建农林大学生命科学学院,福建 福州350002;2.福建农林大学材料工程学院,福建 福州350002)
综述了苦石莲挥发性成分、乙醇提取物的化学成分和主要药理活性的研究进展。苦石莲含有不饱和脂肪酸、二萜类、黄酮类等多种化学成分,具有抗病毒、抗肿瘤、抑菌等药理活性,具有广阔的开发前景和较大的利用价值。
苦石莲;化学成分;药理活性
苦石莲CaesalpiniaminaxHance,别名南蛇勒,喙(荚)果云实,老鸦枕头,打鬼棒,生长于山坡林中或灌木中,是一种药食同源植物[1]。国产喙荚云实产藏量在云实属植物中位居第二,约为6.42×106kg,仅次于云实的产藏量,主要分布于广西、广东、云南、贵州、福建等地[2-3]。因此,苦石莲作为喙荚云实(南蛇勒)的种子,资源相当丰富。苦石莲性凉、味苦,有清热解毒、化湿、散瘀止痛功效,主治风热感冒、痢疾、淋浊、痈肿、跌打损伤等[4],在民间为治疗流感和肝炎等病的常用药,已被广西、贵州、四川等省区的中药材标准收载[5-7]。为了更好地对该植物的化学成分及药理活性进行研究,本文就其化学成分和药理活性的研究进展作一综述。
1 化学成分研究
1.1苦石莲挥发性成分的研究
袁经权等[8]通过石油醚常温渗漉提取方法和甲酯衍生化技术,采用GC-MS联用分析手段对苦石莲的脂肪酸甲酯化产物及挥发油成分进行了分离鉴定,共检出174个色谱峰,鉴定出其中的63个化合物。结果显示不饱和脂肪酸类化合物是苦石莲油脂的主要化学成分,预示着苦石莲油脂可能对由高血脂引起的心脑血管疾病有较好的预防和治疗作用。
霍昕等[9]利用水蒸气蒸馏法分别从苦石莲粉仁和种皮中提取挥发性成分,进而借助气-质联用系统对其挥发性成分进行了定性、定量分析。在苦石莲普通粉仁中共分离出102个化学成分,鉴定出51个化学成分,相对百分含量为59.52%。袁月玲等[10]用同样的提取方法与分析手段,对苦石莲种皮普通粉和微粉的挥发性成分进行了对比研究。结果在苦石莲皮普通粉中分离出115个化学成分,鉴定了63个化学成分,检出率为54.7%。而在微粉中则分离出了119个化学成分,鉴定出64个化学成分。两种粉末挥发性成分中有54种相同成分,且微粉中含量高于普通粉中相应成分的有28种,表明苦石莲微粉样品更能提高挥发性成分的溶出率,对分析检测较有利。
文献报道结果显示苦石莲含有大量的油脂及挥发油类成分,其分析数据为进一步开发苦石莲提供了科学依据。尽管目前已分离出数百种的挥发性成分,但均有约50%以上的成分未能获得鉴定,因此,有关苦石莲挥发性成分的提取分离方法以及检测手段和条件等都还有待进一步的研究。
1.2苦石莲乙醇提取物的化学成分研究
目前,以苦石莲乙醇回流提取物进行化学成分研究的文献报道居多,且绝大多数延用了JiangRW等[11-14]的研究方法,即先获得乙醇的总提取物;而后再将该提取物经水分散后依次分别用正己烷(或石油醚)、三氯甲烷、醋酸乙酯、正丁醇进行逐级萃取分离,获得相应的四大部分有机相萃取物;最后将各部分有机萃取物经反复多次的硅胶柱层析分离、梯度洗脱收集和重结晶等步骤获得纯产物。结合熔点测定值,借助FTIR、NMR、MS、X-射线单晶衍射分析等多种现代谱学表征手段对相关成分进行结构鉴定,迄今共鉴定出数十种化学成分,其中大部分为二萜类化合物。有关苦石莲化学成分提取分离的大致流程归纳如图1所示。
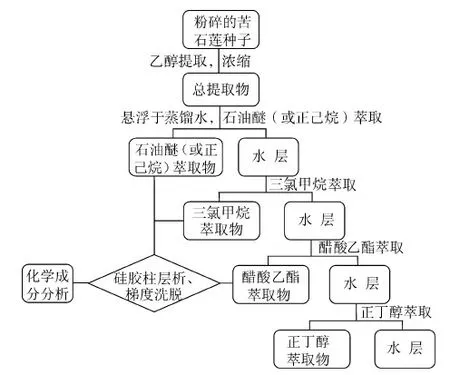
图1 苦石莲化学成分提取分离路线示意图
1.2.1石油醚萃取物的化学成分 袁经权等[15]将苦石莲的石油醚萃取物经反复硅胶柱层析分离及石油醚-醋酸乙酯梯度洗脱后,分离得到5个部分并鉴定出2个化学成分,分别为β-谷甾醇(β-sitosterol) 和硬脂酸(stearic acid)。
1.2.2三氯甲烷萃取物的化学成分 Jiang R W等[12]最先对苦石莲三氯甲烷萃取物的化学成分加以研究,caesalmin A 和 caesalmin B是苦石莲三氯甲烷萃取物中最早被鉴定的2个卡萨烷型呋喃二萜类化合物。此后,该研究小组又陆续分离鉴定了7个新的呋喃二萜类化合物,分别为caesalmin C,D,E,F,G,H和bonducellpin D,另外1个化合物为豆甾醇[11]。上述二萜类化合物的化学结构式如图2所示。Jiang R W 等[14]利用MS、NMR、IR、UV等现代谱学分析手段和X射线单晶衍射对它们的结构进行了表征。此外,他们采用相似的分离纯化手段,还鉴定了一个结构新颖的大十元环状卡桑骨架呋喃二萜内酯化合物,并将其命名为“macrocaesalmin”,其化学结构式和分子结构示意图分别参见图2和图3。单晶结构解析结果显示macrocaesalmin含有1个1,5-二酮环,且是首例具有B-D环呈顺式并合模式几何构型的呋喃二萜内酯化合物。Macrocaesalmin在固态时通过2个分子间弱的C-H…O氢键作用形成二聚体存在。十元环A呈椅式-船式-椅式构型,不饱和B环由于与平面呋喃环C呈顺式并合模式而以扭曲半椅式构型存在。为了考察macrocaesalmin化合物“顺式并合”结构模式的稳定性,Jiang R W等利用密度泛函理论(DFT)对其分子结构进行优化计算,结果显示macrocaesalmin的顺式异构体的基态能量比反式异构体低7.51kcal·mol-1,进一步验证了macrocaesalmin的顺式异构体为更稳定的几何构型。
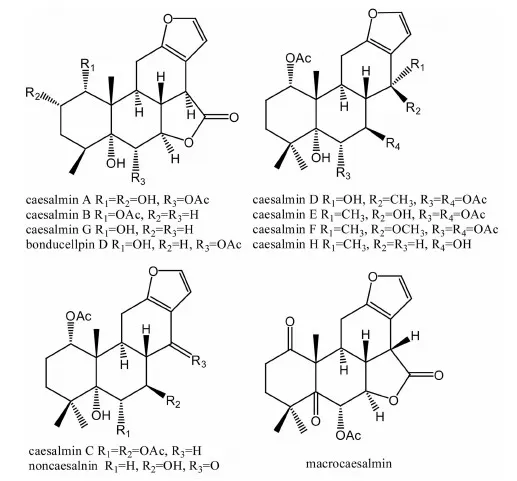
图2 呋喃二萜类化合物的结构式
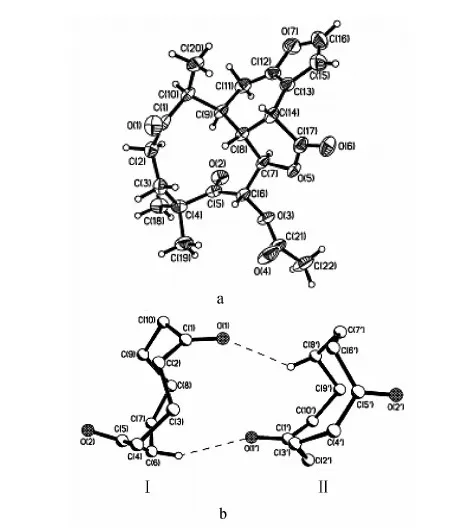
a.macrocaesalmin化合物的分子结构图 b. macrocaesalmin化合物二聚体间的氢键作用图3 macrocaesalmin化合物的分子结构图及二聚体间的氢键作用示意图
袁经权等[15]利用硅胶、凝胶和制备薄层等常规色谱分离方法从苦石莲乙醇提取物的三氯甲烷萃取部分中分离得到5个组分,采用波谱技术和化学方法鉴定了3个化合物。其中1个为已知的caesalmin C,该化合物在苦石莲中的含量相对较大,抗病毒活性较强,可作为有效成分定量分析苦石莲的质量。其余2个化合物:norcaesalnin E(结构式参见图2)和5-羟甲基-2-呋喃醛为首次从苦石莲中分离得到。
吴兆华等[16]采用三氯甲烷-甲醇溶剂系统,通过硅胶柱色谱、凝胶柱色谱和重结晶等方法从苦石莲三氯甲烷浸膏中分离和鉴定了9个化合物。除了Caesalmin C、Caesalmin D、Caesalpin F、β-谷甾醇为已知组分外,首次从该植物中分离鉴定出β-amyrin、Caffeine、胡萝卜苷(Daucosterol)和2个新的二萜类化合物[17-18]。综合解析该二萜类化合物的波谱数据并与文献报道值相比较,确定2个呋喃二萜化合物分别为Neocaesalpin L1和minaxin A,其结构式如图4所示。Neocaesalpin L1的化学结构式与已知的Neocaesalpin L之间的差异在于C-12上的取代基不同,前者是甲氧基,而后者则为羟基,参见图4所示。
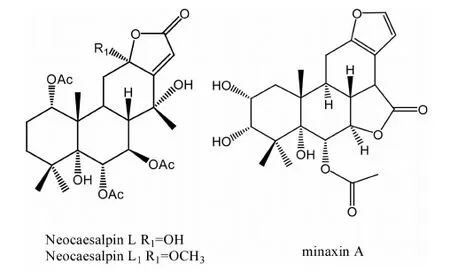
图4 Neocaesalpin L, L1和minaxin A的结构式
1.2.3醋酸乙酯萃取物的化学成分 袁经权等[15]利用硅胶柱层析技术,以三氯甲烷-甲醇为洗脱剂,从醋酸乙酯萃取物中分离得到8个部分,并从中鉴定出3个新的苦石莲化学成分,依次为蔗糖、咖啡酸十八醇酯、2,5-二羟基苯甲酸乙酯。最近,Cheng Y等[19]利用中压液相制备色谱和反相高效液相色谱技术,从醋酸乙酯萃取物中也同样分离到1个卡萨烷型二萜类化合物,结合波谱数据确定其结构与吴兆华等[17]报道的Neocaesalpin L1相同。
综上可以看出,苦石莲乙醇提取物的三氯甲烷萃取物部分获得分离、鉴定的化学成分最多,而正丁醇萃取物部分的化学成分研究迄今未见文献报道,有必要对其加强研究。在众多已鉴定的化学成分中,多数为呋喃二萜类化合物,从而构成了苦石莲具有抗病毒等药理活性的物质基础。
2 药理活性研究
2.1抗病毒活性
苦石莲中多量的呋喃二萜类化合物赋予该植物强的药理活性。JiangRW等[11]研究了Caesalpiniaminax种子中 caesalmin C,D,E,F,G和豆甾醇的抗病毒作用。结果表明,上述化合物有抗Para3病毒(副流感病毒模型3)的活性,其中四环呋喃二萜化合物对Para3病毒的抑制活性最佳,其次是呋喃二萜内酯,而豆甾醇的抑制作用最弱。除此之外,抑制病毒引起细胞病变程度(CPE)的活体检测结果显示caesalmin B和bonducellpin D对Para3病毒也有中等强度的抑制活性,但其毒性较强,二者的TI(毒性指数)值分别达到2.8和2.7。而macrocaesalmin化合物对Para3病毒和Flu-A(A型流感病毒)无抑制活性,却对RSV(呼吸道合胞体病毒)有抑制作用,且SI(选择系数)值高达5.7,具有良好的安全性。为了进一步考察呋喃二萜类化合物的分子结构、极性对抗病毒活性的影响,Jiang R W等[13]将天然分布较丰富的caesalmin D、E、F3种呋喃二萜化合物中的乙酸基(-OAc)还原成羟基(-OH)制得相应的衍生物,测定比较了3种衍生物与其母体化合物对Para3病毒抑制活性的IC50(使50%的实验病毒数遭到有效抑制生长或杀死的最大效应浓度)值。结果表明,还原衍生物的抗病毒活性比起相应的母体化合物有明显的下降。研究结果还指出,四环类呋喃二萜比五环呋喃二萜内酯化合物具有更优异的抗病毒活性,而且伴随化合物极性的增大,其抗病毒活性呈下降趋势。他们的研究结果为研究呋喃二萜化合物的药理活性机制的研究提供了很有价值的借鉴。
袁经权等[15]以狗肾细胞为宿主,分别将苦石莲的石油醚萃取物、三氯甲烷萃取物、醋酸乙酯萃取物、正丁醇萃取物和水溶部位以及回收率较大的caesalmin C作为抗流感甲型病毒活性筛选的备份,测定样品的CPE。结果表明苦石莲醋酸乙酯萃取物和caesalmin C对抗流感甲型病毒活性最强,正丁醇萃取物最差。从它们的TC50来看,石油醚萃取物、氯仿萃取物、醋酸乙酯萃取物、水溶部位和caesalmin C相差不大,但比正丁醇萃取物小得多,表明在相同条件下,正丁醇萃取物使实验病毒细胞中毒的机率要远远小于其他5种备份。醋酸乙酯萃取物、水溶部位和caesalmin C的SI选择指数均大于1,说明它们的安全性良好。
2.2抗肿瘤(癌)活性
余旭亚等[20-21]最早从苦石莲中分离纯化出相对分子质量为19800的南蛇勒蛋白(CMP)。当CMP浓度为22.0μg·mL-1时,CMP可抑制黑色素瘤细胞增殖60% (P<0.05),抑制率为96%(P<0.05),表明CMP对黑色素瘤细胞KI735M2的增殖具有抑制作用。此外,他们还利用 C M-Sephadex C25和 Sephadex G-75层析柱,通过浸提、盐析、离子交换、凝胶过滤层析等实验手段从苦石莲籽中分离纯化得到1个分子量约为29.64kD的苦石莲蛋白。该蛋白在一定实验条件下对小鼠黑色素瘤细胞B16细胞的抑制率约为88.91%。以上研究显示了苦石莲蛋白对恶性黑色素瘤细胞具有较明显的抑制作用,表明苦石莲具有抗肿瘤的潜在药用价值,但有关该类蛋白对其他肿瘤细胞的增殖抑制作用及机理研究还有待进一步地深入开展。另外,苦石莲中的minaxin A化合物对人肝癌细胞HepG2也表现出一定的生长抑制作用,其IC50为(56.8±1.2)μmol·L-1[18]。
2.3抑菌活性及保肝作用
有文献报道了苦石莲95%乙醇提取物对大肠杆菌、金黄色葡萄球菌、绿脓杆菌和镰刀菌的抑制作用,尤其对绿脓杆菌的抑菌效果较好,最低抑菌浓度(MIC)为0.25%,最低杀菌浓度(MBC)为0.5%[1]。研究者经芦丁标准比色法测定出南蛇勒提取物中含有黄酮类化合物,并由此推测提取物的抑菌活性可能与其存在有关。
刘明等[22]研究了苦石莲60%乙醇提取物对四氯化碳所致小鼠急性肝损伤的保护作用。结果表明,苦石莲各剂量组均能对抗CCl4引起的急性肝损伤小鼠血清ALT(谷丙转氨酶)、AST(谷草转氨酶)及肝脏系数升高,且这些作用均呈剂量依赖性,但具体的护肝作用机理尚不清楚。
3 苦石莲的开发及应用展望

[1] 余旭亚,李涛,汪帅,等.南蛇勒提取物抑菌作用研究[J]. 昆明理工大学学报(理工版),2006,31(3):69-71.
[2] 胡剑波,何顺志,陈龙珠,等.中国云实属药用植物产藏量及生境调查[J].中国中药杂志,1999,24(3):134-136.
[3] 何顺志.云实属药用植物开发利用概括[J].中草药,2000,31(3):225-226.
[4] 国家中医药管理局.中华本草(四分册) [M].上海:上海科技出版社,1998:374-375.
[5] 广西壮族自治区卫生厅.广西中药材标准[S].广西:广西科学技术出版社,1992:63.
[6] 贵州省卫生厅.贵州省中药材质量标准[S].贵阳:贵州省人民出版社,1990:26.
[7] 四川省卫生厅.四川省中药材标准[S].四川:四川省卫生厅出版社,1987:58.
[8] 袁经权,冯洁,杨峻山,等.苦石莲脂肪酸及挥发油成分的气相色谱-质谱分析研究[J].中草药,2007,38(12):1797-1798.
[9] 霍昕,刘文炜,袁月玲,等.苦石莲普通粉仁挥发性成分研究[J].生物技术,2008,18(3):51-53.
[10] 袁月玲,霍昕,高玉琼,等.苦石莲皮普通粉和微粉挥发性成分对比研究[J].时珍国医国药,2009,20(1):65-67.
[11] Jiang R W,Ma S C,Paul P H But, et al.New Antiviral Cassane Furanoditerpenes from Caesalpinia minax [J].J. Nat. Prod.,2001,64(10):1266-1272.
[12] Jiang R W,Paul P H But,Ma S C,et al.Furanoditerpenoid lactones from the seeds of Caesalpinia minax Hance [J]. Phytochemistry,2001,57:517-521.
[13] Jiang R W,Ma S C,He Z Dan,et al.Molecular structures and antiviral activities of naturally occurring and modified cassane furanoditerpenoids and friedelane triterpenoids from Caesalpinia minax[J].Bioorganic & Medicinal Chemistry,2002,10:2161-2170.
[14] Jiang R W,Paul P H But,Ma S C,et al.Structure and antiviral properties of macrocaesalmin, a novel cassane furanoditerpenoid lactone from the seeds of Caesalpinia minax Hance [J].Tetrahedron Letters,2002,43:2415-2418.
[15] 袁经权,邹忠杰,杨新洲,等.苦石莲化学成分研究[J].药物分析杂志,2008,28(9):1489-1493.
[16] 吴兆华,王立波,高慧媛,等.喙荚云实的化学成分[J].沈阳药科大学学报,2008,25(8):639-641.
[17] 吴兆华,王立波,高慧媛,等.喙荚云实中的一个新二萜类化合物[J].中国中药杂志,2008,33(10):1145-1147.
[18] 吴兆华.喙荚云实中一个新二萜类化合物[J].中草药,2008,39(8):1127-1129.
[19] Cheng Y, Ma L Y, Miao J H,et al.A new cassane diterpenoid lactone from the seed of Caesalpinia minax [J]. Chinese Chemical Letters,2009,20:444-446.
[20] Yu X Y,Xie L P,Zhang Y,et al.Multiple Suppressive Effects of a Protein from Caesalpinia minax on Murine Melanoma Cells [J].Tsinghua Science and Technology,2002,7(6):88-91.
[21] 余旭亚,李涛,林连兵,等.南蛇勒蛋白对黑色素瘤细胞的抑制及分化作用[J].中国生化药物杂志,2004,25(5):294-296.
[22] 刘明,李丽仙,罗廷顺,等.苦石莲对CCl4所致小鼠急性肝损伤保护作用研究[J].中国药师,2009,12(3):300-301.
[23] 何正春.苦石莲种子在白族民间入药方剂4例[J].中国民族民间医药杂志,2001,(52):306.
[24] 郑民实,李文.400种中草药对HBsAg的抑制作用[J].中国医药学报,1991,6(3):30-31.
[25] 吴兆华,王立波,高慧媛,等.云实属植物化学成分及药理活性研究进展[J].中国现代中药,2007,9(2):25-30.
[26] 余旭亚,李涛,孟庆雄,等.南蛇勒总黄酮的提取及含量测定[J].食品研究与开发,2008,29 (4):138 -141.
2009-09-11)
