天然葡萄酒酵母菌种的分离、鉴定和酿造性能评价*
2010-11-02李慧王惠玲吴雅琨黄卫东
李慧,王惠玲,吴雅琨,黄卫东
(中国农业大学食品科学与营养工程学院,北京,100083)
天然葡萄酒酵母菌种的分离、鉴定和酿造性能评价*
李慧,王惠玲,吴雅琨,黄卫东
(中国农业大学食品科学与营养工程学院,北京,100083)
从“北红”葡萄汁的自然发酵液中分离天然葡萄酒酵母,利用WL营养琼脂培养基对分离菌株进行分类鉴定,共分离到7种类型的葡萄酒酵母,其中1株具有典型的酿酒酵母特征。对该株酵母进行进一步的显微形态观察、生理生化试验及DNA序列分析,证明为酿酒酵母。利用模拟葡萄汁模拟标准葡萄汁的成分,以2株商业葡萄酒酵母为参照,研究分离酿酒酵母的酿造特性,研究结果显示,分离菌株具有良好的酒精转化性能,较快的酒精发酵速率及甘油产生能力。对模拟葡萄汁进行改良以研究分离菌株的胁迫耐受性,研究结果表明,改良模拟葡萄汁适于葡萄酒酵母单一抗逆性能的研究,分离菌株具有良好的温度(特别是高温)、酒精、渗透压和低pH耐受性。天然葡萄汁对分离菌株酿造性能的检测结果进一步证明该菌株良好的酿造特性。
WL营养琼脂培养基,模拟葡萄汁,改良模拟葡萄汁,天然葡萄酒酿酒酵母,酿造性能
葡萄酒的风格不仅与葡萄品种和酿造工艺密切相关,酵母等微生物的发酵作用也非常显著。因此,虽然有商业葡萄酒酵母可供使用,但一些葡萄酒生产商更倾向于选育葡萄产区酵母来生产具有产区特色的葡萄酒[1-2]。产区酵母已经适应了本地的微环境,易于在葡萄酒发酵中占主导地位,更重要的是,使用产区酵母酿造葡萄酒可以保证产区的典型特色[3]。
中国葡萄酒的工业化虽持续约100多年,但为保证发酵速率和发酵产品的一致性并避免污染,大多数国内葡萄酒生产商都使用进口活性干酵母。而我国葡萄栽培面积广阔,葡萄适栽区的生态地理环境多种多样,蕴藏着丰富的葡萄酿酒微生物资源。这些微生物资源长期被搁置,因此分离收集优质葡萄酒产区酵母,利用合理的葡萄酒酵母培养体系对酵母酿造性能进行评价,对本土酵母菌种的选育和生产高品质的“特色”、“产区”葡萄酒非常必要和迫切。
本研究从“北红”葡萄汁的自然发酵液中分离出天然葡萄酒酵母,利用WL营养琼脂培养基对分离菌株进行了分类鉴定,并采用模拟葡萄汁及在此基础上改良的模拟葡萄汁对分离菌株进行酿造性能研究,克服了使用天然葡萄汁进行酵母酿造性能研究的不足,探索了一套适于分离、鉴定及评价葡萄酒酵母的系统。
1 材料与方法
1.1 葡萄原料及试验菌种
1.1.1 酿酒葡萄原料
中科院植物研究所(北京)葡萄园采摘成熟的红葡萄酒酿造品种——“北红”(Muscat hamburg×V.amurensis)葡萄果实;河北怀来葡萄园采摘成熟的“赤霞珠”葡萄果实(Vitis vinifera L.cv.Cabernet Sauvignon)。
1.1.2 试验菌种
酿酒酵母BH8(Saccharomyces cerevisia),本实验室分离并保存;商业葡萄酒酵母AWRI R2和Freddo,分别由Marivin(Australian)及 Erbslöh(Germany) 公司商业化,因具有良好的发酵性能而被国内的一些葡萄酒厂使用。为方便说明,分别将酵母AWRI R2,Freddo和BH8重新编号为A、F和B。
1.2 葡萄汁
1.2.1 天然葡萄汁
“北红”及“赤霞珠”葡萄经除梗、破碎后添加0.03g/L的果胶酶和100 mg/L的SO2,混合均匀后备用。
1.2.2 模拟葡萄汁 (model synthetic medium,MSM)
MSM培养基可以模拟标准葡萄汁的成分,适于研究葡萄酒酵母的酿造特性[4-5]。模拟葡萄汁的成分为(g/L):葡萄糖 (100),果糖 (100),酒石酸(3),柠檬酸 (0.3),L-苹果酸 (0.3),KH2PO4(2),MgSO4·7H2O(0.2)。氮源 (190 mg total N/L):(NH4)2SO4(0.3 g),Asn(0.6 g)。无机盐 (mg/L):MnSO4·H2O(4),ZnSO4·7H2O(4),CuSO4·5H2O (1), KI(1), CoCl2· 6H2O (0.4),(NH4)6Mo7O24·4H2O(1),H3BO3(1)。维生素(mg/L):肌醇 (300),生物素 (0.04),硫酸铵 (1),吡哆醇(1),烟酸 (1),泛酸(1)。脂肪酸 (mg/L):棕榈酸 (1),棕榈烯酸 (0.2),硬脂酸 (3),油酸(0.5),亚油酸 (0.5),亚麻酸 (0.2)。脂肪酸混合物用Tween 80及100%的乙醇溶解,pH值调整为3.3。
1.3 培养基
(1)YPD固体培养基(g/L):酵母粉(10),蛋白胨(20),葡萄糖(20),琼脂(20)。
(2)葡萄酒酵母WL鉴别培养基(g/L):酵母粉(4.0),胰蛋白胨 (5.0),葡 萄糖 (50),KH2PO4(0.55),KCl(0.425),CaCl2(0.125),MgSO4(0.125),FeCl3(0.002 5),MnSO4(0.002 5),琼脂(20),溴甲酚绿(0.022)。
(3)改良模拟葡萄汁:改良模拟葡萄汁的成分与模拟葡萄汁的成分基本相同,但葡萄糖及果糖的浓度分别调整为10g/L,pH值调整为5.8。
1.4 试验方法
1.4.1 天然葡萄酒酵母的分离、纯化与鉴定
1.4.1.1 葡萄酒自然发酵
将采集的用以分离酵母的葡萄样品(“北红”葡萄)除梗、破碎,添加果胶酶。取混匀后的400mL葡萄汁分装入灭菌的500mL三角瓶中,25℃自然发酵。发酵工艺采用红葡萄酒的发酵工艺,不添加商业酵母及SO2。期间取样用于分离酵母,取样重复2次。
1.4.1.2 天然葡萄酒酵母的分离与纯化
葡萄酒自然发酵过程中取样,将样品梯度稀释后涂布于YPD平板以分离酵母,28℃恒温箱中培养3 d,结合镜检和菌落的形态观察,从平板上挑取分离良好、具有典型性的单菌落,经进一步纯化后转管低温保存。
1.4.1.3 天然葡萄酒酵母的菌种鉴定
将分离纯化的酵母菌种梯度稀释后涂布于WL平板,25℃培养5~7 d,观察菌落颜色和形态。挑取具有典型酿酒酵母形态特征的菌株,送中科院微生物研究所进行酵母生理和分子生物学鉴定。
1.4.2 葡萄酒酿造试验
所有的酿造试验使用红葡萄酒的酿造工艺,试验进行3次,使用灭菌的三角瓶,静止培养,活化菌种接种量为0.5%,25℃培养。三角瓶体积/葡萄汁的体积为5/4,使用棉塞或添加有浓H2SO4的发酵栓封口。
1.4.3 葡萄酒酵母细胞培养试验
酵母细胞培养试验进行3次,使用灭菌的三角瓶摇床培养,培养基为改良模拟葡萄汁,接种量为0.5%,三角瓶体积/培养基体积为5/1,培养条件为28℃、160 r/min。每2 h取样1次,利用分光光度计在600 nm波长下测定菌液的吸光度并结合酵母细胞活性分析以绘制酵母生长曲线。
1.4.4 葡萄酒酵母胁迫耐受性能试验
1.4.4.1 温度(高温)耐受性能试验
活化菌种转接于改良模拟葡萄汁中,接种量为1%。分别在22、28、37、40及44℃下三角瓶摇床培养24 h,每3 h取样1次,利用分光光度计在600 nm测定菌液的吸光度以绘制酵母生长曲线。
1.4.4.2 酒精耐受性能试验
活化菌种转接于酒精浓度调整为4%、8%、10%和12%的改良模拟葡萄汁中,接种量为1%,28℃培养24 h,每3 h取样1次,利用分光光度计在600 nm波长下测定菌液的吸光度以绘制酵母生长曲线,以不添加酒精的为对照。
1.4.4.3 渗透压耐受性能试验
酵母渗透压试验经常使用NaCl和山梨醇作为渗透压处理剂[6-7]。为避免离子伤害,本试验选用非离子的,不被酵母代谢利用的山梨醇作为渗透压胁迫处理剂。1mol/L山梨醇添加到含20g/L糖的培养基中所引起的渗透压相当于200g/L糖引起的渗透压[8-9]。
活化菌种转接于含 1.0、1.5、1.7 及 2.0mol/L山梨醇的改良模拟葡萄汁,接种量为1%,28℃培养24 h,每3 h取样1次,以不添加山梨醇的为对照,利用分光光度计在600 nm波长下测定菌液的吸光度以绘制酵母生长曲线。
1.4.4.4 pH 耐受性能试验
用5mol/L H2SO4或5mol/L NaOH将改良模拟葡萄汁的 pH 值调整为 2.8、3.0、3.3、5.8 及 8.0,活化好的菌种分别转接于上述培养基中,接种量为1%,28℃培养24 h,每3 h取样1次,测定600 nm下菌液的吸光度以绘制酵母生长曲线。
以上所有试验,各处理重复次数均为3次。
1.5 分析方法
1.5.1 细胞生长测定
测定菌液的OD600nm值或菌液梯度稀释后涂布于YPD平板,28℃培养72 h后计算活菌落数。
1.5.2 葡萄糖、果糖、乙醇、甘油的检测及CO2失重的测定
1.5.2.1 葡萄糖、果糖、乙醇、甘油的检测
按Liu等[10]的方法,使用高效液相色谱仪 (Waters 2695,Milford,MA,USA),色谱柱为 Aminex HPX-87H(300 mm ×7.8 mm)(Bio-Rad;USA)。柱温65℃;流动相为0.005mol/L H2SO4,流速为0.600mL/min。检测器为示差检测器;进样量20μL。
1.5.2.2 CO2失重的测定
接种前、接种后及发酵过程中,用电子天平称重(精确到0.01 g)发酵瓶,称前先摇晃瓶子,以排除CO2。
1.5.4 总酸的测定
按国标GB/T 15038-2006指示剂法进行。
1.6 数据分析
所有的试验进行 3次,使用 SPSS11.0(SPSS Inc.Chicago,IL)软件进行数据分析。S-N-K(NEWMAN Keuls)单因素方差分析比较平均值。差异显著性设为 P≤0.05。
2 结果与分析
2.1 天然葡萄酒酵母的分离
从“北红”的自然发酵液中分离的酵母在WL培养基上可形成7种不同的菌落形态。参照Cavazza等[11]详细描述的葡萄酒相关酵母在WL营养琼脂上的菌落特征,其中BH8的菌落特征与酿酒酵母相符,在WL培养基上为奶油色带绿色,球形突起,表面光滑,不透明。显微形态观察显示,细胞形状为圆形、椭圆形、出芽生殖,呈典型的酵母形态。该组酵母经中科院微生物所进一步进行生理生化试验及核糖体ITS区的克隆和测序,也证明为酿酒酵母 (Saccharomyces cerevisiae)。
2.2 分离酿酒酵母菌株在模拟葡萄汁中的酿造性能
2.2.1 分离酿酒酵母菌株酒精转化能力及酒精发酵速率
模拟葡萄汁中,酵母还原糖的消耗、乙醇的产量、酵母细胞的生长及CO2的失重如图1所示。
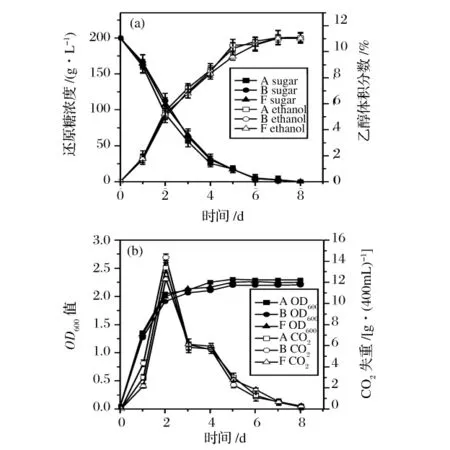
图1 菌株A、B和F在模拟葡萄汁发酵过程中糖消耗、乙醇产生(a)及CO2失重、酵母生长的动态曲线(b)
从图1可以看出,与2株参照商业葡萄酒酵母菌株A和F相比,分离菌株B显示了良好的乙醇转化能力、乙醇转化速率和生长特征。发酵到第2天,酵母开始进入稳定期,细胞数增殖到2.0×108CFU/mL[图1(b)],此时,糖消耗速率和乙醇生成速率加快[图1(a)],CO2失重值最大[图1(b)]。发酵至第6天时,培养基中的糖降至0.5%以下,乙醇含量达到11%以上,发酵至第7天时,发酵基本结束,最终产生的乙醇浓度为11.01%(A),11.02%(B)及11.03%(F)。
2.2.2 分离酿酒酵母菌株产甘油的能力
在模拟葡萄汁发酵过程中,分离菌株B与2株商业菌株A和F甘油的产量如图2所示。
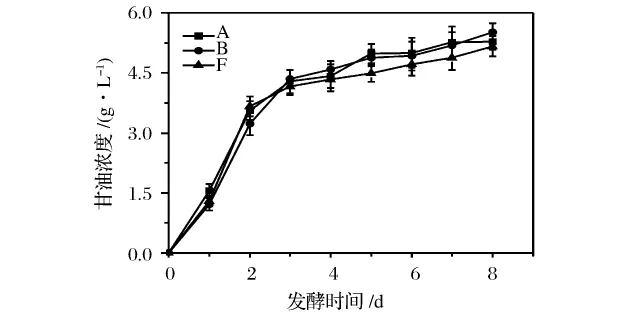
图2 菌株A、B和F在模拟葡萄汁发酵过程中甘油的产生
从图2可以看出,甘油的产量在发酵前2天增加迅速,随后逐渐增加,发酵结束时,发酵液中甘油的含量分别达到5.28g/L(A),5.51g/L(B)和5.17g/L(F),与2株商业酵母菌株相比,菌株B显示了良好的甘油生产能力。甘油不仅是酵母重要的抗逆应答代谢产物,而且是一种重要的风味化合物,葡萄酒中的甘油具有甜味,可增加葡萄酒的圆润感和丰厚感[12]。酵母产甘油的能力也是葡萄酒酵母菌种选育的重要指标。
2.3 改良模拟葡萄汁对葡萄酒酿酒酵母抗逆性能的测定
葡萄酒酿造过程中,要求具有耐温度变化、耐高渗透压、耐酒精、耐低pH等抗逆性能[13],它是葡萄酒酵母菌种选育的重要指标。
2.3.1 改良模拟葡萄汁对葡萄酒酿酒酵母生长的影响
使用MSM研究葡萄酒酵母的酿造性能,具有使用方便、结果重复性好的优点。但是,作为可被酵母代谢利用的碳源,MSM中的糖浓度(200g/L)将不断减少,同时培养基中的乙醇浓度将不断增加,加上培养基中较低的pH值(pH 3.3)等各种因素的影响,用该培养基研究酵母的抗逆性能,通常是多种胁迫因素对酵母的影响。参照培养酵母常用的YPD培养基,本研究将MSM中还原糖的含量调整为20g/L,pH值调整为5.8。首先检测改良模拟葡萄汁对葡萄酒酵母生长的影响(图3)。
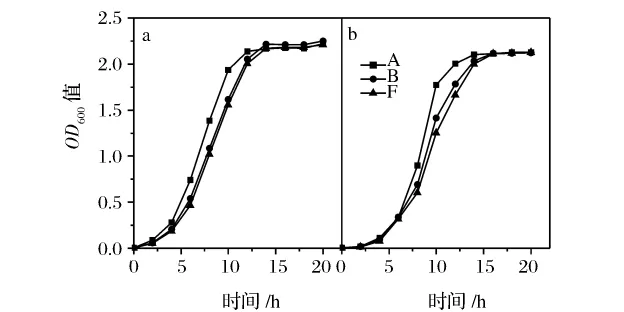
图3 菌株A、B和F在YPD培养基(a)和改良模拟葡萄汁(b)中的生长情况
从图3可以看出,在相同接种量、相同培养条件下,分离菌株B和商业菌株A、菌株F在改良模拟葡萄汁中都能生长良好。与在YPD培养基中的生长相比,虽然3株酵母的迟滞期大约延长了1 h,但对数期和稳定期都比较长,并没有受到显著影响;用改良模拟葡萄汁培养3株酵母至稳定期时,酵母细胞数也都分别达到2.0×108CFU/mL以上。因此,改良模拟葡萄汁也适合葡萄酒酵母的生长,可用于培养葡萄酒酵母。
2.3.2 分离酵母菌株的温度(高温)耐受性分析
不同培养温度(22、28、37、40 及 44℃)下,分离酵母菌株B及菌株A、菌株F在改良模拟葡萄汁中的生长曲线如图4所示。
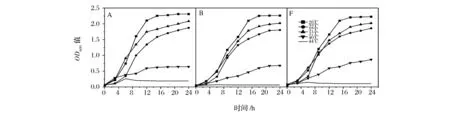
图4 不同培养温度下,菌株A、B和F在改良模拟葡萄汁中的生长 (n=3,sd<16%)
从图4可以看出,分离菌株B与菌株A、菌株F一样可以在较宽的温度(高温)范围内生长。28℃是酵母的适宜生长温度,22℃或37℃对该酵母生长的影响比较小,只有当培养温度升高至40℃时,细胞的对数期才明显延长,培养24 h后,细胞的生物量仅为28℃培养温度下的30%(OD600的比值)左右。而在44℃的培养温度条件下,酵母的生长停滞,细胞长久的处于迟滞期。
2.3.3 分离酵母菌株的乙醇耐受性分析
培养基中添加了4%、8%、10%及12%的乙醇后,酵母的生长曲线如图5所示。
从图5可以看出,3株酵母都可以在含4%~10%乙醇的培养基中生长,表现出良好的乙醇耐受性。但随着乙醇体积分数的增加,细胞的生物量明显降低。当培养基中乙醇体积分数为8%和10%时,细胞的对数期明显延长,且10%的乙醇影响更为明显,培养24 h后,细胞的生物量仅为对照的30%(OD600的比值)左右。在含12%乙醇的培养基中,3株酵母的生长都基本停滞。

图5 菌株A、B和F在含不同浓度乙醇的改良模拟葡萄汁中的生长 (n=3,sd<16%)
2.3.4 分离酵母菌株的渗透压耐受性分析
从酵母在含不同浓度山梨醇的培养基中的生长曲线(图6)可以看出,与商业酵母菌株A和F对比,菌株B也表现出较好的渗透压耐受性。虽然1.5mol/L的山梨醇已经明显抑制了酵母的生长,但即使继续增加山梨醇的浓度至2.0mol/L,培养24 h后,细胞的生物量仍能达到对照的50%(OD600的比值)左右。

图6 菌株A、B和F在含不同浓度山梨醇的改良模拟葡萄汁中的生长 (n=3,sd<16%)
2.3.5 分离酵母菌株的低pH值耐受性分析
不同pH值对酵母生长的影响如图7所示。从图7可以看出,与菌株F和菌株B相比,商业菌株A显示了更宽的pH耐受范围,但实验室新分离的菌株B和商业菌株F也能在较低的pH培养条件下生长。pH值调整为3.3时对酵母生长的影响比较小,当培养基的pH值调整为3.0时,细胞的迟滞期和对数期都有所延长,当pH值为2.8时,3株酵母都停滞生长,细胞长久的处于迟滞期。

图7 菌株A、B和F在不同pH值的改良模拟葡萄汁中的生长 (n=3,sd<16%)
试验结果显示,改良模拟葡萄汁可用于葡萄酒酵母单一胁迫耐受性能的研究。分离菌种具有良好的温度(高温)、酒精、渗透压及低pH值耐受性能。
2.4 分离菌株在“北红”葡萄汁及“赤霞珠”葡萄汁中发酵性能的比较
进一步研究分离菌株在天然葡萄汁中的乙醇转化性能。所使用的酿造原料为分离该菌株的“北红”葡萄,及采自河北怀来葡萄园的“赤霞珠”葡萄。
2.4.1 葡萄汁基本成分分析
“北红”葡萄汁及“赤霞珠”葡萄汁中糖、酸含量及pH值如表1所示。
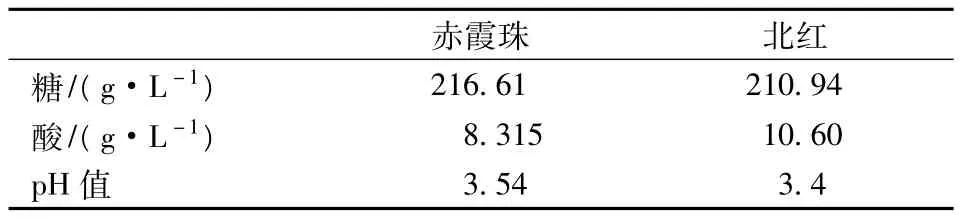
表1 “北红”葡萄汁及“赤霞珠”葡萄汁成分分析 (n=3,sd<12%)
2.4.2 分离菌株在“北红”葡萄汁及“赤霞珠”葡萄汁中的乙醇转化能力
还原糖的消耗,乙醇的产量如图8所示。
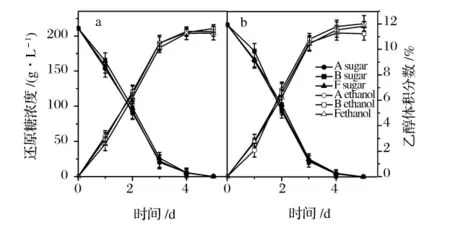
图8 菌株A、B和F在“北红”葡萄汁 (a)和“赤霞珠”(b)葡萄汁发酵过程中糖的消耗及乙醇的产生
从图8可以看出,分离菌株B及菌株A和F在天然葡萄汁中都表现出了良好的乙醇转化能力和较快的乙醇转化速率。在葡萄汁中的发酵周期仅为4 d。发酵结束时产生乙醇的浓度,“北红”葡萄汁为11.63%(A),11.72%(B)及 11.58%(F);“赤霞珠”葡萄汁为 12.03%(A),11.84%(B)及 11.82%(F)。
2.4.3 分离菌株在“北红”葡萄汁及“赤霞珠”葡萄汁中的甘油生成能力
“北红”葡萄汁及“赤霞珠”葡萄汁发酵过程中,分离菌株及2株商业菌株甘油的产量如图9所示。
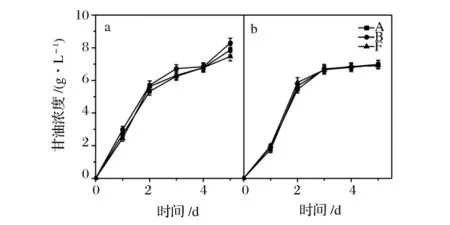
图9 菌株A、B和F在“北红”葡萄汁 (a)和“赤霞珠”(b)葡萄汁发酵过程中甘油的产生
从图9可以看出,3株酵母在2种葡萄汁中发酵,都能产生大量的甘油,含量高于6g/L。分离菌株显示了更好的甘油生成能力,尤其使用“北红”葡萄汁发酵,产生更多的甘油。
3 讨论
WL营养琼脂被设计用于饮料发酵过程中微生物类群的监测。Cavazza 等[11]和 Pallmann 等[14]的研究表明,在葡萄酒自然发酵过程中出现大多数典型的酵母菌种都可以用WL营养琼脂培养基进行区分,主要基于菌落颜色和菌落形态。虽然该方法对于酵母菌种鉴定的准确度无法与测序相比,但对于不需要非常准确的分类试验和数量较大的菌种鉴定工作来说,WL营养琼脂是相当简便、快速并且也是十分有效和节俭的方法。本研究利用WL营养琼脂培养基对从“北红”葡萄汁的自然发酵液中分离的天然葡萄酒酵母进行分类鉴定,共分离到7种类型的葡萄酒酵母,其中一株具有典型的酿酒酵母特征。进一步通过显微形态观察、生理生化试验及DNA序列分析也证明该酵母为酿酒酵母。
由于天然葡萄汁的供应具有季节性限制,葡萄栽培产区、葡萄栽培品种等原因引起的葡萄汁成分的差异,使对选育葡萄酒酵母菌种酿造性能的评价难以长期、有效、一致的进行。因此,国外的研究人员[4-5]使用模拟葡萄汁(MSM)。MSM既可以模拟标准葡萄汁的成分,减少天然葡萄汁中的固态成分对分离酵母细胞的影响,还具有使用方便、结果重复性好的优点。更重要的是MSM是完全化学合成的培养基,可以方便的进行成分调整。但是,MSM不适于研究葡萄酒酵母的单一胁迫耐受性能,所以本研究将MSM进行改良。改良后的MSM适于葡萄酒酵母的生长并适于研究葡萄酒酵母的单一胁迫耐受性。采用模拟葡萄汁、改良模拟葡萄汁对实验室新分离葡萄酒酿酒酵母的酿造特性进行评价,分离菌种显示了良好的乙醇转化性能;较快的乙醇发酵速率及甘油产生能力;较好的温度(特别是高温)、乙醇、渗透压及低pH值耐受性能。天然葡萄汁对该菌株酿造性能的研究进一步支持上述结论。
本研究首先分离天然葡萄酒酵母,并对葡萄酒酵母菌种简便、快速的分离和鉴定方法进行探索,进一步利用葡萄酒酵母的实验室培养体系研究分离菌株的酿造特性,为研究本土葡萄酿酒微生物资源的生物多样性,分离收集优质葡萄酒产区酵母菌株,推动产区葡萄酒的发展奠定基础。
[1]Jemec K P,Raspor P.Initial Saccharomyces cerevisiae concentration in single or composite cultures dictates bioprocess kinetics[J].Food Microbiol,2005,22:293-300.
[2]Mercado L,Dalcero A,Masuelli R,et al.Diversity of Saccharomyces strains on grapes and winery surfaces:A-nalysis of their contribution to fermentative flora of Malbec wine from Mendoza(Argentina)during two consecutive years[J].Food Microbiol,2007,24:403-412.
[3]Nikolaou E,Soufleros E H,Bouloumpasi E,et al.Selection of indigenous Saccharomyces cerevisiae strains according to their oenological characteristics and vinification results[J].Food Microbiol,2006,23:205-211.
[4]Marullo P,Bely M,Masneuf-Pomarede I,et al.Inheritable nature of enological quantitative traits is demonstrated by meiotic segregation of industrial wine yeast strains[J].Fems Yeast Res,2004,4:711-719.
[5]Masneuf-Pomarède I,Mansour C,Murat M L,et al.Influence of fermentation temperature on volatile thiols concentrations in Sauvibnon blanc wines[J].Int J Food Microbiol,2006,108:385-390.
[6]Carvalheiro F,Roseiro JC,Gírio FM.Interactive effects of sodium chloride and heat shock on trehalose accumulation and glycerol production by Saccharomyces cerevisiae[J].Food Microbiol,1999,16:543-550.
[7]Siderius M,Kolen C P A M,van Heerikhuizen H,et al.Candidate osmosensors from Candida utilis and Kluyveromyces lactis:structural and functional homology to the Sholp putative osmosensor from Saccharomyces cerevisiae[J].Biochim et Biophy Acta,2000,1 517:143-147.
[8]Novo M T,Beltran G,Torija M J,et al.Changes in wine yeast storage carbohydrate levels during preadaptation,rehydration and low temperature fermentations[J].Int J Food Microbiol,2003,86:153-161.
[9]Pérez-Torrado R,Carrasco P,Aranda A,et al.Study of the first hours of microvinification by the use of osmotic stress-response genes as probes[J].Syst Appl Microbiol,2002,25:153-161.
[10]Liu H J,Liu D H,Zhong J J.Interesting physiological response of the osmophilic yeast Candida krusei to heat shock[J].Enzyme Microb Tech,2005,36:409-416.
[11]Cavazza A,Grando M S,Zini C.Rilevazione della flora microbica di mosti e vini[J].Vignevini,1992(9):17-20.
[12]Nikolaou E,Soufleros E H,Bouloumpasi E,et al.Selection of indigenous Saccharomyces cerevisiae strains according to their oenological characteristics and vinification results[J].Food Microbiol,2006,23:205-211.
[13]Cardona F,Carrasco P,Pérea-Ortín JE,et al.A novel approach for the improvement of stress resistance in wine yeasts[J].Int J Food Microbiol,2007,114:83-91.
[14]Pallmann C L,Brown J A,Olineka T L,et al.Use of WL medium to profile native flora fermentations[J].Am J Enol Vitic,2001,52(3):198-203.
Study on the Isolation,Identification of Native Wine Yeast and the Evaluation of Its Oenological Characteristics
Li Hui,Wang Hui-ling,Wu Ya-kun,Huang Wei-dong
(College of Food Science & Nutritional Engineering,China Agricultural University,Beijing 100083,China)
Native wine yeasts isolated from spontaneously fermenting Beihong red wine grape(Muscat Hamburg×V.amurensis)were plated onto Wallerstein Laboratory Nutrient Agar(WL).Seven unique colony morphologies were identified and one strain showed distinct character of Saccharomyces cerevisia.Further identification by micro-morphological observation,physiological and biochemical experiment and DNA sequence analysis also confirmed the strain as S.cerevisia.The model synthetic medium which could simulate a standard grape juice was used to study the important enological traits of the newly selected S.cerevisia,the results showed that the newly selected S.cerevisia had high ethanol production,high fermentation activity and high glycerol production.The model synthetic medium was modified to study the stress tolerance of the newly selected S.cerevisia,the result showed that the modified model synthetic medium could be used for analyzing single stress tolerance of wine yeast,the newly selected wine yeast could tolerant high temperature,high ethanol concentration,high sorbitol concentration and low pH.Pilot scale fermentation using nature grape juice also showed that the newly selected S.cerevisia had desirable fermentative behavior.
WL medium,model synthetic medium,modified model synthetic medium,native wine yeast,oenological characteristics
博士研究生(黄卫东教授为通讯作者)。
*北京科委重大项目(D07060500160701)
2010-04-21,改回日期:2010-09-07
