酶解核桃蛋白制备抗氧化肽工艺条件优化*
2010-11-02康玮丽唐军虎敬思群
康玮丽,唐军虎,敬思群
(新疆大学生命科学与技术学院,新疆乌鲁木齐,830046)
酶解核桃蛋白制备抗氧化肽工艺条件优化*
康玮丽,唐军虎,敬思群
(新疆大学生命科学与技术学院,新疆乌鲁木齐,830046)
采用单因素试验和响应面分析,以对DPPH自由基的清除率为响应值,研究了酶与底物的比值([E]/[S])、pH值和酶解温度对制备抗氧化肽工艺的影响。确定了采用碱性蛋白酶制备核桃抗氧化肽的最佳酶解条件为:[E]/[S]为2.6%,pH值9,酶解温度为49℃,[S]为2%,酶解时间为2h,在此条件下制备的核桃抗氧化肽对DPPH自由基的清除率达69.85%。
核桃蛋白,抗氧化肽,酶解,响应面分析法,优化
核桃是胡桃科核桃属多年生落叶乔木的坚果,学名Juglans regia L.又名为胡桃、羌桃、合桃等,是四大干果之一,也是世界上栽培最广,经济价值最高的木本油料、干果和用材树种之一[1]。
核桃中除了含有高达65%~83%的核桃油脂以外,还含有大量的核桃蛋白。核桃蛋白由清蛋白、球蛋白、醇溶谷蛋白和谷蛋白所构成[2]。研究发现,核桃蛋白质中18种氨基酸齐全,特别是人体必需的8种氨基酸含量合理,不但是很好的蛋白源,还是优良的制备多肽的原料[3]。
随着自由基生命科学研究的不断发展,氧化应激损伤和抗氧化保护作用的理论备受关注,衰老、癌症及心血管等疾病被公认为与氧化应激损伤及自由基代谢失调相关,因而筛选具有强抗氧化活性的天然资源已成为生物学、医学和食品科学研究的新趋势[4-5]。
本研究探讨了碱性蛋白酶酶解核桃蛋白制备抗氧化肽的工艺参数,并研究了酶解液对自由基的清除作用,为核桃蛋白的深加工提供科学依据。
1 材料与方法
1.1 材料和仪器
核桃,新疆和田产薄皮核桃,由新疆阿布丹食品开发有限公司提供;核桃蛋白,实验室自制;Alcalase2.4L碱性蛋白酶,AS1398中性蛋白酶,木瓜蛋白酶,均购于杰能科酶制剂有限公司;其它试剂均为分析纯。
BS210S型分析天平(感量0.0001g),福建科立龙电子有限公司;RE-52型旋转蒸发器,上海亚荣生化仪器厂;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;FD-1-50冷冻干燥机,北京博医康实验仪器有限公司;JXL型沉淀离心机,上海医用分析仪器厂;电子精密pH指示计,上海精密科学仪器有限公司;数湿恒温磁力搅拌器,上海沪西分析仪器厂;紫外可见分光光度计,尤尼柯(上海)仪器有限公司;HH-S型水浴锅,巩义市英峪于华仪器厂。
1.2 方法
1.2.1 核桃抗氧化肽的制备工艺
1.2.1.1 脱脂核桃粉制备工艺
去壳核桃仁在65℃下,用1.5%NaOH溶液浸泡30 min后去皮,然后放置于超低温速冻冰箱中,在-50℃下速冻20 min。取出的核桃仁冷冻干燥24 h后进行粉碎,按1∶6的料液比在65℃下用正己烷回流提取4 h,然后经4 000 r/min离心20 min,去上清液后所得的残渣,再经冷冻干燥24 h后,得到脱脂核桃粉。
1.2.1.2 脱脂核桃蛋白制备工艺[6]
脱脂核桃粉粉碎后过40目筛,在45℃下,按1∶20的料液比加水搅拌,然后用1.0mol/L NaOH调节pH到9,并用超声波在25 kHz、300 W下搅拌1 h,再经4 000 r/min离心20 min。去油层和下层沉淀后所得蛋白上清液加入活性炭进行脱色,过滤后的滤液用1mol/L HCl溶液调pH至5.0,再经4 000 r/min离心20 min,用去离子水洗涤沉淀3次后调pH值至7.0,冷冻干燥得到脱脂核桃蛋白粉。
1.2.1.3 核桃抗氧化肽制备工艺[7]
将脱脂核桃蛋白粉放入酶反应器中,并加入去离子水搅拌均匀,50℃下恒温水浴溶解30 min,用1.0mol/L NaOH调pH至酶的最适值后加酶,采用pH-stat法控制反应体系的pH值在设定pH的±0.03之间,反应结束后,90℃灭酶10 min,添加1.0mol/L HCl调pH值至7.0,8 000 r/min离心20 min,上清液经大孔吸附树脂脱盐,再经真空浓缩,冷冻干燥后得到核桃抗氧化肽。
1.2.2 分析方法
1.2.2.1 水解度(DH)测定
采用 pH-stat法[8]。
1.2.2.2 核桃抗氧化肽体外抗氧化活性测定
(1)DPPH自由基清除能力的测定[9]:准确称取DPPH标准品2.56 mg,用无水甲醇定容到100mL容量瓶中,使终浓度为6.5×10-5mol/L。精确称取一定量的核桃抗氧化肽,溶解于蒸馏水,使终浓度为4mg/mL。各取0.5mL待测样依次与2.5mL 6.5×10-5mol/L DPPH溶液室温避光反应30min,同时以无水甲醇调0、蒸馏水为空白做对照,于517nm波长测定吸光值,计算DPPH清除率。

式中:A0,空白吸光值;A1,样品吸光值。
(2)酶解物还原力的测定[10]:取酶解液2.5mL,加0.2mol/L磷酸钠缓冲液(pH6.6)2.5mL和1%的铁氰化钾(赤血盐)溶液2.5mL,然后将混合物放入50℃水浴保温20min;加入质量浓度为10%的三氯醋酸2.5mL混合,取5mL混合液于25mL比色管中,加入5mL去离子水和0.1%的氯化铁1mL,混合均匀,定容至25mL,在680 nm下测定吸光度,吸光度越高,说明还原力越高,即抗氧化性越强。
2 结果与分析
2.1 影响碱性蛋白酶酶解核桃蛋白的因素
2.1.1 酶源的确定
由于酶与底物的反应表现出一定的特异性,不同蛋白酶对同一种蛋白质底物的作用结果并不相同,蛋白质水解物中多肽的长度及结构也不同,因此酶的种类和酶水解蛋白的能力对酶解产物的抗氧化能力具有很大的影响[11]。核桃分离蛋白在pH值接近5.0时,表现出较差的溶解性,这是因为此pH值接近核桃蛋白的等电点。溶液pH值高于或低于等电点都有利于蛋白质溶解性的增加,这是因为在等电点两侧蛋白质与水分子的相互作用较强,另外蛋白质分子间的相互排斥作用也较强[12]。因此实验中选用Alcalase 2.4L碱性蛋白酶、AS1398中性蛋白酶及木瓜蛋白酶对其进行酶解。水解情况见图1。
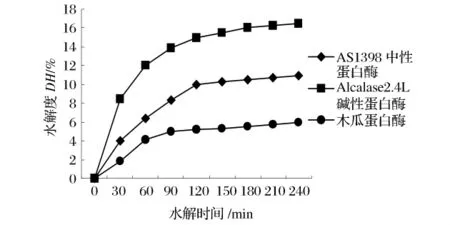
图1 不同种类蛋白酶对核桃蛋白水解度的影响
由图1可知,实验用3种酶对核桃蛋白的水解能力有较大的差别,其水解能力由大到小依次为:Alcalase 2.4L碱性蛋白酶、AS1398中性蛋白酶、木瓜蛋白酶。选择Alcalase 2.4L碱性蛋白酶为实验用酶。此外,从A1calase 2.4L碱性蛋白酶对核桃蛋白的水解度曲线可以看出,反应前2h,DH增加较快,后2h增加趋于缓慢,综合考虑成本和效率,在实验中选择反应时间为2 h。
在酶种确定的前提下,影响蛋白质酶解的因素主要有底物浓度、酶浓度、反应温度、反应pH值等,因而采用单因素试验分别讨论上述因素对酶解效果的影响。
2.1.2 底物浓度[S]对核桃蛋白水解度及抗氧化活性的影响
选用 Alcalase2.4L 在pH值9.0,50℃,[E]/[S]为2.5%的条件下水解2 h,研究底物浓度[S]对核桃蛋白水解度和抗氧化活性的影响,结果分别见图2和图3。

图2 底物浓度对水解度及还原能力的影响
底物浓度过低会导致底物分子与酶分子结合的几率降低,最终影响酶促反应的速率,使反应速度降低;底物浓度过高,酶的活性部位已全部被底物分子占据,反应速度趋于极限,达到零级反应[13]。由图2可知,随着底物浓度的增加,酶解物的还原能力和水解度都逐渐增强。当底物浓度达到2%后,还原能力的增长趋势变缓;底物浓度达到5%后,水解度开始下降。
由图3可知,当底物浓度达到2%时,酶解物对DPPH自由基的清除能力最强。当底物浓度达到5%时,酶解物的水解度达到最大值。

图3 底物浓度对水解度及DPPH自由基清除率的影响
图2和图3的结果表明,随着底物浓度的增加,水解度和酶解物的抗氧化性并不具有明显的相关性,并不是水解度越大,所得酶解物的抗氧化效果就越好,而是在特定的水解度下,酶解物才具有最大的抗氧化能力,因此选择底物浓度范围为1%~3%。
2.1.3 加酶量与底物浓度比[E]/[S]对核桃蛋白水解度及抗氧化活性的影响
选用 Alcalase2.4L 在pH值9.0,50℃,[S]为2%的条件下水解2 h,研究加酶量与底物浓度比[E]/[S]对核桃蛋白水解度和抗氧化活性的影响,结果分别见图4和图5。

图4 [E]/[S]对水解度及还原能力的影响
从图4可以看出,随着酶量的增加,水解度和还原能力也不断增强。揭示在底物分子过饱和的情况下,酶用量增加可以大大提高酶与底物的结合效率,从而加快底物转化为产物的反应速率。当酶量增加到一定值后,酶分子趋向饱和,曲线的上升趋缓,此时继续增大加酶量将对反应速率贡献不大。在加酶量达到2.5%之后,加酶量对酶解物的还原能力的影响不大,而水解度在加酶量达到1.0%之后变化不大。
从图5可以看出,酶解产物清除DPPH自由基的能力并不与水解度成线性关系,当[E]/[S]达到2.5%的时候,酶解产物表现出最高的清除DPPH自由基的活力。图4和图5的结果表明随着加酶量的增加,水解度和酶解物的抗氧化性都逐渐增加,但并不是简单的线性关系。综合考虑,[E]/[S]为2%~3%为适宜范围。
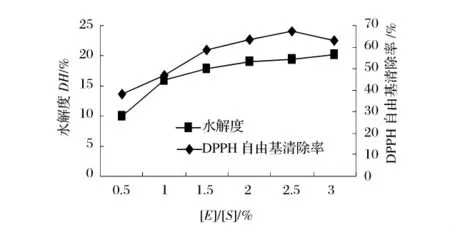
图5 [E]/[S]对水解度及DPPH自由基清除率的影响
2.1.4 温度对核桃蛋白水解度及抗氧化活性的影响
选用 Alcalase2.4L在 pH 值 9.0,[S]为 2%,[E]/[S]为2.5%的条件下水解2 h,研究温度对水解度和抗氧化活性的影响,结果分别见图6和图7。
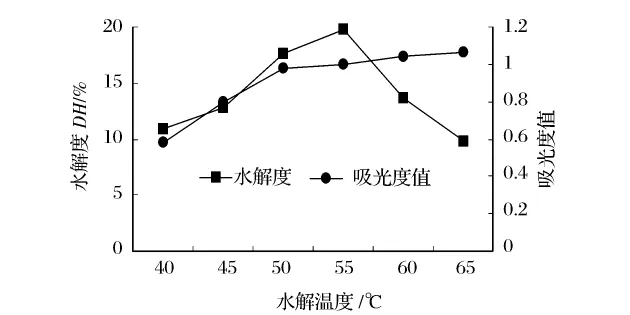
图6 温度对水解度及还原能力的影响
温度对酶催化反应的影响是多方面的,温度提高会影响酶的稳定性和底物转化为产物的速度,在一定范围内,温度的提高可加快反应速度使得水解度升高以及酶解物还原能力的增强[13]。由图6可知,在55℃时,酶解的水解度最大。当温度达60℃时,水解度反而呈下降趋势。这可能是因为温度升高,使得酶蛋白的结构发生改变,造成酶活性降低。随着温度的升高,酶解物的还原能力逐渐增强,50℃以后还原能力增长趋于缓慢。从图7可知,温度对酶解产物的活性的影响较大,在50℃时表现出最强的DPPH自由基清除能力,因此选择温度范围为45~55℃。从图6和图7也可进一步证实,水解度与酶解物的抗氧化活性并不成线性关系。

图7 温度对水解度及DPPH自由基清除率的影响
2.1.5 pH值对水解度及抗氧化活性的影响
选用 Alcalase2.4L 在[S]为 2%,[E]/[S]为2.5%,温度为50℃的条件下水解2h,研究pH值对水解度和抗氧化活性的影响,结果分别见图8和图9。
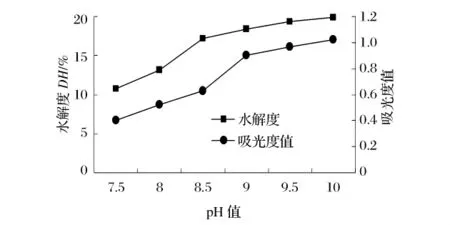
图8 pH值对水解度及还原能力的影响
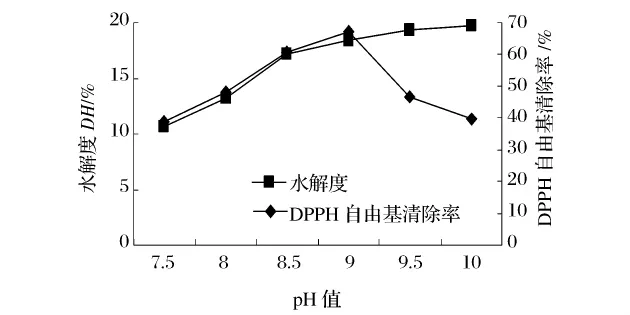
图9 pH值对水解度及DPPH自由基清除率的影响
pH值通过影响酶蛋白的构象和酶分子及底物分子的解离状态,从而影响酶的稳定性、酶与底物的结合以及酶催化底物转变为产物,进而影响酶的催化效果[13]。由图8可见,在 pH 值7.5~10,水解度和还原能力随pH值的增加而增加。由图9可知,当pH值为9时,酶解产物对DPPH自由基清除能力最强。当pH值为10时,虽然其水解度最大,却表现出最低的DPPH自由基清除能力,可能是由于过度水解将活性片断进一步切断。由此也可见,水解度与抗氧化活性并不表现为线性关系。因此,pH值8.5~9.5为适宜范围。
2.2 酶解工艺参数优化[14-15]
为了获得高活性的核桃抗氧化肽,在单因素试验的基础上,固定[S]为2%,酶解时间为2 h,以[E]/[S]、酶解温度及pH值3个因素为自变量(分别以X1,X2,X3表示),以DPPH自由基清除率为响应值设计了3因素3水平共15个实验点的响应面分析实验,15个实验点分为12个析因点和3个0点,每个试验因素水平选取如表1所示。

表1 三因素三水平响应面分析试验设计表
实验以随机次序进行,将实验所得的DPPH自由基清除率用Minitab15.0程序进行分析,并得出响应面分析图、回归拟合方程以及方差分析表。响应面实验设计与结果见表2。
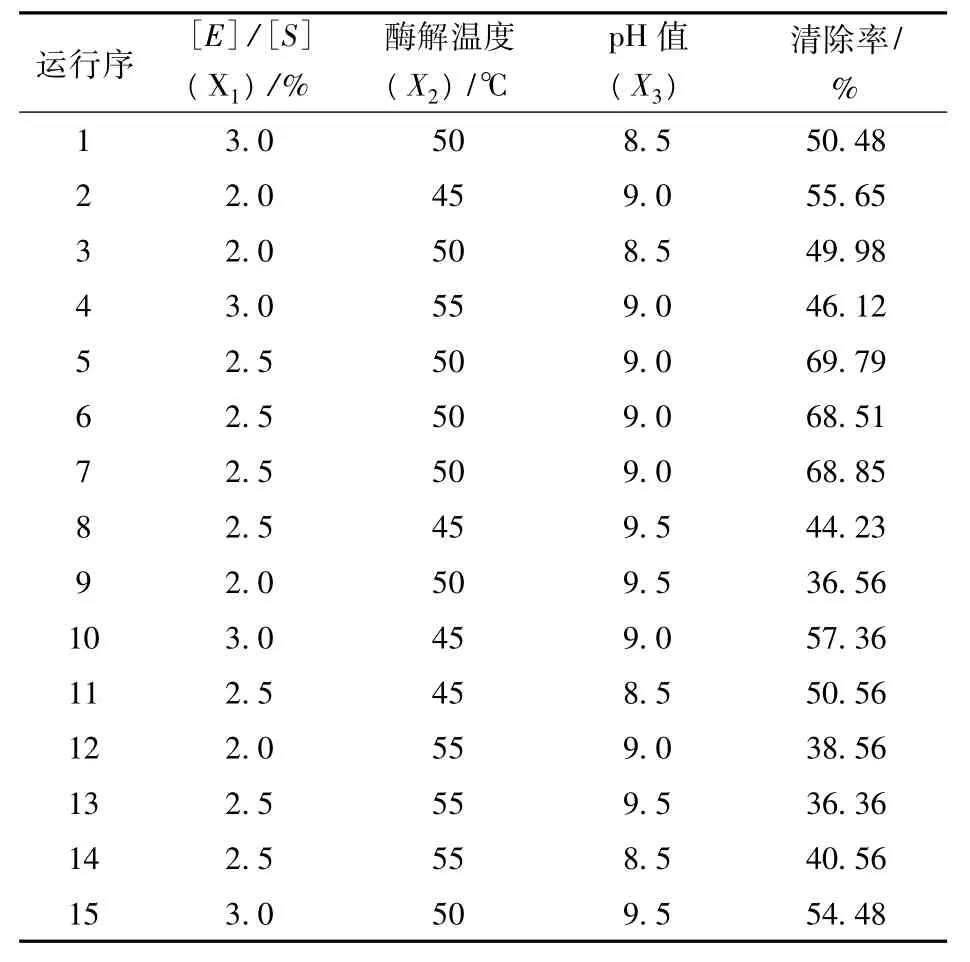
表2 核桃抗氧化肽酶解条件优化试验设计及结果
利用Minitab软件对实验数据进行分析,由表3得出拟合二次多项式方程为:
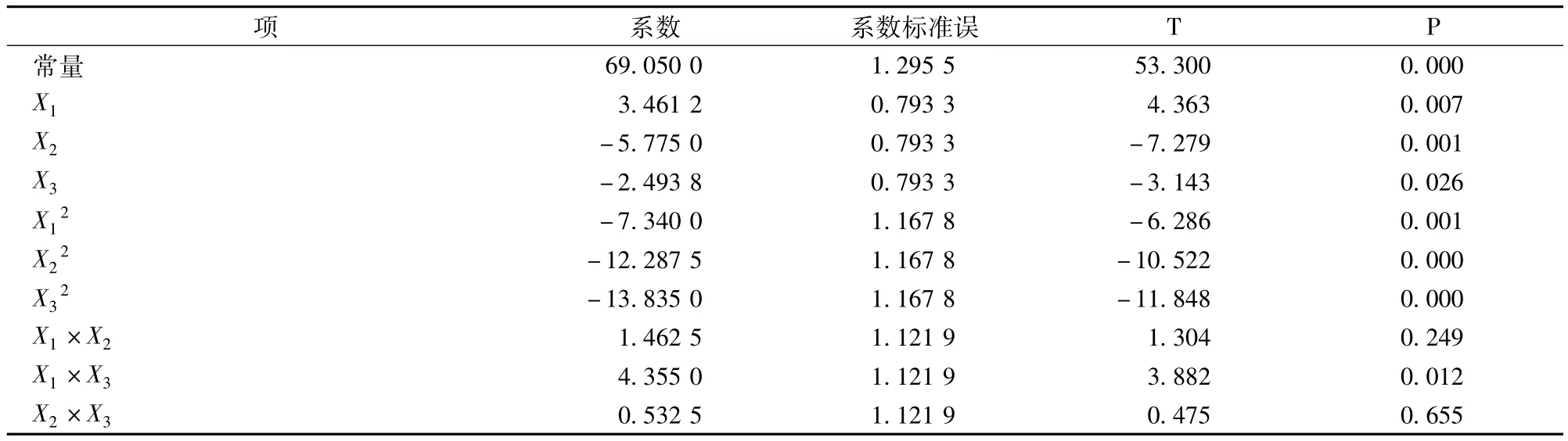
表3 三因素三水平中心组合参数估计

表4 方差分析
由表3知,对方程影响显著程度由大到小依次为酶解温度、[E]/[S]、pH,酶解温度和[E]/[S]对方程影响最显著,说明这二者直接关系到DPPH自由基的清除率,而pH值的影响在一定范围内并不是最显著,并且得知方程一次项、二次项的影响都是显著的,各因素之间不是简单的线性关系,而是二次关系。
由表4知模型的回归极显著,交互作用较显著,说明3因素之间存在相互影响;失拟项F检验不显著,表明用方程Y拟合3个参数与DPPH自由基清除率之间的关系是可行的;实验误差小,故可用回归方程代替实验真实点对实验结果进行分析。
同时做出中心组合设计试验所得的三组响应面曲面图(图10)。响应面图形是特定的响应值Y对应的因素X1、X2、X3构成的一个三维空间在二维平面上的等高图,可以直观地反映各因素的交互作用以及对响应值的影响。图中可看到拟合曲面有最大值,对拟合方程求偏导,可得出模型最大值,即为最优的试验方案。
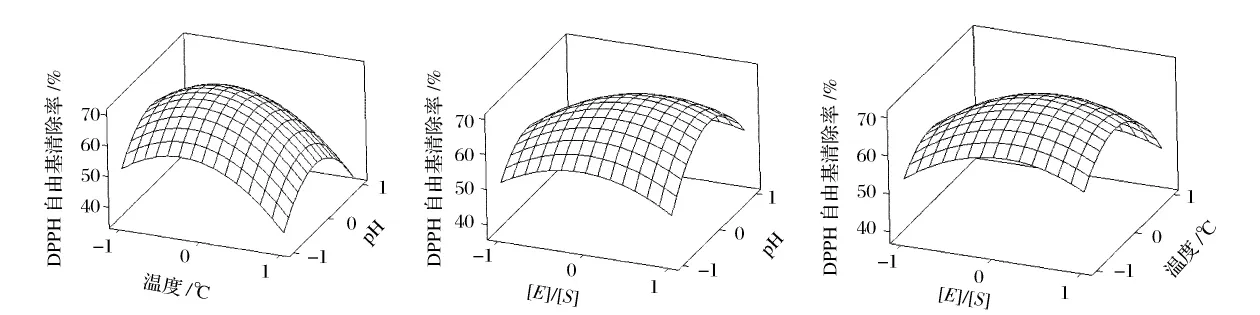
图10 因素交互作用对DPPH自由基清除率的响应面分析
为了进一步确证最佳点的值,利用上述分析进行最优工艺的推导,对回归方程取一阶偏导数为0,并整理得:
3.461 2-14.68X1+1.462 5X2+4.355X3=0
-5.775+1.462 5X1-24.575X2+0.532 5X3=0
-2.493 8+4.355X1+0.532 5X2-27.67X3=0
联立上述3个方程求解,得到X1=0.194 4,X2=-0.225 2,X3=-0.063 8。换算后得到最佳工艺条件是[E]/[S]为2.597 2%、酶解温度为 48.87 4℃、pH为8.968 1。由回归方程预测对DPPH自由基的理论清除率为70.11%。
2.3 验证实验
为检验响应面法所得结果的可靠性,采用上述优化条件再重复实验3次,考虑到实际操作的便利,将工艺参数修正为:[E]/[S]2.6%,酶解温度49℃,pH值9,在上述优化条件下实际对DPPH自由基的清除率为69.85%,与理论预测值相比,其相对误差约为0.37%,说明了回归方程的预测值与试验值之间具有较好的拟合度。
3 结论
(1)水解核桃蛋白的蛋白酶选用Alcalase2.4L碱性蛋白酶。
(2)核桃抗氧化肽的最佳酶解条件为:[S]2%、[E]/[S]2.6%、pH9、49℃、2h,在此条件下制备的核桃抗氧化肽对DPPH自由基的清除率达69.85%。
[1]崔莉,葛文光.核桃蛋白质功能性质的研究[J].食品科学,2 000(1):25-29.
[2]翟文俊.核桃油中脂肪酸的组成与含量测定[J].西北轻工业学院学报,1998(3):150-152.
[3]FAO/WHO Protein Quality Evaluation[M].Rome:Food and Agricuhura Organzation of the United nations,1990:66.
[4]Vezin H,Lamour E,Routier S,et al.Free radical production by hydroxy-salen manganese complexes studied by ESR and XANES[J].Journal of Inorganic Biochemistry,2002,92(3/4):177-182.
[5]Nakajima Y,Nakashima T,Inaba K,et al.Effects of nitric oxide on the redox status of liver microsomes-electron spin resonance monitoringusing nitroxide probes[J].Hepatology Research,2002,24(1):72-79.
[6]姜莉,徐怀德,何玉君,等.核桃渣中蛋白质的提取工艺及其功能性研究[J].食品科技,2007,32(4):237-240.
[7]程云辉,王璋,许时婴,等.酶解麦胚蛋白制备抗氧化肽的研究[J].食品科学,2006,27(6):147-151.
[8]Jens Aadler-Nissen.Enzymic Hydrolysis of Food Proteins[M].Elsevier Applied Science Publishers,1986.
[9]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthum on the autoxidation of soybean oil in cyclodextrin emulsion[J].Journal of Agricultural and Food Chemistry,1992,40:945-948.
[10]Oyaizu.Antioxidantive activities of browning reaction prepared from glucose amine[J].Japan Journal of Nutrition,1986,44:307-315.
[11]周徐慧,钱平,卢蓉蓉,等.酶法制备汉麻籽蛋白抗氧化肽[J].食品与发酵工业,2008,34(5):76-81.
[12]杜蕾蕾,郭涛,万辉,等.核桃蛋白的分离纯化及功能性质的研究[J].中国油脂,2009,34(5):21-24.
[13]王璋,许时婴.食品化学[M].北京:中国轻工业出版社,2002.
[14]李钊,王娜妮,陈栓虎.响应面优化法研究花椒籽油在近临界水中的水解[J].中国油脂,2009,34(5):28-31.
[15]孟岳成,张学,兵邱蓉.响应曲面法优化大豆多糖微波提取工艺[J].食品研究与开发,2009,30(2):28-31.
Optimization of the Preparation of Antioxidative Peptide from Walnut Protein with Enzymolysis Technology
Kang Wei-li,Tang Jun-hu,Jing Si-qun
(College of Life Sciences & Technology,Xinjiang University,Urumqi 830046,China)
Single-factor experiments and response surface analysis were adopted to study the effect of[E]/[S],pH value and enzymolysis temperature on preparation of antioxidant peptide,with the DPPH radical scavenging rate as the response value.According to the above results,the optimum enzymatic hydrolysis conditions for preparation of antioxidant peptides from Walnut protein using alkaline protease enzyme was obtained as follows:[E]/[S]2.6%,pH 9,enzymolysis temperature 49℃,[S]2%,enzymolysis time 2h.Under these conditions,the scavenging rate of DPPH radical is up to 69.85%.
walnut protein,antioxidant peptide,enzymatic hydrolysis,response surface methodology(RSM),optimization
硕士研究生(敬思群为通讯作者)。
*新疆维吾尔自治区科技人员服务企业行动项目资助(No.2009GJG40043)
2010-07-23,改回日期:2010-09-16
