黑曲霉固态发酵菊芋粉产菊粉酶的工艺条件优化研究
2010-11-02王丽威郑彦山陈科伟宋秀洁
王丽威,郑彦山,陈科伟,宋秀洁
(辽宁工程技术大学理学院,辽宁阜新123000)
黑曲霉固态发酵菊芋粉产菊粉酶的工艺条件优化研究
王丽威,郑彦山,陈科伟,宋秀洁
(辽宁工程技术大学理学院,辽宁阜新123000)
为提高菊粉酶活力,降低成本,研究了黑曲霉固态发酵菊芋粉产菊粉酶的发酵工艺,实验结果表明,初始pH、发酵时间和发酵温度对菊粉酶活力的影响均显著,优化后的发酵工艺参数麸皮28%,菊芋粉12%,(NH4)H2PO40.5%,玉米浆1%,按固液比4∶6加水,初始pH为7.0,接种量3%,35℃培养6d,所得的菊粉酶活力最高,达158U/g,为菊粉酶的工业化生产提供了技术参考。
菊粉,菊粉酶,黑曲霉,菊芋,固态发酵
1.1 实验材料
黑曲霉(Aspergillus niger)A4 分离于菊芋块茎周围土壤,经EMS化学诱变和紫外诱变,察氏斜面培养基,4℃冰箱中保藏,实验时将保存的菌种接种于斜面活化培养基,于30℃恒温培养3d,如此连续活化3次。用活化的菌种制作孢子悬液,接种于种子培养基,30℃培养6d,制成孢子浓度约为2×109cfu/mL的种子液,作为发酵用菌种;酶反应底物的配制3.00%菊糖溶液:称取菊糖(sigma公司)3.0g溶于80mL醋酸-醋酸钠缓冲液(0.05mol/L、pH4.5),置于磁力搅拌器上加热溶解,冷却搅拌过夜,用缓冲液定容至100mL,4℃贮存备用(不超过7d);3.00%蔗糖溶液:配制方法同 3.00%菊糖溶液;DNS(3,5 Dinitrosalicylic Acid)试剂 参考文献[9]进行配制和使用;粗酶液的制备 发酵结束后,按培养基∶水= 1∶8(m/v)的比例加入去离子水,在涡旋混合器振荡30min,10℃下5000r/min离心10min,取上清,制成粗酶液,4℃保存;菊芋 产于阜新农业园区实验田,3月下旬采收,去皮,切成约2mm厚的薄片,于80℃烘干磨粉,过40目筛,保藏备用,经测定,菊糖含量为51.2%;斜面活化培养基 察氏培养基;种子培养基 麸皮与水质量比1∶1混合,拌匀,以10g/瓶分装于250mL锥形瓶中,121℃,灭菌20min;发酵培养基麸皮和菊芋粉占40%,按固液比4∶6加水,其它按实验设计添加。
1.2 培养方法
1.2.1 菌种的活化和种子培养方法 将黑曲霉菌种接种于斜面活化培养基中,置于30℃的恒温培养箱中,培养至孢子长满斜面(约3~4d),再次转接,如此连续活化培养3次。将活化好的菌种转接于斜面培养基上,置于30℃的恒温培养箱中,培养3d,加入无菌水和已灭菌的玻璃珠,在涡旋混合器上充分振荡,制成孢子悬液,用血球计数板在显微镜下计数,调整孢子浓度为7.0×107个/mL。吸取1mL孢子悬液接种于10g种子培养基中,置于30℃恒温培养箱中培养,每天摇曲一次,防止培养基板结粘连。待种子培养基上布满孢子(约6d)时,表示种子已经生长成熟。再按上述操作方法,制成孢子悬液,用作种子液。
1.2.2 发酵培养 将配制好的发酵培养基按10g/瓶(以湿重计)分装于250mL锥形瓶中,110℃灭菌20min后冷却,按实验设计的比例接种一定量的种子液,摇匀,置于30℃培养箱中静止培养,每天摇曲一次。发酵的前2d按1mL/10g补加无菌水。
1.3 菊粉酶活力的测定[3]
3,5-二硝基水杨酸(DNS)比色法:将粗酶液适当稀释(使其在水解曲线的线性范围内)后取0.2mL,加入2mL 3%底物,55℃恒温水浴中反应10min灭活。然后加入1.5mL 3,5-二硝基水杨酸试剂,沸水浴反应5min,取出后立即放入盛有冷水的烧杯中冷却,再用去离子水定量至25mL,混匀,测定540nm下吸光度值OD540。在相同条件下,以加入失活的酶液作对照。通过果糖标准曲线y=4.9814x-0.0062求得还原糖含量。菊粉酶活力定义为:以菊粉为底物,每分钟转化生成1!mol还原糖所需的酶量为一个酶活力单位(U)。
1.4 实验设计与数据处理
1.4.1 单因素实验设计 实验以菊芋粉和麸皮为基本原料,研究了碳源、氮源、接种量、发酵温度、初始pH、发酵时间对黑曲霉产菊粉酶的影响。每个处理重复3次,取平均值。
1.4.2 正交实验设计 根据单因素实验结果,采用3因素3水平正交实验设计,考察了初始pH、发酵时间、发酵温度对黑曲霉产菊粉酶的影响。采用DPS数据处理软件对数据进行分析。
2 结果与讨论
2.1 单因素实验结果
2.1.1 麸皮与菊芋粉添加比例对黑曲霉产菊粉酶活力的影响 发酵过程中,菊糖起到产酶底物的作用。有研究结果表明,菊粉酶的产生具有一定的诱导性,但同时也受阻遏效应的影响[2,5,8]。麸皮作为一种天然物质,不但能为黑曲霉发酵提供碳源和能源及其它营养因子,还起到载体的作用。因此,二者的比例对菊粉酶活力具有重要影响。由于实验采用的菊芋粉中含有51.2%的菊糖,而一般液态发酵菊粉酶菊糖含量在2%~8%之间,因此实验中考虑到固态发酵原料转化率问题,将发酵培养基中麸皮和菊芋粉总量设置为40%,麸皮与菊芋粉比例分别设置为24∶16、28∶12、32∶8、36∶4,其它条件为:硫酸铵1%,pH6.5,接种量3%,30℃恒温箱中培养6d。所得结果如图1。

图1 麸皮与菊芋粉添加比例对菊粉酶活力的影响
由图1可知,随着菊芋粉在总固体基质中所占比例增加,菊粉酶活力呈现先增加后降低的趋势,当麸皮与菊芋粉比例为28∶12时,即麸皮添加量为28%,菊芋粉添加量为12%时,即菊糖含量6%左右,菊粉酶活力最高。
2.1.2 氮源对黑曲霉产菊粉酶活力的影响 大量的研究结果表明,培养基中的氮源对产酶影响很大。研究以麸皮和菊芋粉为基础培养基(麸皮28%,菊芋粉12%,pH为6.5),添加不同氮源,按3%接种量接种,于30℃恒温箱中培养6d,测定菊粉酶活力,结果如表1。由表1可以看出,有机氮比无机氮更利于产酶,复合氮源比单个有机或无机氮作用强。这是因为无机氮属快速氮源,发酵初期菌体能快速吸收利用无机氮进行大量生长繁殖,而蛋白质类有机氮经过菌体蛋白酶分解后产生的多肽、氨基酸又可直接被吸收利用,利于菌体生长和酶合成。
2.1.3 发酵时间对黑曲霉产菊粉酶的影响 发酵过程中,随着菌体的生长繁殖,酶活力也发生相应的变化。发酵培养基为麸皮 28%,菊芋粉 12%,(NH4)H2PO40.5%,玉米浆 1%,pH6.5,灭菌后,按3%接种量接种,置于30℃恒温培养箱中培养8d,每隔1d测定菊粉酶活力,结果如图2。由图2可知,随着发酵时间的延长,菊粉酶活力呈现先增加后减小的趋势,当培养时间为6d时,菊粉酶活力达到最高。6d后菊粉酶活力开始下降,可能是由于黑曲霉产酶代谢过程中产生一些代谢产物,特别是一些酸类物质,使得体系酸度升高,菌体开始衰老。
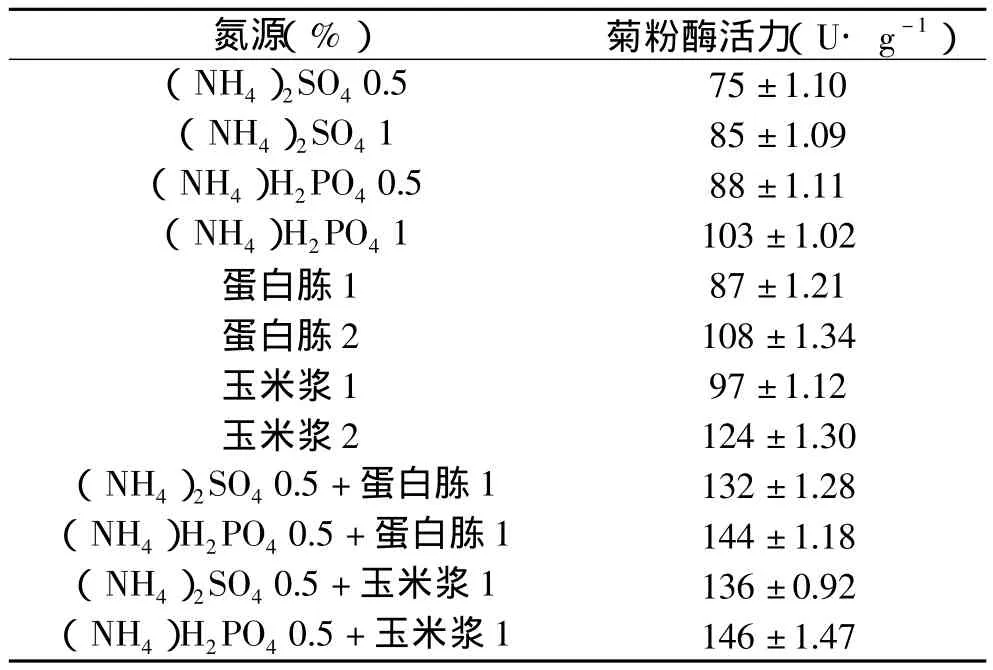
表1 不同氮源对菊粉酶活力的影响
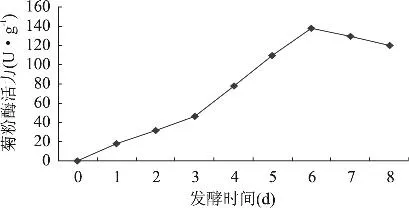
图2 不同发酵时间对菊粉酶活力的影响
2.1.4 初始pH对黑曲霉产菊粉酶活力的影响 发酵培养基为麸皮28%,菊芋粉12%,(NH4)H2PO40.5%,玉米浆1%,调节pH,灭菌后,按3%接种量接种,置于30℃恒温培养箱中培养6d,测定菊粉酶活力,结果如图3。随着pH的提高,菊粉酶活力逐渐增强,当初始pH为6.5时达到最高。这表明偏酸性的条件利于黑曲霉产菊粉酶。实验中发现,发酵过程中基质的酸度发生了较大的变化,发酵3d后pH甚至降到3.0,这非常不利于产酶,应在培养基中添加缓冲盐类或碳酸钙来维持一定的酸度。
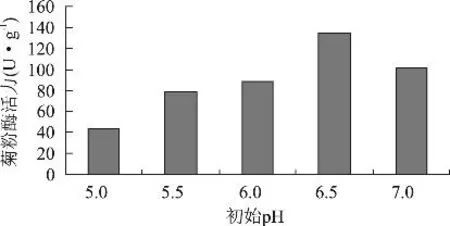
图3 不同初始pH对菊粉酶活力的影响
2.1.5 发酵温度对黑曲霉产菊粉酶活力的影响 发酵培养基为麸皮28%,菊芋粉12%,(NH4)H2PO40.5%,玉米浆1%,pH为6.5,按3%接种量接种,分别置于不同温度下培养6d,测定菊粉酶活力,结果如图4。由图4可见,35℃时菊粉酶活力最高,这说明黑曲霉固体发酵菊粉需要在较高温度下进行。这可能是由于固体发酵基质含水量低,需要在较高的温度下才能维持一定的传质效率,进而促进酶的合成。

图4 发酵温度对菊粉酶活力的影响
2.1.6 接种量对黑曲霉产菊粉酶的影响 发酵培养基与2.1.5中所用的相同,分别按不同接种量接种,于35℃恒温箱中培养6d,测定菊粉酶活力,结果如图5。由图5可以看出,随着接种量的增加,菊粉酶活力逐渐提高,当接种量为3%时达到最高,但当接种量继续增加时,菊粉酶活力反而降低。这是因为接种量较小时,菌体繁殖量少,酶的产量也少;当接种量过大时,菌体繁殖速度过快,大量分解菊糖,产生较多的降解物造成分解代谢阻遏,产酶量减少。

图5 不同接种量对菊粉酶活力的影响
2.2 正交优化实验结果
发酵培养基成分与2.1.5中所用的相同,选取初始pH、发酵时间、发酵温度作为发酵工艺条件正交实验的3个因素,结果如表2和表3。

表2 发酵工艺条件正交实验结果L9(34)
由极差、方差分析可以看出,初始pH(A)、发酵时间(B)和发酵温度(C)三个因素对黑曲霉产菊粉酶活力的影响均显著,其影响主次顺序为B>A>C,发酵工艺参数优水平组合为B2A3C3,即初始pH为7.0,发酵时间为6d,培养温度为35℃。由于该组合在正交实验中没有出现,因此需进行验证实验,其结果表明,采用该工艺条件发酵菊粉酶活力达158U/g。
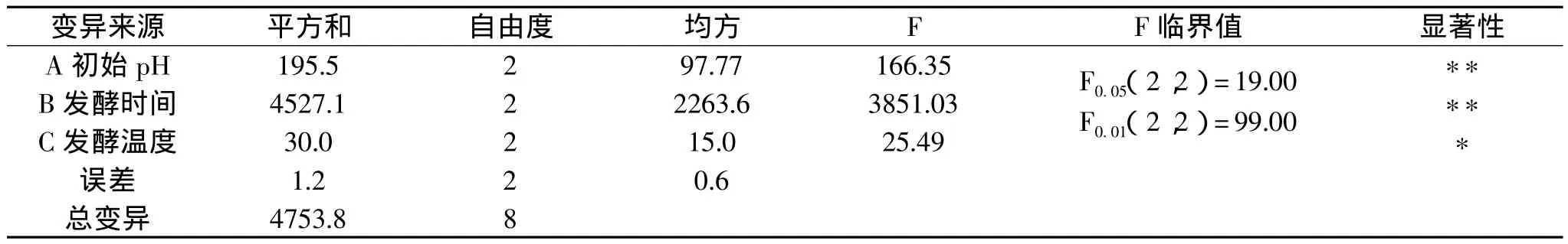
表3 方差分析表
3 结论
以菊芋粉、麸皮为主要基料,采用正交实验设计得到了黑曲霉Aspergillus niger A4固态发酵菊粉酶的最佳条件:麸皮28%,菊芋粉12%,(NH4)H2PO40.5%,玉米浆1%,按固液比4∶6加水,初始pH为7.0,按3%接种,35℃,培养6d,所得菊粉酶活力最高,达158U/g。实验采用菊芋粉为主要原料,既节约了菊糖提取带来的成本,又充分发挥了菊芋中碳源、氮源、维生素、矿物质等营养成分作用,得到了菊粉酶活力较高培养方法,为菊粉酶的工业化生产提供了一条有效途径。
[1]郑文竹,姚炳新,魏文铃,等.从菊芋制备菊粉精液的方法和菊芋干片成分分析[J].厦门大学学报:自然科学版,1996,35(1):112-115.
[2]王建华.微生物菊粉酶基因结构、酶学性质与应用研究进展[J].天然产物研究与开发,2000,13(1):183-189.
[3]Shuichi O,Norio S.Purification and substrate specificity of endo-type inulinase from penicillium purpurogenum[J]. Agricultural and Biological Chemistry,1988,52(10):2569-2576.
[4]Kim K Y,Kang S I,Kim S I.Production of a novel endoinulinase from Arthrobacter sp.S37[J].Agricultural Chemistry and Biotechnology,1996,39(2):99-103.
[5]Dong H K,Yong J C,Seung k S,et al.Production of inulooligosaccharides using endo-inulinase from a Pseudomonas sp.[J].Biotechnology Letters,1997,19(4):369-371.
[6]Park J P,Bae J P,You D J,et al.Production of inulooligosaccharides form inulin by a novelendoinulinase from Xanthomonas sp.[J].Biotechnology Letters,1999,21:1043-1046.
[7]张国青,崔福绵,杨秀清,等.毛壳霉内切菊粉酶的纯化与性质[J].微生物学报,2004,44(6):785-788.
[8]Gao W,Bao Y,Liu Y,et al.Characterization of thermo-stable endoinulinase from a new strain Bacillus smithii T7.[J]Applied Biochemistry and Biotechnology,2009,157(3):498-506.
[9]俞建英,蒋宇,王善利.生物化学实验指导[M].北京:化学工业出版社,2005.
Optimization of solid-state fermentation conditions with Jerusalem artichoke powder for production of inulinase by Aspergillus niger
WANG Li-wei,ZHENG Yan-shan,CHEN Ke-wei,SONG Xiu-jie
(College of Science,Liaoning Technology University,Fuxin 123000,China)
To obtain inulinase with high activity and low cost,optimization of medium composition and fermentation conditions for the production of inulinase by Aspergillus niger A4 was investigated in solid-state fermentation using orthogonal experimental designs.The results showed that with solid-state fermentation method,when the fermentation temperature was 35℃,wheat bran 28%,Jerusalem artichoke powder 12%,the initial pH7.0,inoculum 3%,(NH4)H2PO40.5%,corn steep 1%,fermentation time 6d,the enzyme activity was up to 158U/g solid medium,which was much higher than that reported in the literature using liquid fermentation.
inulin;inulinase;Aspergillus niger;Jerusalem artichoke;solid-state fermentation
TS201.3
A
1002-0306(2010)12-0202-04
菊芋,学名 Jerusalem artichoke(Helianthus tubeuosus),为菊科向日葵属多年生草本植物,地下形成块茎。由于菊芋具有耐旱、耐寒、繁殖力强、易于栽培等特点,使其分布很广。近年来,许多地方将其种植在沙地、荒坡、海滩等贫瘠的土地上,用于防风固沙、保持水土和改良土壤。据测定菊芋干片中含菊粉54.07%,蛋白质8.86%,脂肪1.45%,粗纤维3.56%,灰分3.6%,水分8.39%[1]。菊芋块茎中的菊粉(又称菊糖,inulin)是继淀粉之后的“第二代糖源”。其化学本质是以β-2,1-糖苷键连接的果糖多聚物,聚合度(DP)一般为2~60。菊粉酶(Inulinase,E.C.3.2.1.7),是一种菊糖水解酶,按照其作用的方式分为外切菊粉酶(Exo-inulinase)和内切菊粉酶(Endo-inulinase)。研究发现,能产生菊粉酶的微生物包括曲霉属、青霉属、克鲁维酵母属、假丝酵母属、杆菌属、镰孢属、踝节菌属、毕赤酵母属、Chrysosporium属、节杆菌、假单胞菌、黄假单胞菌、娄彻氏链霉菌、隐球酵母菌、毛壳霉[2-8]等的微生物,其中以曲霉属及青霉属微生物所产酶的活力为最高,黑曲霉(Aspergillius niger)作为工业酶制剂生产的传统经典菌种,得到了许多研究者的重视。菊粉经过降解可以生产果糖和低聚果糖,作为食用或饲用添加剂,也可以通过进一步发酵生产酒精、有机酸等产品。从九十年代开始,国内有一些单位进行了菊粉酶的研究,主要采用液态发酵法。在国外,诺维信(Novozyme)公司率先开发出Fructozyme,具有内切酶和外切酶活性,可用来水解菊粉,但是价格较高。比利时的Ofrati公司采用内切菊粉酶降解来源于菊苣的菊粉生产低聚果糖。由于固态发酵具有节能、节水、环保等优越性,因此在酶制剂、酒精、有机酸等领域得到了广泛应用。本研究对黑曲霉固态发酵菊芋粉生产菊粉酶的发酵工艺参数进行优化,为菊粉酶的工业化生产提供技术基础。
1 材料与方法
2009-11-10
王丽威(1977-),女,硕士,讲师,研究方向:食品生物技术。
校级青年基金(07A138)。
