先天性心脏病体外循环术后110例心肺脑复苏的研究
2010-11-02张燕搏刘晋萍李守军
张燕搏,王 旭,龙 村,刘晋萍,李守军,闫 军
先天性心脏病(先心病)患儿在体外循环(cardiopulmonary bypass,CPB)下行心脏手术后,由于基础疾病及手术方式的特殊性,心跳呼吸骤停(cardio-respiratory arrest,CRA)的发生率较高,且发生急骤,复苏困难[1]。如何及时发现 CRA、尽早明确诱因并进行符合患儿特点的有效心肺脑复苏(cardiopulmonary cerebral resuscitation,CPCR),从而提高患儿近远期存活率,是重症监护病房(ICU)工作的重点和难点。本文回顾研究我中心近 5年CPB术后在儿童 ICU(PICU)中发生的 CRA 110例,分析诱因、探讨有效的复苏方法、总结成功经验,以期为进一步提高心脏术后 CRA患儿的复苏成功率提供依据。
1 资料与方法
1.1 一般资料 2005年1月至 2009年12月,阜外心血管病医院小儿心脏中心共有 110名患儿在 CPB术后发生 CRA并在 PICU中接受 CPCR。其中男 71例、女 39例,年龄 0.5个月~12岁 (19±4)个月,体重 2.8~23(9.1±19.1)kg。CPB时间 80~255(142±54)min,心肌血运阻断时间 20~153(81±39)min。CRA发生时机械通气 59例,非机械通气51例。病种及手术方法见下表1。

表1 患儿病种分布及手术方式
1.2 判断标准[2]
1.2.1 CRA的判断标准 突发经皮血氧饱和度下降,心电图呈室颤、心电-机械分离(Pulseless Electronic Activity,PEA)、心脏停搏、严重心动过缓之一且伴有血压明显下降,需给予正压通气、胸外心脏按压和复苏药物者。仅予通气及药物而未实施心外按压者除外。
1.2.2 CPCR初步成功的标志 自主心搏恢复或可被正常起搏、动脉监测出现较正常波形或可触及大动脉脉搏,且自主循环恢复(Restoration of Spontaneous Circulation,ROSC)时间≥20min。
1.3 CPCR方法 依据美国心脏学会(AHA)和欧洲复苏学会(ERC)2005年儿童基础生命支持(Pediatric basic life support,PBLS)和高级生命支持(Pediatric advanced life support,PALS)指导纲要及心血管急救指南进行 CPCR[3],同时尽快明确诱因。
1.3.1 复苏具体步骤 ①按照 ABC或 CAB顺序,清理呼吸道和/或气管插管、纯氧面罩加压或经气管插管皮球加压给氧。双人配合按压/通气比 15:2、2 100~120次/Min不间断胸外心脏按压。②PEA、心脏停搏、严重心动过缓立即使用临时心脏起搏器和静脉推注阿托品。室颤以起始能量 2 J/(kg·次)非同步直流电击除颤,1 J/(kg·次)逐步加量,细颤经静推肾上腺素转为粗颤后再除颤。③按标准剂量即 0.01~0.02 mg/(kg·次),以“弹丸式”经中心静脉推注肾上腺素,间隔 1~2min加量重复。心搏停止≥10min且呼吸状态改善后予碳酸氢钠纠酸。④积极纠正低钙、低血糖及室性心律失常。⑤CPCR开始同时即予冰帽头部降温、适度全身降温,保持肛温在33~35℃,头温 32~34℃,昏迷者至少要保持 12~24 h。
1.3.2 复苏后药物治疗 ①静脉予多巴胺、多巴酚丁胺、肾上腺素、垂体加压素等正性肌力药和心肌营养药。②根据诱因进行纠正电解质紊乱、抗心律失常、补充血容量等治疗。③应用肾上腺皮质激素及胃肠黏膜保护剂减少应激对机体的损伤。④开始复苏至 ROSC≥5min者常规予脱水降颅压治疗。
1.3.3 床旁开胸指征 ①高度怀疑心包填塞或严重胸腔积液。②常规复苏≥10 min、ROSC可建立但难以维持。③需进行床旁 CPB或体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)治疗。④ROSC无法建立但家属要求。
1.3.4 ECMO指征[4]常规复苏≥20min、ROSC无法建立或难以维持,经相关专业小组讨论确定患儿具有可逆性呼吸或循环功能衰竭指征后行 ECMO治疗。
1.4 统计方法 所用统计软件为 SPSS 10.0,以卡方检验(χ2)分析各相关因素对初步复苏成功率的影响,以 P<0.05为差异有显著性。
2 结 果
2.1 复苏成功率 全组患儿均在 CRA发生后 3 min内开始进行 CPCR,初步复苏成功 57例(51.8%),其中 45例治愈出院(40.9%),死亡 65例(总死亡率 59.1%)。床旁开胸 29例,其中 6例治愈出院(包括 ECMO 4例、大量心包积液、胸腔积液各 1例)。床旁 CPB 5例,全部死亡。 ECMO 12例,其中7例顺利撤机(58.3%),4例治愈出院(33.3%)。
2.2 引起 CRA的主要原因 由各种原因导致的低氧血症是本组病例 CRA的首要诱因,共 49例(44.5%),其他诱因依次为:室颤 26例(23.6%)、PEA 20例(18.2%)、心跳停搏 11例 (10%)、心包积液 2例、胸腔积液 2例。
2.3 各相关因素对初步复苏成功率的影响 本研究 110例患儿的相关临床资料见表2。分析患儿的一般情况,性别对初步复苏成功率的影响差异无显著性(χ2=2.82,P>0.05),年龄、体重对初步复苏成功率的影响差异无显著性(χ2=0.06,P>0.05、χ2=0.09,P>0.05)。分析 CRA时患儿的呼吸状态,是否机械通气对初步复苏成功率的影响差异无显著性(χ2=0.86,P>0.05)。分析 CRA的诱因,是否为循环因素对初步复苏成功率的影响差异有显著性(χ2=4.55,P<0.05)。见表2。
3 讨 论
3.1 掌握 CPB后儿童 CRA的特点、及早明确诱因是保证复苏成功的基础 “早期识别、早期心肺复苏、早期除颤、早期进行高级生命支持”是保持“生存链”的关键。从复苏学角度看,小儿年龄划分为 4个阶段:1个月以内为新生儿、1岁以内为婴儿、1~8岁为儿童,8岁以上等同成人,各阶段的发病特点及复苏方法不尽相同。与成人常以室颤为主要表现不同,呼吸因素常是儿童 CRA的主要诱因,这可能与其生理特点及病种分布有关[5-6]。从本组资料看,各种原因引起的低氧血症同样也是先心病 CPB术后 CRA的主要诱因。这除与儿童自身特点有关,还与先心病患儿常合并呼吸功能发育不全及 CPB对不成熟肺脏和呼吸中枢造成的打击等因素有关,这就提示临床医生在寻找此类患儿 CRA的诱因时不应仅限于考虑心脏问题,在发现 CRA后,呼吸支持和心外按压同等重要。但是,统计结果显示,先心病术后患儿发生 CRA时是否在进行机械通气对 ROSC的建立无显著影响,这说明机械通气本身并不能提高初步复苏的成功率,此类患儿在复苏时是否需要气管插管应视情况而定,气囊面罩加压给氧则是ICU医护人员都必须熟练掌握的技能。另一方面,统计结果也显示,先心病术后由循环因素诱发的CRA初步复苏的成功率较低,这与本研究中患儿的基础疾病及手术特点有关。本组中室颤发生率为23.6%,虽与成人 80%~90%的发生率有较大差别,但此结果仍高于一般的儿科中心[5-6],因此,一旦明确室颤,必须尽快除颤。
3.2 正确的方法和训练有素的团队是复苏成功的关键 大量研究和观察证实 CPCR开始的时间越早复苏效果越好[7],本组病例全部在 CRA发生后 3min内开始进行 CPCR,初步复苏成功率达 51.8%,高于综合 PICU(10%~30%),也高于其他心脏中心的PICU(40%左右)[1]。这与我科复苏团队的训练有素、复苏设备的配套完善、CRA的发现与 CPCR的实施几乎同时进行密切相关。国外研究也证实,复苏团队的成熟度与复苏成功率明显相关[8]。
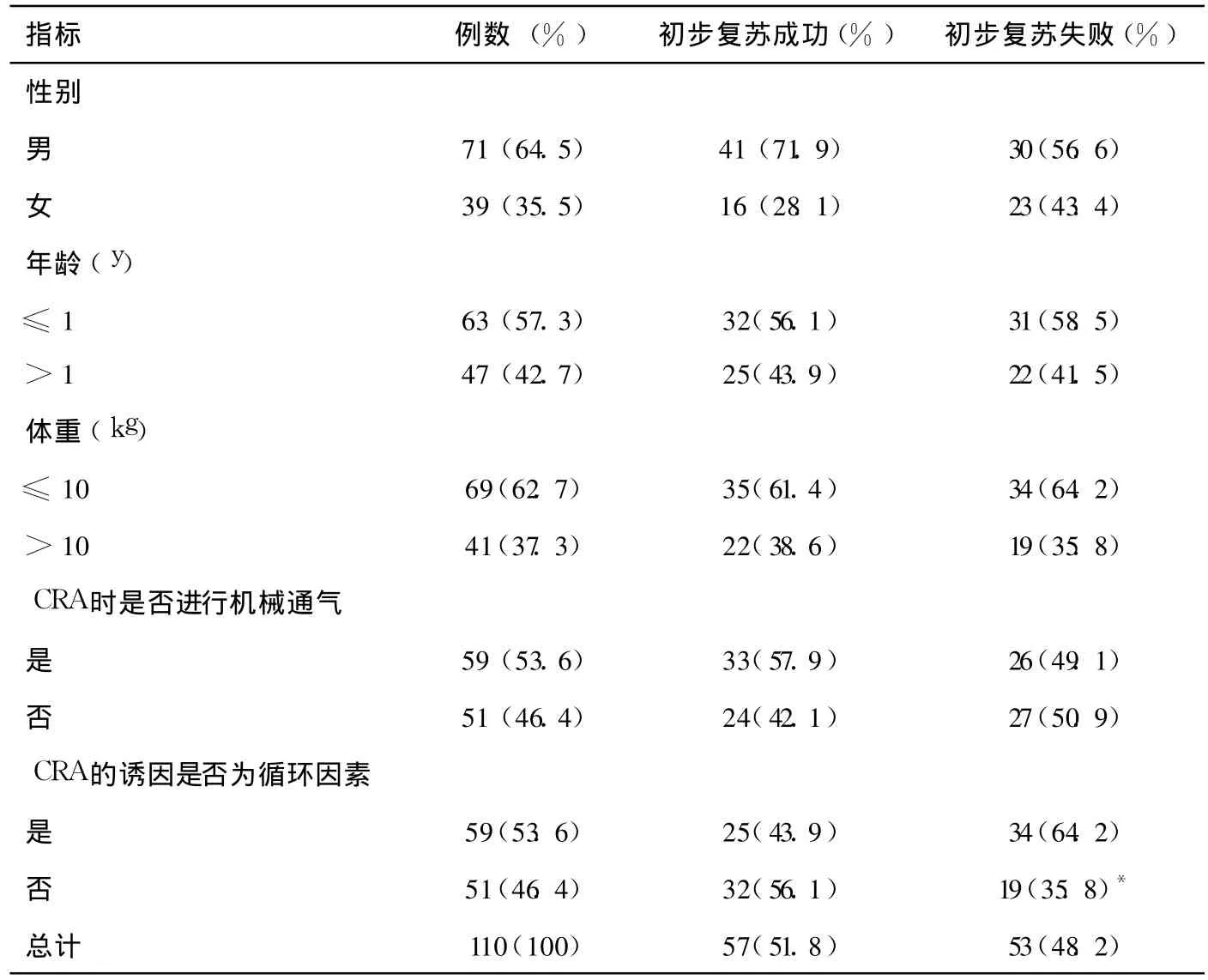
表2 患儿相关临床资料分析
近年来,随着 CPB手术指征的放宽,低龄、低体重儿的比例在逐步提高,但比较不同年龄段(≤1岁 />1岁)及不同体重(≤10 kg/>10 kg)患儿与初步复苏成功率的关系,发现低龄及低体重对初步复苏成功率的影响并不显著,这说明,针对不同阶段患儿采取与之相应的复苏方法均可取得较好的效果。
关于复苏的基本顺序是 ABC还是 CAB的争论一直存在,我们认为,对于儿童,发现 CRA后,立即行呼吸支持必须与心外按压同时进行,且应加压给予 100%浓度的纯氧。因为即使是心脏因素导致的CRA,组织在低氧状态下因无氧酵解增加造成的代谢性酸中毒也会严重影响心跳和循环的恢复。
关于一线复苏药物肾上腺素是使用常规剂量还是大剂量,也一直是 ICU界讨论的焦点。我们根据AHA和 ERC 2005版指南,全部经中心静脉“弹丸式”给予常规剂量,即 0.01~0.02mg/(kg·次)的肾上腺素取得了满意的效果。虽然有报道认为[9],按 0.1~0.2mg/(kg·次)给予大剂量肾上腺素有利于提高冠脉灌注压及 ROSC的建立,但大剂量肾上腺素强烈的血管收缩作用及对血压心率的急剧增高将使机体重要脏器经受剧烈打击。随着 CPB技术的日臻完善,对于常规剂量肾上腺素难以恢复或维持ROSC的患儿,我们主张更积极的进行 ECMO治疗[10]。在 2000版的指南中血管加压素已作为一线用药应用于室颤和无脉搏性室速。此药的特点是可通过血管加压素 I受体直接增加外周血管收缩,增加重要脏器血流,同时释放一氧化氮(NO)扩张脑血管、增加冠脉灌注压。有学者指出[11],血管加压素较肾上腺素有更好的缩血管作用、持续时间更长,且不增加心肌耗氧和乳酸的产生;体内较低水平的血管加压素浓度可能是复苏失败的主要原因,因此建议以血管加压素替代肾上腺素或两者同时使用。但是作为一种相对较新的复苏药物,我们主张在肾上腺素单独使用无效时再考虑使用血管加压素,对于外周血管张力极低(如严重的感染中毒性休克)及消化道大出血等病例,应用指征可以放宽。
3.3 脑复苏是决定复苏最终成功的重要因素 脑保护是高级生命支持的重点,神经系统的恢复也是评估复苏最终成功的标志,因此,早在 1985年第四届全美复苏会议上就已将心肺复苏(CPR)的概念更换为心肺脑复苏(CPCR)。心脏停搏后,脑缺氧 4~6 min即出现不可逆损伤,12~48 h脑水肿达到高峰并持续 3~7 d,因此脑复苏必须与心肺复苏同步进行。恢复神经元细胞功能的两个重点是保证脑血流灌注和降低脑温度[12]。标准的心肺复苏应达到正常心输出量的30%,同时保证足够的氧分压及合适的二氧化碳分压,但由于复苏过程的复杂性,临床实际操作中一般很难达到上述标准,这就要求尽早实施头部降温、以降低脑代谢,避免不可逆的脑损伤。本组病例全部在复苏初期即使用冰帽进行降温,保持头温 32~34℃,并配以冰袋全身降温,初步复苏成功者未发生严重神经系统并发症。儿童脑的重量占体重比例较成人大,且能量储备少、对缺血缺氧敏感,因此,初步复苏成功后必须继续给予儿茶酚胺类药物以保证足够的脑灌注,同时应用肾上腺皮质激素以加强溶酶体膜稳定性、保持血脑屏障的完整性、改善毛细血管的通透性,最终达到减轻脑水肿、稳定颅内压的目的。
目前关于脑复苏的研究尚不完善,许多观点还处于争议中,如关于低温疗法、亚低温疗法的意义和安全性讨论、幼体在复苏时脑灌注较成体究竟是更少还是更多等[13],但高温肯定对复苏中的机体及脏器保护不利,故头部降温必须尽早进行。
3.4 ECMO对提高复苏成功率作用重大 动物实验证实[14],CPB可以明显改善复苏时受损的心肺功能,如果在 CRA发生后 15~20min建立起 CPB,24 h存活率可提升至 90%。但临床观察却发现,床旁CPB患者往往难以撤机[15],我们的结论与此一致(本组有 5例患儿行床旁 CPB,全部因无法撤机死亡)。有人提出在手术室中建立的体外循环可能有较好的预后,我们在此方面经验不多,尚待研究。
近年来,ECMO已被广泛应用于儿童基础复苏后的生命支持[4]。尽早的建立 ECMO能够明显减少血管活性药的用量、减少复苏和药物对机体重要脏器的损伤,对提高近远期存活率及避免神经系统并发症有益[10,16]。有研究显示 52%~67%的患儿可以顺利撤机,35%~56%的患儿存活[16-18],我们的结果与此接近(本组12例患儿进行 ECMO治疗,撤机率 58.3%,治愈出院率 33.3%)主要的并发症为严重出血、多脏器功能衰竭、感染等,与内、国外报道类似[16-18]。
总之,先心病患儿 CPB术后如何提高 CPCR的成功率是目前临床亟待解决的问题。经过我们小儿心脏中心 110例病例资料的总结分析,及时发现CRA、准确的判断病因、配以训练有素的复苏团队及ROSC建立后的综合处理并合理应用 ECMO技术,可为提高 CPCR的远期成功率起到积极作用。
[1]Parra DA,Totapally BR,Zahn E,et al.Outcomeofcardiopulmonary resuscitation in a pediatric cardiac intensive care unit[J].Crit Care Med,2000,28(9):3296-3300.
[2]Slonim AD,Patel KM,Ruttimann UE,et al.Cardiopulmonary resuscitation in pediatric intensive care units[J].Crit Care Med,1997,25(12):1951-1955.
[3]Doniger SJ,Sharieff GQ.Pediatric resuscitation update[J].Emerg Med Clin North Am,2007,25(4):947-960.
[4]del Nido PJ,Dalton HJ,Thompson AE,et al.Extracorporeal membrane oxygenator rescue in children duringcardiac arrestafter cardiac surgery[J].Circulation,1992,86(5 Suppl):II300-304.
[5]曾健生,钱素云,陈贤楠,等.儿童重症监护病房心肺复苏的回顾性分析[J].中华急诊医学杂志,2005,14(6):488-490.
[6]钱素云.小儿心肺复苏特点[J].世界危重病医学杂志,2005,2(2):628-630.
[7]Lopez-Herce J,Garcia C,Rodriguez-Nunez,et al.Longterm outcome of paediatric cardiorespiratory arrest in Spain[J].Resuscitation,2005,64(1):79-85.
[8]Suominen P,Korpela R,Kuisma M,et al.Paediatric cardiac arrest and resuscitation provided by physician-staffed emergency care units[J].Acta Anesthesiol Scand,1997,41(2):260-265.
[9]刘骏达,黄喜林,吴贤仁,等.大剂量与常规剂量肾上腺素在心跳骤停复苏应用的比较研究[J]〛.河北医学,2005,11(1):20-21.
[10]龙村.体外膜肺支持疗法在本世纪中国体外循环的机遇和挑战[J].中国体外循环杂志,2005,3(2):65.
[11]姜胜,王彤,黄子通.血管加压素在心肺复苏中的作用研究进展[J].中国急救医学,2003,23(9):643.
[12]Goetting MG,Paradis NA,Appleton TJ,etal.Aortic-carotid artery pressure differences and cephalic perfusion pressure during cardiopulmonary resuscitation in human[J].Crit Care Med,1991,19(8):1012-1017.
[13]Schleien CL,Dean JM,Koehler RC,etal.Effectof epinephrine on cerebral and myocardial perfusion in an infant animal preparation of cardiopulmonary resuscitation[J].Circulation,1986,73(4):809-817.
[14]Angelos MG,Gaddis ML,Gaddis GM,et al.Improved survival and reduced myocardial necrosis with cardiopulmonary bypass reperfusion in canine model of coronary occlusion and cardiac arrest[J].Ann Emerg Med,1990,19(10):1122-1128.
[15]Martin GB,Rivers EP,Paradis NA,et al.Emergency department cardiopulmonary bypass in the treatmentofhuman cardiac arrest[J].Chest,1998,113(3):743-751.
[16]Raithel SC,Pennington DG,Boegner E,etal.Extracorporeal membrane oxygenation in children after cardiac surgery[J].Circulation,1992,86(5 Suppl):II305-II310.
[17]黑飞龙,楼松,龙村,等.体外膜肺氧合回顾分析[J].中国体外循环杂志,2010,8(1):4-7.
[18]郝星,闫晓蕾,倪虹,等.心脏术后心源性休克的体外膜肺氧合治疗[J].中国体外循环杂志,20108(1):8-11.
