高效液相色谱法测定动物组织中喹乙醇标示残留物
2010-10-28张小军陈雪昌余海霞梅光明
张小军,郑 斌*,陈雪昌,余海霞,梅光明
(1.浙江省海洋水产研究所,浙江 舟山 316100;2.浙江工商大学食品与生物工程学院,浙江 杭州 310035;3.浙江省海洋开发研究院,浙江 舟山 316000;4.浙江大学舟山海洋研究中心,浙江 舟山 316000)
高效液相色谱法测定动物组织中喹乙醇标示残留物
张小军1,2,郑 斌3,*,陈雪昌1,余海霞4,梅光明1
(1.浙江省海洋水产研究所,浙江 舟山 316100;2.浙江工商大学食品与生物工程学院,浙江 杭州 310035;3.浙江省海洋开发研究院,浙江 舟山 316000;4.浙江大学舟山海洋研究中心,浙江 舟山 316000)
建立动物组织中喹乙醇标示残留物3-甲基喹噁啉-2-羧酸(MQCA)的高效液相色谱测定方法。肌肉组织通过盐酸水解提取MQCA,阴离子固相萃取柱净化,高效液相色谱定量。方法在4.0~200μg/kg添加范围内的平均回收率为82.1%~90.3%,相对标准偏差均小于7%,方法定量限为4.0μg/kg。
高效液相色谱;喹乙醇标示残留物;3-甲基喹噁啉-2-羧酸
喹乙醇属于喹噁啉类化合物,在水产养殖业中常作为一种较好的生长促进剂添加于饲料中。喹乙醇本身不稳定,在动物体内能够在短时间内代谢,其10多种代谢产物中3-甲基喹噁啉-2-羧酸(MQCA)是主要代谢物,在体内相对稳定,是欧盟规定的标示残留物。喹乙醇及其代谢物有致癌、至畸变作用,食用含有该类药物残留的肉类产品会对人体造成危害[1]。
目前动物食品中常用的MQCA检测方法有液相色谱法[2-4]、液相色谱-串联质谱法[5-6]、纳米胶体金探针法[7]等。纳米胶体金探针法不能够准确定量,液质联用法由于仪器昂贵而不能够普及,影响检测方法推广应用。本实验采用酸水解前处理和固相萃取等方法,研究并建立适用于动物食品中MQCA测定的高效液相色谱方法,为喹乙醇及其代谢物的检测及监控提供一种提取净化效果好、灵敏度高、重现性好的定量分析方法。
1 材料与方法
1.1 材料与试剂
猪肉、牛肉、对虾和草鱼购自舟山东河市场,用组织捣碎机捣碎,混合均匀。
实验用水为Milli-Q制备高纯水;甲醇、甲酸、乙酸乙酯(均为色谱纯) MERK公司;盐酸(分析纯) 中国上海试剂总厂;3-甲基喹噁啉-2-羧酸标准品(纯度>98%) 德国Dr公司;其他试剂均为分析纯。
1.2 仪器与设备
Alliance 2695高效液相色谱仪(带紫外检测器)、60mg/3mL MAX阴离子交换固相萃取柱 美国Waters公司;T18匀浆机、MS2漩涡混合器 德国IKA公司;Centrifuge5810高速离心机 Eppendorf公司;N-EVAP112氮吹仪 Organomation公司;SHA-B水浴恒温振荡器江苏亿通电子有限公司。
1.3 方法
1.3.1 提取
称取(5±0.02)g样品置于50mL离心管中,加入15mL 2mol/L盐酸,匀浆5min,盖塞振荡水解60min,然后8000r/min离心10min,收集上清液,备用。
1.3.2 净化
MAX固相萃取柱依次用3mL甲醇、3mL水活化,待溶液流至填料上层以下,加入样品提取液,控制流速小于3mL/min,待样液全部流出后用3mL乙酸钠溶液-甲醇(0.05mol/L乙酸钠溶液:甲醇=9:1,V/V)淋洗固相萃取柱,待全部流出后抽真空5min。最后用3mL甲酸-乙酸乙酯溶液(甲酸:乙酸乙酯=2:98,V/V)洗脱,洗脱液在40℃下氮气吹干,加1mL流动相溶液溶解残渣,漩涡混匀,过0.45μm滤膜后待测。
1.3.3 色谱条件
色谱柱:Sunfire C18柱(250mm×4.6mm,5μm)。流动相:甲醇-1.0%甲酸溶液(40:60,V/V)。流速:1.0mL/min。柱温:30℃。进样量:50μL。检测波长:320nm。
1.3.4 标准溶液配制
MQCA标准储备液:准确称取10mg标准品,用甲醇溶解并定容至100mL棕色容量瓶,配成标准储备液,质量浓度100mg/L。避光冷藏保存,保存期为3个月。
MQCA标准工作液:用流动相将标准溶液逐级稀释成20、50、250、500、1000μg/L系列标准工作液,现配现用。
1.3.5 标准曲线与样品测定
分别取系列标准工作液,经高效液相色谱测定后绘制标准曲线。样品测定根据保留时间定性,外标峰面积定量。分别取猪肉、牛肉、对虾和草鱼样品各5.0g,加入相当于样品含量4、40、200μg/kg的MQCA标准溶液,每个水平做6个平行,测定MQCA含量,计算回收率和相对标准偏差。
2 结果与分析
2.1 前处理方法选择
MQCA残留在动物组织中与肌肉结合紧密,普通方法很难将其完全提取,且会带入大量色素、蛋白质等杂质,影响分离、提取效果。有研究表明可以利用酸水解[7]、碱水解[8]和酶解[4,9]等方法使MQCA与肌肉组织分离,形成游离态的MQCA,达到提取的目的。碱水解通常反应较为剧烈,会造成少量MQCA降解,且反应后需要调节pH值至酸性。酶解条件比较温和,但需要较长的反应时间(16h以上)。本研究采用盐酸水解方法,研究不同浓度盐酸的酸解效果。采用阳性草鱼样品进行水解实验,以实测最高浓度为理论浓度计算获得盐酸水解效果图,其结果如图1所示。结果表明,样品组织用2mol/L盐酸溶液水解60min,可有效将MQCA从肌肉组织中分离。方法与同等实验条件氢氧化钠碱水解相比,盐酸水解条件较为温和,可减少提取液中杂质成分,提高净化效果,提高方法回收率。
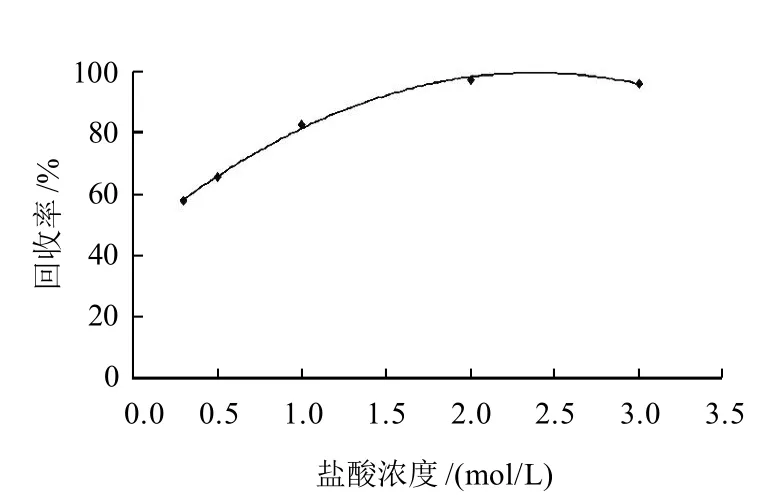
图1 盐酸浓度对样品水解的影响Fig.1 Effect of hydrochloric acid concentration on hydrolysis efficiency
2.2 色谱条件选择

图2 50μg/L MQCA标准溶液色谱图Fig.2 HPLC chromatogram of MQCA standard (50μg/L)
实验对ZORBAX SB-C18柱(250mm×4.6mm,5μ m)、Sunfire(250mm×4.6mm,5μm)、X-Bridge(250mm×4.6mm,5μm) 3种C18色谱柱进行选择,ZORBAX和XBridge出峰较早,但有杂峰干扰,Sunfire出峰相对较晚,但分离效果好,因此选择Sunfire柱作为MQCA分析柱。分析MQCA常用的流动相为1%甲酸溶液-甲醇(60:40),甲醇、水和乙酸-乙酸钠缓冲液组成梯度洗脱以及0.5%甲酸水溶液-甲醇(70:30)。经实验比较,以1%甲酸溶液-甲醇(60:40)作为流动相,其峰形和灵敏度最好。MQCA标准溶液的高效液相色谱图如图2所示,猪肉样品空白色谱图、样品加标色谱图如图3~5所示。MQCA色谱峰峰形尖锐,对称性好,与杂质完全分离,可满足定量分析的要求。

图3 猪肉空白样品色谱图Fig.3 HPLC chromatogram of blank pork sample

图4 猪肉样品4μg/kg MQCA加标色谱图Fig.4 HPLC chromatogram of pork sample with spiked MQCA(4μg/kg)

图5 猪肉样品40μg/kg MQCA加标色谱图Fig.5 HPLC chromatogram of pork sample with spiked MQCA(40μg/kg)
2.3 线性范围和检出限
用MQCA标准使用液配制质量浓度分别为20、50、250、500、1000μg/L的标准工作溶液,进样后制作标准曲线,标准曲线方程为Y=105000X-272。方法在4.0~200μg/L范围内方法线性良好,线性相关系数为0.9994。将加标浓度逐级稀释添加于样品中测定信噪比,最终按照10倍信噪比计算该方法的定量限(LOQ)为4.0μg/kg。
2.4 方法回收率和精密度
分别对猪肉、牛肉、对虾和草鱼样品进行3个梯度的加标回收实验,计算其回收率和相对标准偏差,结果如表1所示。方法平均回收率为82.1%~90.3%,相对标准偏差均小于7%。由结果可知,水产品MQCA的回收率要稍高于畜产品,其原因是由于水产品色素和脂肪含量相对较少,其基质效应要小于畜产品。
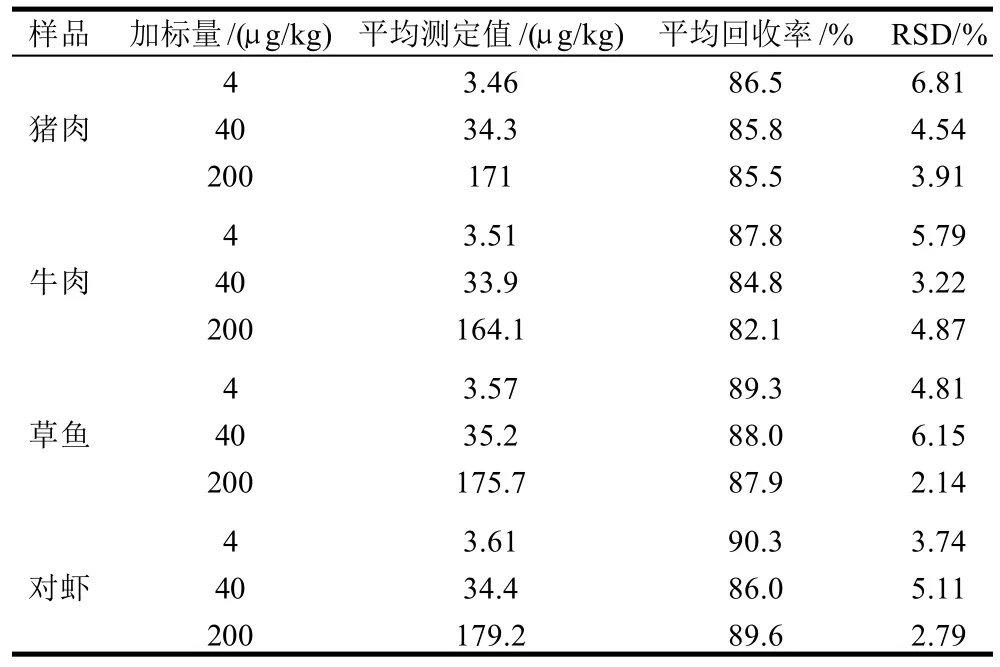
表1 样品中添加回收率及方法的精密度实验(n=6)Table 1 Recovery rates and precision of the determination method(n=6)
2.5 样品测定
利用本方法对从舟山市场上购得的猪肉、牛肉、草鱼、对虾各20个样品进行MQCA测定,没有阳性样品检出。结果表明该批次样品没有喹乙醇安全隐患,可利用本方法对市场继续检测监控。
3 结 论
建立动物组织中喹乙醇标示残留物MQCA的高效液相色谱测定方法,使用酸水解法提取组织中的MQCA,可有效地将MQCA从肌肉组织中分离;MAX固相萃取柱净化能去除大量杂质和色素,减少基质效应。利用方法对本地80个实样进行检测,未发现有阳性样品。本方法具有重现性好、精密度高、抗杂质干扰等优点,可满足目前的检测要求。
[1] Commission Regulation (EC) No.2788/98 of 22 December 1998 amending Council Directive 70/524/EEC concerning additives in feedingstuffs as regards the withdrawal of authorisation for certain growth promoters[J].Off J Eur Commun, 1998, 347: 31-32.
[2] YUAN Zonghui, WU Yulian, WANG Yujie, et al. Development of an HPLC-UV method for simultaneous quantification of quinoxaline-2-carboxylic acid and 3-methyl-quinoxiline-2-caboxylic acid in muscle and liver of swine, chicken and fish[J]. Journal of Veterinay Pharmacology and Therapeutics, 2006, 29: 142-143.
[3] WU Yujie, YU Huang, WANG Yulian, et al. Development of a highperformance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues[J]. Journal of Chromatography A,2007, 1146(1): 1-7.
[4] 殷居易, 倪梅林, 寿成杰, 等. 鸡肉中喹乙醇、卡巴多及其代谢物的残留检测[J]. 中国兽药杂志, 2006, 40(1): 11-15.
[5] BOISON J O, LEE S C, GEDIR R G. A determinative and confirmatory method for residues of the metabolites of carbadox and olaquindox in porcine tissues[J]. Analytica Chimica Acta, 2009, 637: 128-134.
[6] HUTCHINSON M J, YOUNG P B, KENNEDY D G. Confirmation of carbadox and olaquindox metabolites in porcine liver using liquid chromatographyelectrospray, tandem mass spectrometry[J]. Journal of Chromatography B, 2005, 816: 15-20.
[7] YAMAGATA M, LOW L K. Automated and ultrasensitive detection of methyl-3-quinoxaline-2-carboxylic acid by using gold nanoparticles probes SIA-rt-PCR[J]. Biosensors and Bioelectronics, 2009, 24(9): 2858-2863.
[8] 王霄旸, 张丽芳, 薛飞群, 等. 采用高效液相色谱-串联质谱法检测鲫鱼组织3-甲基喹噁啉-2-羧酸残留量[J]. 中国兽医科学, 2007, 37(8): 718-720.
[9] 欧阳姗, 庞国芳, 谢丽琪, 等. 动物组织中卡巴氧和喹乙醇以及相关代谢产物的液相色谱-串联质谱检测方法[J]. 分析测试学报, 2008,27(6): 590-594.
Determination of Olaquindox Marker Residue in Animal Tissues by HPLC
ZHANG Xiao-jun1,2,ZHENG Bin3,*,CHEN Xue-chang1,YU Hai-xia4,MEI Guang-ming1
(1. Marine Fisheries Research Institute of Zhejiang, Zhoushan 316100, China; 2. College of Food Science and Biotechnology,Zhejiang Gongshang University, Hangzhou 310035, China;3. Zhejiang Marine Development Research Institute, Zhoushan 316000, China;4. Zhoushan Ocean Research Institute, Zhejiang University, Zhoushan 316000, China)
A high performance liquid chromatography (HPLC) method was developed to determine olaquindox marker, methyl-3-quinoxaline-2-carboxylic acid (MQCA) residue in animal tissues. MQCA in muscle tissues were extracted by hydrochloric acid hydrolysis, purified by MAX SPE, and then quantitatively determined by HPLC. The recovery rate of spiked MQCA at the addition range of 4.0-200μg/kg was 82.1%-90.3% with the relative standard deviation (RSD) of less than 7%. The limit of detection (LOD) was 4.0 μg/kg.
high performance liquid chromatography (HPLC);marker residue of olaquindox;methyl-3-quinoxaline-2-carboxylic acid (MQCA)
TS251.7
A
1002-6630(2010)24-0289-04
2010-04-22
浙江省分析测试科技计划项目(2008F70030);浙江省科技计划项目(2009C32008)
张小军(1982—),男,工程师,博士研究生,研究方向为水产品安全检测。E-mail:xiaojun3627@163.com
郑斌(1968—),男,教授级高工,硕士,研究方向为水产品安全及标准化。E-mail:6369958@163.com
