金针菇水溶性多糖物理提取工艺及优化
2010-10-28孔晓雪安辛欣赵立艳胡秋辉
孔晓雪,安辛欣*,赵立艳,胡秋辉
(南京农业大学食品科技学院,江苏 南京 210095)
金针菇水溶性多糖物理提取工艺及优化
孔晓雪,安辛欣*,赵立艳,胡秋辉
(南京农业大学食品科技学院,江苏 南京 210095)
对比研究湿法超微粉碎提取、微波辅助提取、超声波辅助提取等不同提取方法,对金针菇可溶性多糖提取效果的影响,采用响应曲面试验设计法优化湿法超微粉碎提取金针菇水溶性多糖的工艺条件。结果表明,湿法超微粉碎提取法能显著提高金针菇水溶性多糖的提取率,优化后的工艺参数为胶体磨磨齿间隙42μm、提取温度87℃、提取时间170min。根据模型预测提取液中多糖含量为417.6μg/mL,验证实验中多糖含量为(418±3.21)μg/mL,提取率为3.63%。
金针菇;水溶性多糖;湿法超微粉碎;响应曲面
金针菇(Flammunlina velutipes)为担子菌目金钱菌属,是一种药食两用菌,其子实体含蛋白31.2%,含有丰富的维生素(VB1、VB2、VC、Vpp)和多种氨基酸[1-2]。金针菇多糖是金针菇中主要的生物活性成分之一,具有抑制肿瘤、抗癌、增强机体免疫力等作用[3-5]。
金针菇多糖的提取方法大致分为3类:水提醇沉法、酶解法、物理提取法。水提醇沉法操作简便但提取率不高,已报道的提取率(以金针菇干质量计)在1.6%左右[6-7]。酶解法中使用较多的是纤维素酶,该法提取率在2%左右[8]。物理提取法主要是指通过微波、超声波、超微粉碎等物理手段辅助提取多糖,该法能有效提高金针菇多糖提取率,研究发现微波可使多糖提取率提高83.67%[9-11],超声波可使多糖提取率提高76.22%[9]。
本实验研究微波、超声波、湿法超微粉碎(胶体磨处理)辅助提取对金针菇多糖的工艺,并通过响应曲面试验设计对湿法超微粉碎提取金针菇多糖的工艺条件进行优化,以期能够提高金针菇多糖提取率,从而为金针菇多糖的研究提供参考。
1 材料与方法
1.1 材料、试剂与仪器
金针菇白色品系F21,购于高淳金针菇种植基地,无开伞,平均含水量为85%。
葡萄糖标准溶液(100μg/mL)、Sevag试剂(体积比5:1的氯仿正丁醇混合溶液)、硫酸、蒽酮、无水乙醇等均为分析纯。

表1 对照实验操作步骤Table 1 Operation procedures of different extraction metods
UV-2450紫外分光光度计 日本岛津公司;SANLEWZD1S型微波设备 南京三乐微波设备有限公司;AS 20500A超声仪 瑞士Buchi公司;L50试验室专用胶体磨 上海诺尼机械厂;HH-42数显恒温水浴锅 常州国华电器有限公司;电热鼓风干燥箱 上海第三仪器厂;AUY120电子分析天平 日本岛津公司;植物组织破碎机 台湾联中电器厂;Avanti J-E落地式高效冷冻离心机 美国 Beckman Coulter 公司。
1.2 方法
1.2.1 金针菇多糖提取方法筛选
准确称取18份金针菇,每份100.00g,分为6组依次编号为1、2、3、4、5、6,操作步骤如表1所示。通过对比实验选择适宜的提取方法,并对该方法进行单因素与响应曲面试验优化。
1.2.2 湿法超微粉碎提取金针菇多糖工艺的单因素优化
以提取液中多糖含量为指标,对金针菇多糖的湿法超微粉碎提取工艺的5个单因素(提取次数、料液比、胶体磨磨齿间隙、提取温度和提取时间)进行优化。
提取次数的影响:准确称取数份100.00g新鲜金针菇,按1次提取料液比1:15,2次提取料液比1:10,3次提取料液比1:5进行湿法超微粉碎提取(其余提取条件与表1中2组相同),提取液浓缩为1500mL后测定多糖含量。
料液比的影响:按料液比1:5、1:10、1:15、1:20、1:25,进行湿法超微粉碎,提取液浓缩或稀释为1500mL后测定提取液中多糖含量。
胶体磨磨齿间隙的影响[12]:调节胶体磨磨齿间隙依次为20、40、60、80、100μm,将金针菇浆液在胶体磨中胶磨,得到金针菇超微粉碎浆按表1中2组的步骤提取,并测定提取液中多糖含量。
提取时间的影响:金针菇超微粉碎浆,在80℃提取30、60、90、120、180min(其余提取条件与表1中2组相同),测提取液中多糖含量。
提取温度的影响:金针菇超微粉碎浆,在20、40、60、80、100℃范围内提取90min(其余提取条件与表1中2组相同),测提取液中多糖含量。
1.2.3 提取液中多糖含量的测定
采用硫酸-蒽酮法[13]进行测定。
1.2.4 多糖提取率的计算

1.2.5 Box-Behnken响应曲面设计
根据湿法超微粉碎提取工艺的单因素试验结果,选择磨齿间隙、提取温度、提取时间3个因素为研究对象,以提取液中多糖含量为响应值设计Box-Behnken试验,对湿法超微粉碎提取工艺进行进一步优化。试验因素水平及编码见表2。
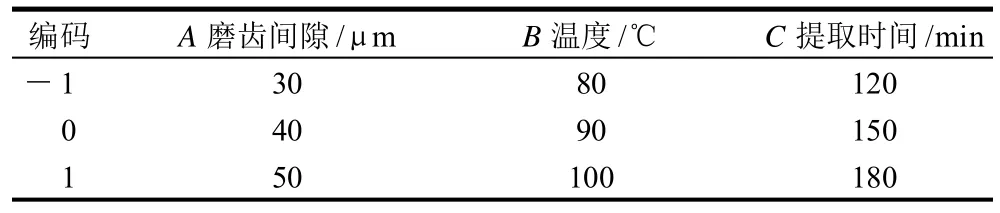
表2 Box-Behnken响应曲面设计试验因素水平和编码Table 2 Factors, levels and codes of Box-Behnken response surface experiments
1.2.6 回归模型验证实验
按照Design Expert 7.0给出的最优参数进行实验,重复3次,计算实验值与理论值之间的误差。
1.3 统计分析
数据统计采用SAS 8.12进行ANOVA单因素方差分析及多重检验(P<0.05),数据以平均值±标准差表示。响应曲面优化及数据分析采用Design Expert 7.0软件。
2 结果与分析
2.1 葡糖糖标准曲线的绘制
葡萄糖标准曲线回归方程如下:

式中:y为吸光度;x为葡萄糖标准曲线中对应的葡萄糖质量浓度/(μg/mL)。
2.2 金针菇多糖提取
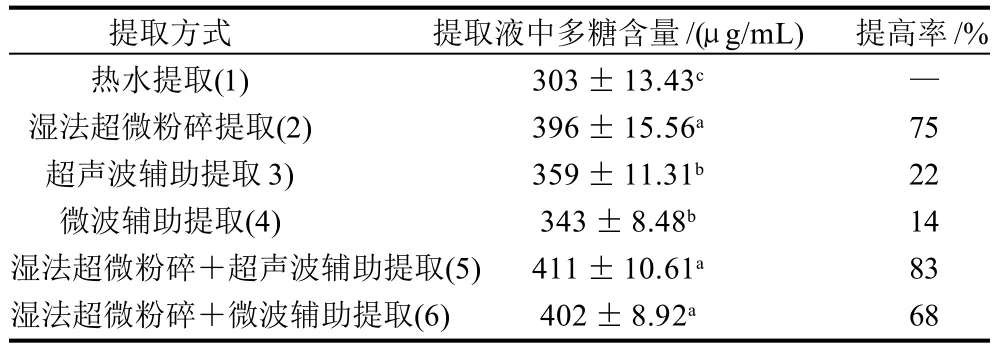
表3 不同提取方式提取效果比较Table 3 Comparison of extraction rates using different extraction methods
如表3所示,超声波、微波辅助提取能显著提高提取液中多糖含量(P<0.05);湿法超微粉碎提取、湿法超微粉碎与超声波结合辅助提取、湿法超微粉碎与微波结合辅助提取,能极显著的提高提取液中多糖含量(P<0.01),其中湿法超微粉碎与超声波结合辅助提取法,提取液中多糖含量最高,较热水提取工艺提高83%,但与湿法超微粉碎处理组相比提取液中多糖含量没有显著差异,为了简化工艺,本实验中金针菇水溶性多糖的提取采用湿法超微粉碎提取法。
2.3 湿法超微粉碎提取法单因素试验
2.3.1 提取次数对多糖含量的影响

图1 提取次数对多糖含量的影响Fig.1 Effect of extraction repeat number on the content of polysaccharides
如图1所示,随提取次数增加,多糖提取率逐渐增加,其中1次提取与2次提取相比,多糖提取率增加显著;两次提取与3次提取相比,多糖提取率增加不显著,从工艺耗时和经济方面考虑,提取次数选择2次。
2.3.2 料液比对多糖含量的影响

图2 料液比对多糖含量的影响Fig.2 Effect of material-liquid ratio on the content of polysaccharides
如图2所示,随料液比比值减小多糖提取率逐渐升高,当料液比比值小于1:15时,提取液中多糖含量上升趋势减缓,结果表明金针菇多糖湿法超微粉碎提取适宜的料液比为1:15。
2.3.3 胶体磨磨齿间隙对多糖含量的影响
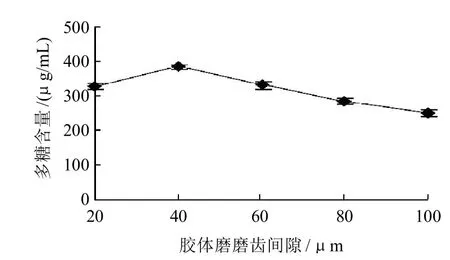
图3 胶体磨磨齿间隙对多糖含量的影响Fig.3 Effect of colloid mill gap on the content of polysaccharides
如图3所示,随胶体磨磨齿间隙的增加,多糖提取率呈先增大后减小的趋势,当磨齿间隙为40μm时,提取液中多糖含量最高,达384μg/mL。磨齿间隙越小,金针菇粉碎的粒径越小,细胞壁破壁率越高,多糖越容易溶出,可以很快溶解到提取溶剂中;但如果粒子粒径继续减小,颗粒表面能会增加,将对一部分多糖产生吸附作用,反而使溶剂中多糖含量下降[12,14],适宜的磨齿间隙选为40μm。
2.3.4 提取时间对多糖含量的影响

图4 提取时间对多糖含量的影响Fig.4 Effect of extraction time on the content of polysaccharides
如图4所示,随着提取时间的延长,提取液中多糖含量迅速增加,当提取时间超过150min后,提取液中多糖含量有所下降,这可能是因为长时间的高温处理使提取液中的一部分多糖分子发生了降解[13,15],适宜的提取时间为150min。
2.3.5 提取温度对多糖含量的影响

图5 提取温度对多糖含量的影响Fig.5 Effect of extraction temperature on the content of polysaccharides
如图5所示,随着提取温度的升高,提取液中多糖含量迅速增加,当温度超过80℃以后,多糖含量上升趋势减缓。这主要是由于随温度的升高分子活动加剧,可溶物溶出速率提高,但温度超过80℃后,继续升高温度也不能使提取液中多糖含量继续上升,适宜的提取温度为80℃。
2.4 Box-Behnken响应曲面设计
2.4.1 拟合模型的建立
对数据进行回归分析,获得二元多次回归方程:

2.4.2 拟合方程方差分析

表4 响应曲面试验设计及结果Table 4 Design and results of response surface experiments
响应曲面试验结果见表4,对模型的方差分析结果见表5。分析结果表明,对金针菇多糖得率所建立的二次多项式模型具有高度显著性(P<0.0001),方程负相关系数的平方(R2)为0.9961,失拟项不显著(P=0.1853),R2Adj=0.9911,说明建立的模型能够解释99.11%响应值的变化,能很好的描述金针菇多糖湿法超微粉碎提取过程中多糖提取率随提取条件的变化规律,可以用此模型对多糖的提取率进行分析和预测[16-17]。

表5 回归模型的方差分析Table 5 Variance analysis of regression equation
模型方程回归系数及其显著性检验结果表明,模型一次项A、B、C,二次项A2、B2、C2,交互项AB、AC、BC对响应值的影响都极显著。
2.4.3 交互作用分析
由二次多项式方程所作的响应面图及等高线图见图5~7,各因素及其交互作用对响应值的影响可以通过该组图直观反映出来。等高线的形状反映了交互作用的强弱,等高线图越接近圆形表明交互作用越不显著[18]。
2.4.3.1 磨齿间隙与提取温度的交互作用
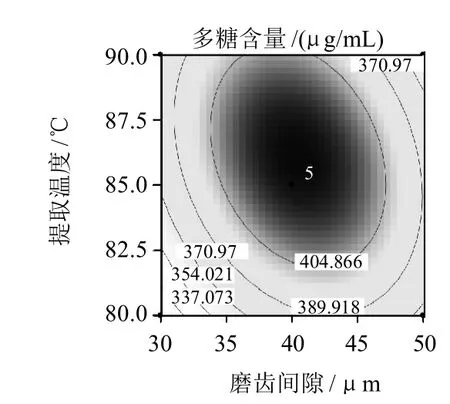
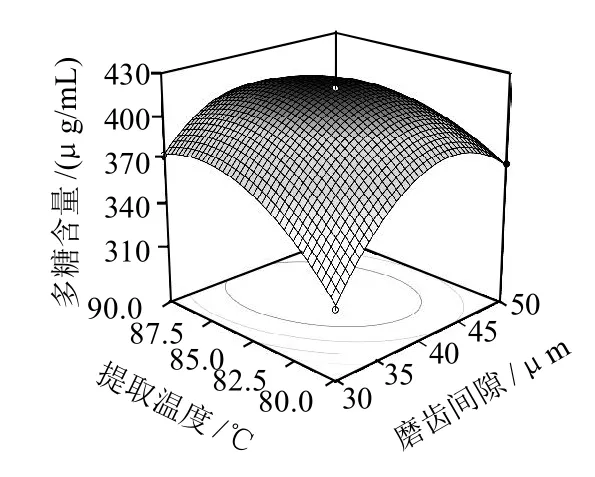
图5 胶体磨磨齿间隙与提取温度的等高线图和响应曲面图Fig.5 Response surface and contour plots for the effect of crossinteraction between the gap of colloid mill and extraction temperature on the extraction rate of polysaccharides
图5显示提取时间最佳值为171.2min时,磨齿间隙与提取温度对多糖提取率的影响。由方差分析表中的P值分析得出磨齿间隙与提取温度之间的交互作用极显著,当把提取温度固定在85℃,随磨齿间隙的增加,在试验范围内提取液中多糖含量先增加后减少,在40μm附近达到峰值。当把磨齿间隙固定在40μm,随提取温度的升高在试验范围内提取液中多糖含量先增加后减小,在85℃附近达到峰值。
2.4.3.2 磨齿间隙与提取时间的交互作用
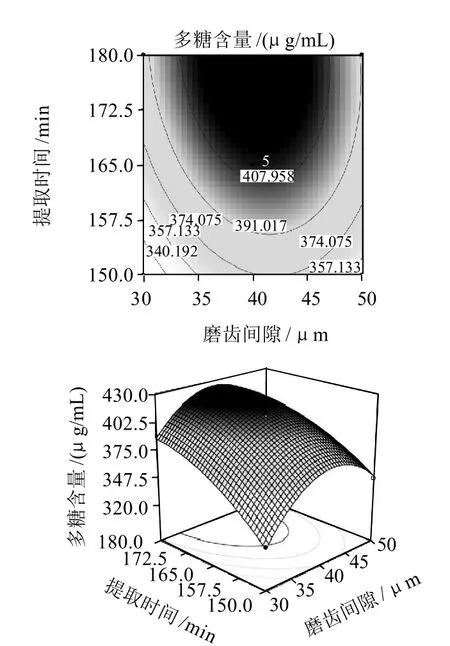
图6 胶体磨磨齿间隙与提取时间的等高线图和响应曲面图Fig.6 Response surface and contour plots for the effect of crossinteraction between the gap of colloid mill and extraction time on the extraction rate of polysaccharides
图6显示提取温度最佳值为86.9℃时,磨齿间隙与提取时间对多糖提取率的影响。由方差分析表中的P值分析得出磨齿间隙与提取时间的交互作用极显著。当把提取时间固定在165min,随磨齿间隙的增大提取液中多糖含量呈先增加后减少的趋势,在40μm附近达到峰值。当把磨齿间隙固定在40μm,随提取时间延长,提取液中多糖含量持续增加,在165~180min内达到峰值。
2.4.3.3 提取时间与提取温度的交互作用

图7 提取时间与提取温度的等高线图和响应曲面图Fig.7 Response surface and contour plots for the effect of crossinteraction between extraction time and extraction temperature on the extraction rate of polysaccharides
图7显示了磨齿间隙最佳值为42.2μm时,提取时间与提取温度对多糖提取率的影响。由方差分析表中的P值分析得出提取时间与提取温度之间的交互作用达到极显著水平。当把提取温度固定在85℃,随提取时间的延长提取液中多糖含量在试验范围内持续增加,在165~180min内达到峰值。当把提取时间固定在165min上,随提取温度升高,多糖含量先增加后减少,在85℃附近达到峰值。
2.4.4 模型的优化和验证
通过Design Expert 7.0分析得到最佳提取条件为磨齿间隙42.2μm、提取温度86.9℃、提取时间171.2min。根据实际情况把工艺参数修正为磨齿间隙42μm、提取温度87℃、提取时间170min。按照此工艺得到的提取液中多糖含量为(418±3.21)μg/mL,经拟合模型得到的预测值为417.6μg/mL,与实测值差异不显著,说明该模型可以很好的预测金针菇水溶性多糖的提取条件与提取液中多糖含量之间的关系,同时也说明了工艺参数的可行性。此时的多糖提取率(按金针菇干质量计)为3.63%。
3 结 论
湿法超微粉碎(胶体磨处理)、超声波、微波等物理手段能提高提取液中多糖的含量。其中湿法超微粉碎处理效果最为明显,与单纯沸水提取相比,湿法超微粉碎提取法获得的多糖含量提高了75%。
响应曲面法优化后的多糖提取率为3.63%,高于已报道的水提醇沉法和酶解法的提取率,操作简便,工艺参数切实可行。
[1] 蔡和晖, 廖森泰, 叶运寿, 等. 金针菇的化学成分、生物活性及加工研究进展[J]. 食品研究与开发, 2008(11): 171-174.
[2] KALAC P. Chemical composition and nutritional value of European species of wild growing mushrooms: a review[J]. Food Chemistry,2009, 113(1): 9-16.
[3] ZHANG M, CUI S W, CHEUNG P C K, et al. Antitumor polysaccharides from mushrooms: a review on their isolation process, structural characteristics and antitumor activity[J]. Trends in Food Science and Technology, 2007, 18(1): 4-19.
[4] JEURINK P V, NOGUERA C L, SAVELKOUL H F J, et al.Immunomodulatory capacity of fungal proteins on the cytokine production of human peripheral blood mononuclear cells[J]. International Immunopharmacology, 2008, 8(8): 1124-1133.
[5] 张春玉, 黄国辉, 王革, 等. 几种食(药)用真菌凝集素免疫活性的研究和应用前景概述[J]. 农业与技术, 2007(1): 58-60.
[6] 刘晓鹏, 姜宁, 向东山, 等. 金针菇深层发酵条件及水浴提取菌丝体多糖的研究[J]. 食品科学, 2008, 29(9): 437-440.
[7] GHOSH K, CHANDRA K, ROY S K, et al. Structural investigation of a polysaccharide (Fr. I) isolated from the aqueous extract of an edible mushroom, Volvariella diplasia[J]. Carbohydrate Research, 2008, 343(6): 1071-1078.
[8] 于荣利, 秦旭升, 宋凤菊. 金针菇研究概况[J]. 食用菌学报, 2004(4):63-68.
[9] CHEN Yiyong, GU Xiaohong, HUANG Shengquan, et al. Optimization of ultrasonic/microwave assisted extraction (UMAE) of polysaccharides from Inonotus obliquus and evaluation of its anti-tumor activities[J].International Journal of Biological Macromolecules, 2010, 46(4): 429-435.
[10] 庞利苹, 徐雅琴. 微波辅助萃取法提取南瓜籽中植物甾醇工艺的优化[J]. 中国粮油学报, 2010(8): 34-36.
[11] WANG Junlong, ZHANG Ji, ZHAO Baotang, et al. A comparison study on microwave-assisted extraction of Potentilla anserina L. polysaccharides with conventional method: molecule weight and antioxidant activities evaluation[J]. Carbohydrate Polymers, 2010, 80(1): 84-93.
[12] 纵伟, 张欢欢. 湿式超微粉碎提取怀菊花总黄酮的研究[J]. 食品科学, 2009, 30(16): 169-171.
[13] 刘洁, 缪晓青. 响应面分析法优化莲花蜂花粉多糖提取工艺研究[J].食品科学, 2010, 31(14): 101-105.
[14] ZHAO Xiaoyan, DU Fangling, ZHU Qingjun, et al. Effect of superfine pulverization on properties of Astragalus membranaceus powder[J].Powder Technology, 2010, 203(3): 620-625.
[15] 陈欣, 龚兰, 刘冠卉. 食用真菌多糖提取条件的优化及其还原力的比较[J]. 食品科学, 2010, 31(14): 140-145.
[16] 申迎宾, 范子剑, 麻浩. 响应面法优化发芽豇豆积累γ-氨基丁酸工艺条件的研究[J]. 食品科学, 2010, 31(2): 10-16.
[17] 余勃, 陆豫, 郑颖洁. 茶花粉超微粉碎破壁工艺优化[J]. 食品科学,2009, 30(22): 88-91.
[18] 徐丽萍, 李笑梅, 王鑫. 响应曲面法优化桔梗皂甙提取工艺[J]. 食品科学, 2010, 31(12): 50-52.
Optimization of Extraction Processing for Water-soluble Polysaccharides from Flammulina velutipes
KONG Xiao-xue,AN Xin-xin*,ZHAO Li-yan,HU Qiu-hui
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Wet ultra-fine pulverization extraction, microwave-assisted extraction and ultrasound-assisted extraction were used to explore the optimal extraction conditions of water-soluble polysaccharides from Flammulina velutipes. Response surface methodology (RSM) was employed to optimize the conditions of wet ultra-fine pulverization extraction for water-soluble polysaccharides. Results indicated that the optimal extraction processing parameters were the gap of colloid mill at 42μm,extraction temperature of 87 ℃ and extraction time of 170 min. Under the optimal extraction conditions, the extraction rate of polysaccharides was 3.63%. The concentration of water-soluble polysaccharides based on predictive model was 417.6μg/mL,and the actually determined concentration of water-soluble polysaccharides was (418 ± 3.21 )μ g/mL.
Flammulina velutipes;water-soluble polysaccharides;wet ultra-fine pulverization extraction;response surface methodology (RSM)
TS201
A
1002-6630(2010)24-0230-06
2010-11-02
国家现代农业产业技术体系建设专项
孔晓雪(1985—),女,硕士研究生,研究方向为食品营养化学。E-mail:ldxmkxx@yahoo.cn
安辛欣(1960—),男,副教授,硕士,研究方向为食品营养化学。E-mail:anxinxin@njau.edu.cn
