多粮浓香型白酒厂内细菌多样性及分布的研究
2010-10-27周瑞平陈云宗唐代云
周瑞平,陈云宗,唐代云
(四川省宜宾市叙府酒业有限公司技术中心,四川 宜宾 644000)
多粮浓香型白酒厂内细菌多样性及分布的研究
周瑞平,陈云宗,唐代云
(四川省宜宾市叙府酒业有限公司技术中心,四川 宜宾 644000)
采用改良的NA培养基分离、去除冗余,从多粮浓香型酒厂内的空气、曲药、糟醅、窖泥中分离到82株细菌,其中优势细菌24株,占分离所得细菌总数的29.27%。对这24株优势细菌的16S rDNA序列分析表明,其中13株为Bacillus属,9株分属于Lysinibacillus属、Staphylococcus属、Rummeliibacillus属,Brevibacillus属、Brachybacterium属,还有2株菌与数据库中模式菌株相似性低于97%,很可能代表着新类群。入窖糟醅中细菌种类及数量最多,曲药中产芽孢细菌最多,可产淀粉酶的细菌在生产环境中分布最广,表明细菌种类及数量的分布与白酒生产以及酒体的风格形成可能有着密切的联系。
多粮浓香型;细菌;分离;16S rDNA;分析
多粮浓香型白酒的生产离不开当地独特的自然环境,宜宾作为中国酒都,地处三江交汇处,其特殊的气候环境孕育出了独特的酿酒微生物生态区系;一般认为在浓香型白酒生产过程中,霉菌主要起糖化作用,酵母发酵产生酒精,细菌主要参与形成白酒复杂的风味和香气。虽然目前浓香型白酒酿酒微生物的研究已有较多报道[1-2],但主要集中于功能细菌的分离、分布及产物利用[3-4],而且其分类主要是根据其产物来判断。同时,因为某些不可培养微生物在酿造过程中可能也起着重要作用[5],近年来利用免培养法研究窖泥及糟醅中微生物区系分布有所报道[6]。但结合生产实践的理论研究相对滞后,影响了白酒产业的发展。
本实验利用纯培养的方法对多粮浓香型白酒生产环节中优势细菌开展研究,希望对浓香型白酒酿造过程中主要细菌区系的变化有一个比较细致的了解,以探讨多粮浓香型白酒酿造中多种细菌对白酒质量的影响。
1 材料与方法
1.1 材料
样品采集:窖泥及糟醅选取同一车间产酒质量及产酒率较优、中等、较差且相对稳定的3口窖取样。曲药为自制小麦大曲。
窖泥样品:出窖时取分别于上中下层4点、底层中央取窖泥100g,每口窖单独混合,采集后马上回实验室进行分离。
糟醅样品:入窖及出窖时分别于每口窖内上中下层糟醅同一平面上的中心及四周共15个取样点各取样100g,每口窖出窖样品、入窖样品单独混合,采集后立即回实验室进行分离。
曲药样品:取质量不同(优、中、差,初步判断,后期通过产酒状况进一步证实)、储存时间(新曲、储存3个月、储存半年以上)不同的大曲样品6个,分离其中细菌。
空气样品:采用自然沉降法取样,取样平板暴露在空气中5min,按奥梅梁斯基公式换算为单位体积空气中的细菌浓度[7]:n=50000×N/(A×t),式中,n为大气微生物浓度/(CFU/m3);N为平板菌落数/(CFU/平皿);A为平皿面积/cm2;t为平皿暴露于空气中的时间/ min;50000为单位体积空气中的细菌浓度的经验值。
1.2 分离培养基
改良牛肉膏蛋白胨培养基(NA):1000mL NA培养基中含100mL由酒糟、曲药浸提所得的浸提液及50000U制霉菌素。浸提液为50g酒糟或曲药加500mL水煮沸后四层纱布过滤后所得。
1.3 试剂与仪器
菌株DNA提取、16S rDNA片段扩增所用的各种酶、Marker、dNTPs、Buffer等 上海生工生物工程技术服务有限公司;其余试剂均为国产分析纯。
TC-412 PCR仪 英国Techne公司;celdocxR凝胶成像系统 美国Bio-Rad公司。
1.4 细菌的分离及保藏
分别取各样品100g溶于900mL无菌水中(实验室自制蒸馏水,灭菌,下同)中,梯度稀释至10-4,每一稀释梯度涂布10个分离平板。定期观察分离平板,挑取单菌落划线纯化于常规NA斜面上。对从同一样品内分离到的菌株,如果菌落颜色、大小、突起特征、边缘特征、表面光滑与否、气味、透明度、镜下形态、排列方式等特征完全一致,则合并去除冗余。预实验发现稀释到10-3时,分离平板上生长的细菌菌落已很少,且10-3梯度与10-2梯度的菌落数量差异主要由少数优势细菌引起,因此在本实验中确定每克样品中菌落总数超过102CFU的细菌为优势细菌,同时对可形成某些产物提高酒质或可能致病的细菌,予以特别关注。
1.5 培养物DNA提取和16S rDNA PCR扩增
根据文献[8]提供的方法,提取优势菌及特殊菌基因组DNA后,PCR扩增16S rDNA。细菌引物27f:5′-AGAGTTTGATCTGGCTCAG-3′和1541r:5′-AAGGAGGTGATCCAGCCGCA-3′[9]。PCR反应体系和反应条件参照东秀珠等[10]的方法进行(PCR扩增时退火温度57℃,延伸时间50s,25个循环)。
1.6 16S rDNA部分序列分析
扩增的PCR产物送上海生工生物工程技术服务有限公司纯化并测序,测序长度1000~1100bp,所得序列用EzTaxon server 2.0[11]在线进行相似性分析。用ClustalX按照最大同源性的原则进行排序,采用Kimura-2[12]计算核苷酸差异值,并用BioEdit 5.0.9进行检验,最后用Neighbor-Joining法[13]构建系统进化树,自展数(bootstrap)为1000。
2 结果与分析
2.1 不同酿造环境中细菌的分布

表1 白酒酿造细菌分离情况Table 1 Distribution of bacteria during the production of Luzhouflavor liquor
从糟醅、曲药、空气、窖泥中一共分离得到82株细菌,其中优势菌24株,占分离总数的29.27%。从分离结果来看,入窖糟醅中分离到的细菌种类和数量均最多,一方面因为入窖糟醅是连接窖内外环境的媒介,既包含了来自曲药中的细菌,也包含了空气、环境中附着的细菌;另一方面,入窖糟醅营养丰富、湿度大,适宜好氧细菌及兼性厌氧细菌附着、生长。因此入窖糟醅不仅可为窖池内微生物的生长繁殖补充新的营养,而且还向窖内接种了大量新的细菌,更新了窖内菌群,保证了窖内细菌菌群的动态平衡。入窖糟醅中分离到的细菌数量及种类多于出窖糟醅及窖泥,说明在窖内发酵过程中部分细菌因不能适应窖内环境而不能存活,导致不能在出窖糟醅中分离到这些细菌。出窖糟醅中的细菌又多于窖泥中的细菌,可能是因为糟醅营养比窖泥更丰富,且其氧化还原电位高于窖泥,部分好氧菌也能存活。
窖泥中优势菌少,因为窖泥中的营养来自糟醅和黄水,成分复杂,含量均不高,很难富集某一类细菌,再加上窖泥环境波动小,高酸及兼性厌氧,甲烷菌、己酸菌等厌氧细菌在其中经过长期的驯化形成了相对稳定的细菌群落,多种属细菌在长期的合作、驯化过程中形成了相对稳定、相互依存的群落关系,其中一些细菌很难通过平板分离得到纯培养,因此分离得到的细菌种类和数量远远少于实际,优势菌也仅有两种,说明纯培养法用于研究窖泥微生物存在一定局限性,尚需结合免培养法对其进行深入研究,这也从一个侧面证明难以通过简单地接种几种细菌复制名厂老窖窖泥,生产出同等质量的优质白酒。
曲房空气及曲药中分离到的细菌种类都较少,但优势菌所占比例超过1/3,因为制曲过程中曲房内温度湿度都较高,曲药品温可达70℃以上,多数细菌不能耐受这样的高温,分离到的细菌均为耐高温的产芽孢细菌。
窖房空气中分离到的细菌菌株数较多,但仅有18%的优势菌,可能是因为空气中的营养和环境不能满足大多数细菌生长繁殖所需,空气中的细菌多数来自于厂区生产环境,少数也可经风或进入厂区的交通工具、工人带入,随空气的流动在曲房或窖房内短暂停留,因此曲房及窖房空气中的细菌菌群不如糟醅、窖泥中的菌群稳定。
2.2 浓香型白酒酿造细菌的种属分布
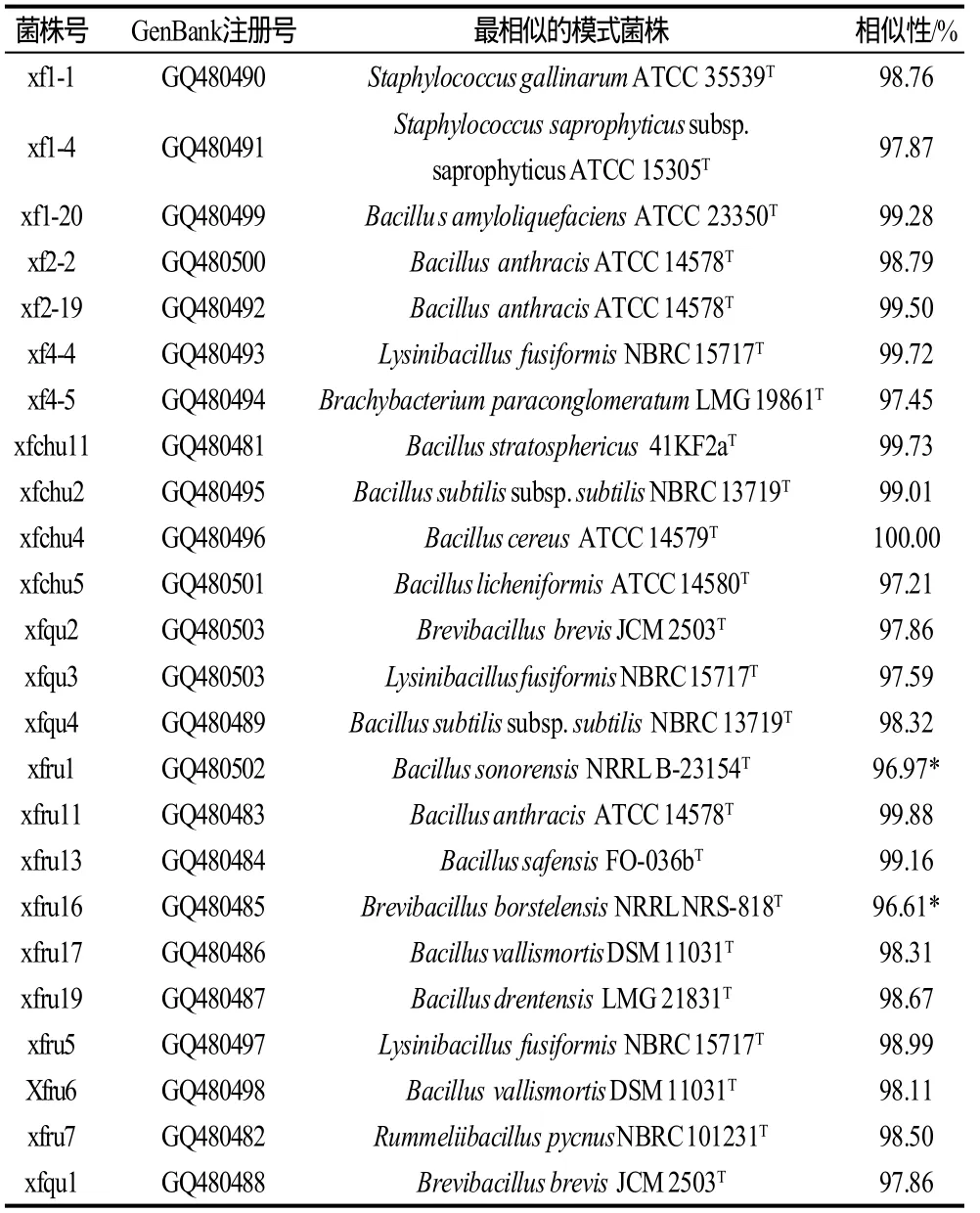
表2 24株细菌与模式菌株的16S rDNA对应序列相似性比对Table 2 Alignment of 16S rDNA gene sequences between 24 selected bacterial strains and their corresponding typical strains
对24株优势细菌的16S rDNA进行测序,共得到24条有效序列(全部在GenBank注册,序列号见表2)。一般情况下,16S rDNA序列相似性在98%以上的可以认为是同种,97%以上可以认为是同属[15],序列相似性小于96%~97%的可以认为是不同种,小于93%~95%的可以认为是不同属[16],从24株细菌16S rDNA部分序列与GenBank中菌株对应序列的比较结果来看,这些细菌中的16株菌与分属于5个属10个种的模式菌株对应序列相似度大于98%,据此可将这24株菌中的16株菌归属到4个属的10个种,其中12株分属于Bacillus属的8个种,包括属于Bacillus subtilis的2株、Bacillus amyloliquefaciens的1株、Bacillus drentensis的1株、Bacillus stratosphericus的1株、Bacillus anthracis的3株、Bacillus safensis的1株、Bacillus cereus的1株,Bacillus vallismortis的2株;与模式菌株Bacillus anthracisATCC14578对应序列相似性大于98%的3株菌平板培养未见产荚膜,可见并非致病种。两株属于Lysinibacillus fusiformis,1株属于Rummeliibacillus pycnus;1株属于Staphylococcus gallinarum。对应序列与模式菌株相似性在97%~98%之间6株菌仅能划分到属,分别是属于Bacillus属的两株,属于Staphylococcus属、B r e v i b a c i l l u s属、L y s i n i b a c i l l u s属、Brachybacterium属的各1株。对应序列与数据库中菌株最高相似性在96%~97%的两株菌可认为是分属于Bacillus属、Brevibacillus属的两个新种(表2),但图1中显示,编号为xfru1的细菌虽然与数据库中模式菌株最高相似性为96.97%,但一般认为95%以下肯定为不同属,95%~97%之间有可能为同属不同种,结合图1的系统发育图来看,推测该株菌可能仍是Bacillus属的一个新种或亚种,有待进一步深入研究。编号xfru16的细菌与模式菌株Brevibacillus borstelensisNRRL NRS-818T对应序列相似性为96.61%,且其在系统发育图上距离模式菌株较近,有可能是Brevibacillus属内的新种。
曲药中分离得到的4株细菌,有两株属于短芽孢杆菌Brevibacillus属,其16S rDNA序列分别与该属中两个种的典型菌株序列最为接近,另外两株菌的序列分别与Lysinibacillus属及Bacillus属内的一个模式菌株对应序列相似性最高,且相似性均在97%以上,所以此两株菌可能分属于Lysinibacillus属及Bacillus属。所以,曲药中分离出的4株细菌均为产芽孢细菌,可能属于3个属中的4个种,这与产芽孢细菌能够耐受制曲高温有关。
入窖糟醅中分离到的细菌最多,其中9株优势菌及1株疑似致病菌均为产芽孢杆菌,5株细菌的16S rDNA部分序列与Bacillus属的4个种的典型菌株的序列最为相似(均大于98%),所以此5株菌属于Bacillus属;两株的序列分别与Lysinibacillus属、Rummeliibacillus属中的两个种典型菌株的序列相似性超过98%,可认为分属于Lysinibacillus属及Rummeliibacillus属。所以入窖糟醅中分离得到的优势细菌分属于Bacillus属、Rummeliibacillus属、Lysinibacillus属及未确定属的8个种。
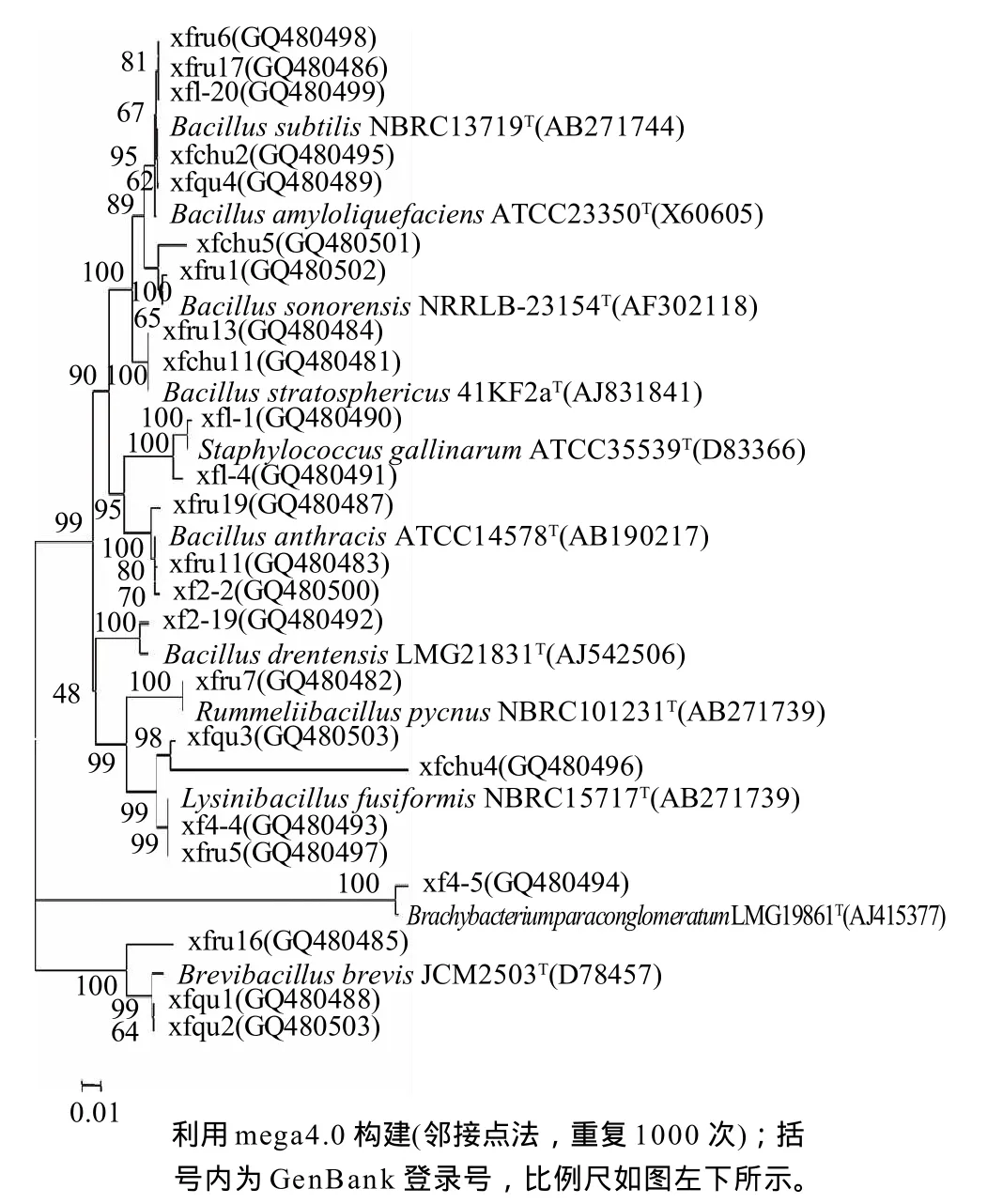
图1 24株白酒酿造细菌的16S rDNA系统发育树Fig.1 16S rDNA phylogenetic tree of 24 selected bacterial strains during the production of Luzhou-flavor liquor
出窖糟醅中分离得到的4株细菌中的3株与3个模式菌株对应序列的相似度超过99%,可认为其分布属于Bacillus stratosphericus、Bacillus subtilis、Bacillus anthracis3个种,其中与Bacillus anthracis相似性最高的一个种已确认为非致病菌,1株菌与Ba c ill u s licheniformis对应序列相似性为97.21%,可确定为Bacillus属。
曲房空气中分离得到3株优势细菌其中的两株与Staphylococcus属中两个种模式菌株对应序列相似性均在97%以上,可认为是该属的两个种。有1株与模式菌株Bacillus amyloliquefaciensATCC 23350对应序列相似性超过99%,可认为就是解淀粉芽孢杆菌。
窖房空气中分离得到的两株优势细菌与模式菌株Bacillus anthracisATCC 14578对应序列相似性超过98%,可认为是同属菌株。
2.3 优势细菌酿造特性分析
Bacillus属产芽孢细菌是大量存在于空气、土壤、水等自然环境中的革兰氏阳性杆菌,此次分离所得的24株优势细菌中属于该属的细菌最多,包括8个种12株,分布于窖泥、糟醅、曲药、空气中(图1),数量和种类均多于其他环境中分离得到的Bacillus属细菌,说明该属细菌在酿造环境中存在最广,与浓香型白酒生产的关系最密切:一方面该属的多个种可产淀粉酶或蛋白酶,糟醅、曲药等酿造基质能够满足其生长繁殖所需营养条件,另一方面其细胞壁中脂质含量低,对酒厂高浓度的乙醇、乙酸环境适应较好。
其次是分属于Lysinibacillus属的两个种的4株细菌,该属细菌曾在水中、土壤及多种植物内分离到,值得注意的是曲药、入窖糟醅、窖泥中各发现1株与Lysinibacillus fusiformis模式种对应序列相似性最高的细菌,该模式种不分解淀粉,也不能利用半乳糖、麦芽糖、果糖、葡萄糖、蔗糖产酸,这与通常认为的白酒酿造细菌产淀粉酶、产酸等性能相去甚远,推测这类细菌能够耐受制曲过程中的高温,并由曲药接种到入窖糟醅和窖泥中,在此过程中可能会参与合成一些与浓香型白酒风味物质相关的一些物质。
在曲药中分离到两株Brevibacillus属细菌曾在多种环境中分离到,严格好氧,曾报道该属的一些种可产甘露聚糖酶,淀粉酶等,对多种动植物病原真菌有明显抑制作用,推测出现在曲药中的这两株Brevibacillus属细菌可能在制曲过程中对曲药菌群有一定程度的选择作用。
从出窖糟醅中分离到1株Rummeliibacillus属细菌,该属细菌为革兰氏阳性,兼性好氧,可在多处自然环境分离到,但目前对该属细菌的相关研究主要是理论研究[16],其产物特征还有待进一步分析。Staphylococcus属细菌广泛存在于个种环境中,但笔者仅在空气中分离到两个非致病种,1株为鸡葡萄球菌,1株为腐生葡萄球菌,曲药、糟醅及窖泥中都未发现,推测这两株菌与白酒酿造没有必然联系。
从产物特征来看,此次分离所得的24株优势细菌,经平板实验可产淀粉酶的有13种,无论是种类还是数量都在分离环境中的细菌菌群中占优势,其次是耐乙醇、耐热、产酸的细菌亦较为常见,如曲房空气中分离到1株与模式菌株解淀粉芽孢杆菌Bacillus amyloliquefaciensATCC 23350对应序列相似度98%以上的优势菌,入窖糟醅中分离到1株与模式菌株死亡谷芽孢杆菌Bacillus vallismortisDSM 11031对应序列相似度98%以上的优势菌,该属细菌可水解淀粉,还可利用蔗糖、半乳糖、葡萄糖、海藻糖、麦芽糖产酸;出窖糟醅中分离到1株与枯草芽孢杆菌模式菌株Bacillus subtilissubsp. NBRC 13719相似度99%以上的菌株,可认为就是枯草芽孢杆菌,另有1株与地衣芽孢杆菌模式菌株B a c i l l u s licheniformisATCC 14580相似度97%以上的菌株可认为是同属。
总体来看,能产淀粉酶、有机酸且耐乙醇、耐热的各种细菌在酿造环境中占较大优势,这与大曲或糟醅多年以来对环境细菌的选择性富集有关。一般浓香型白酒的生产,酒醅的pH值在第2周或第3周表现出明显上升,之后逐渐缓慢下降到3.5左右,大分子物质粗淀粉、粗蛋白的大量降解基本上在第1周就已从入窖时的18%~21%下降到9%~12%,已接近降解下限;酒精发酵的主发酵在前3周已完成[17]。可见白酒生产3周之前主要是由大曲中的糖化酶来分解淀粉,酵母菌转化糖生成酒精,之后长达7周的发酵时间则主要是决定白酒品质的多种风味物质的形成,在这些风味物质生成和转化的过程中,细菌起着主要作用。以出窖糟醅中细菌为例,发酵后期细菌糟醅中粗淀粉含量为2%~10%,且含量稳定,基质酸度较高,5%乙醇左右时产淀粉酶、有机酸且耐乙醇的细菌所占比例明显超过了其他分离样品中的此类细菌,可能是因为在发酵末期,此类能够分解淀粉的细菌更能适应糟醅中糖类营养缺乏的环境,分解淀粉维持生存的同时,其产物还能为其他细菌提供营养或代谢前体物质,直接或间接地参与白酒风味物质的生成,并逐渐在群体中成为优势菌。在生产过程中取样发现,发酵后期温度上升到40℃左右,酒精度仍有所上升,这一阶段酵母因温度上升、还原糖下降等因素生成乙醇的作用已经很小,但细菌仍可正常生长,继续分解淀粉,供少量存活的酵母发酵形成乙醇。徐学明等[18]的研究表明在丢糟中加入糖化酶及活性干酵母可酿出中等质量的白酒,而细菌可持续不断地产糖化酶,说明在酿造过程中,细菌除参与形成浓香型白酒风味物质之外,还可能起着提高酒精度的作用。
此次分离到的24株优势菌中的两株菌与数据库中模式菌株对应序列的相似性小于97%,代表着新的分类单位,可能是因为我国独特的浓香型白酒酿造环境中存在一些特殊的细菌种属,因此有必要对这两株菌开展进一步研究。此外,即使是与数据库中模式菌株对应序列的相似性大于97%的细菌,由于长期选择驯化,也可能跟已报道的同种属细菌存在较大差异,如从窖泥中分离到的1株Brachybacterium属细菌,已发现的该属细菌皆为好氧,不耐酸的革兰氏阳性细菌,可代谢葡萄糖和一些其他糖产酸。窖泥的高酸、兼性厌氧环境通常是不利于该属细菌生长繁殖的,但这株非产芽孢细菌作为优势细菌从窖泥中分离到说明这株细菌与该属其他细菌存在较大差异,可能是Brachybacterium属的一个新种,尚有待进一步研究证实。
3 讨 论
通常认为环境中存在大量不可培养微生物,通过人工培养的方法很难培养出某一环境中的所有细菌,但白酒糟醅及窖泥中的营养物质相对较为简单,一般的培养基能够满足,而且细菌间的相互作用主要也是通过糟醅、曲药等媒介进行的,在分离过程中加入了糟醅及曲药的混合浸提液,分别在好氧及兼性厌氧的环境下分离培养,保证了大部分细菌,尤其是那些在群体中占优势的、与白酒酿造关系密切的细菌被分离出来。
16S rDNA由于具有许多的优点,做为当今生物系统发育的主要分子标尺,但其也存在偏保守和可能存在多操纵子等问题。已经有许多研究结果表明有些16S rDNA序列相似性大于97%的菌株仍然属于不同的分类类群[14]。所以,仅用16S rDNA序列信息是无法将菌株进行准确的鉴定的,尚需结合多种生理生化指标检测及BOX-PCR、全序列杂交等遗传指标检测结果进行准确鉴定。但是,利用16S rDNA序列分析对大量的快速菌株进行初步鉴定是目前研究细菌多样性主要使用的方法。
从本研究结果来看,细菌在白酒酿造的不同阶段所起的主要作用不同,曲药中的细菌主要以能耐高温的产芽孢细菌为主。在制曲过程中,曲药最高温度可达70℃,超过了绝大多数酵母和霉菌所能耐受的最高温度,但细菌则不然,已从曲药中分离到了耐72℃高温的细菌,可见曲药中存活的微生物主要是细菌;另一方面,入窖糟醅经过蒸煮,粮食中附着的微生物已经死亡,在混曲混糟然后发酵的过程中引入的微生物来自于4个途径:曲药、空气、红糟、窖泥。红糟及窖泥均来自窖内,所以窖外微生物主要就是通过曲药及空气引入。空气中的真菌孢子入窖后在窖内氧气稀薄的环境下很难萌发[19],糖化作用主要是靠曲药中的糖化酶而不是活的真菌来进行。而细菌代谢类型多样,所需营养简单,可适应多种环境性,是在酿造环境中分布最广最稳定的微生物,尤其是Bucillus属细菌存在种类和数量最多[4,20],从多方面影响着白酒的质量。
[1] 陈敏. 浓香型酒发酵过程中糟醅微生物动态研究[J]. 酿酒科技, 1998 (5): 26-28.
[2] 赵东, 乔宗伟, 彭志云. 浓香型白酒发酵过程中酒醅微生物区系及其生态因子演变研究[J]. 酿酒科技, 2007(7): 37-39.
[3] 胡佳, 邓斌, 张文学, 等. 浓香型白酒曲药中细菌组成及系统学分析[J]. 酿酒科技, 2007(5): 17-195.
[4] 廖建民, 姚万春, 唐玉明, 等. 浓香型曲药细菌初步分类鉴定研究[J].酿酒, 2001, 28(5): 42-43.
[5] 许德富, 张宿义, 税梁扬. 微生物技术在浓香型白酒业的发展方向[J]. 酿酒, 2009, 36(3): 9-11.
[6] 张文学, 向文良, 乔宗伟, 等. 浓香型白酒窖池糟醅原核微生物区系的分类研究[J]. 酿酒科技, 2005(7): 22-25.
[7] 许钟麟. 空气洁净技术原理[M]. 上海: 同济大学出版社, 1998.
[8] RAINEY F A, WARD-RAINEY N, KROPPENSTEDT R M, et al. The genusNocardiopsisrepresents a phylogenetically coherent taxon and a distinct actinomycete lineage: proposal ofNocardiopsaceaefam.nov.[J]. Int J Syst Bacteriol, 1996, 46(4): 1088-1092.
[9] BROSIUS J, DULL T J, SLEETER D D, et al. Gene organization and primary structure of a ribosomal RNA operon fromEscherichia coli.[J]. J Mol Biol, 1981, 148(2): 107-127.
[10] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
[11] CHUN J, LEE J H, JUNG Y, et al. EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences [J]. Int J Syst Evol Microbiol, 2007, 57: 2259-2261.
[12] KIMURA M. A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences[J]. J Mol Evol, 1980, 16(2): 111-120.
[13] SAITOU N, NEI M. The neighbor-joining method:a new method for reconstructing phylogenetic trees[J]. Mol Biol Evol, 1987, 4(4): 406-425.
[14] STACKEBRANDT E, EBERS J. Taxonomic paramenters revisited: tarnished gold standards[J]. Microbiol Today, 2006, 33(4): 152-155.
[15] DEVEREUX R, HE S H, DOYLE C L, et al. Diversity and origin ofDesulfovibriospecies: phylogenetic definition of a family[J]. Bacteriol, 1990, 172(7): 3609-3619.
[16] VAISHAMPAYAN P, MIYASHITA M, OHNISHI A, et al. Description ofRummeliibacillus stabekisiigen. nov., sp. nov. and reclassification ofBacillus pycnusNakamura et al. 2002 asRummeliibacillus pycnuscomb. nov.[J]. Int J Syst Evol Microbiol, 2009, 59(5): 1094-1099.
[17] 张文学, 岳元媛, 向文良, 等. 浓香型白酒酒醅中化学物质的变化及其规律性[J]. 四川大学学报: 工程科学版, 2005, 37(4): 44-48.
[18] 徐学明, 方发培. TH-AADY在剑南春丢糟中应用的研究[J]. 酿酒科技, 1996(2): 66-67.
[19] 胡承, 应鸿, 许德富, 等. 窖泥微生物群落的研究及其应用[J]. 酿酒科技, 2005(3): 34-38.
[20] 张文学, 乔宗伟, 胡承, 等. PCR技术对浓香型白酒糟醅细菌菌群的解析[J]. 四川大学学报: 工程科学版, 2005, 37(5): 82-87.
Diversity and Distribution of Bacteria in Luzhou-flavor Wine Factory
ZHOU Rui-ping,CHEN Yun-zong,TANG Dai-yun
(Technical Center, Xufu Liquor Industry Co. Ltd., Yibin 644000, China)
Totally 82 bacterial strains were separated from air, koji, grain stuff and pit mud in Luzhou-flavor wine factory using improved NA medium, of which 24 were the dominant strains, accounting for 29.27% of the total number. According to the 16S DNA sequence analysis, the 24 strains comprised 13 belonging to the genusBacillus, 9 belonging to the generaLysinibacillus,Staphylococcus,Rummeliibacillus,BrevibacillusorBrachybacteriumand 2 presumed to be new species belonging to the generaBacillusorBrevibacillusdue to less than 97% similarity in 16S rDNA gene sequence compared with type strains from database. Meanwhile, most species and population of bacteria were observed in grain stuffs prepared for fermentation and endosporebearing bacteria were observed in koji. However, amylase-producing bacteria were distributed in manufacturing environment. These findings suggest that the distribution of bacterial species and their number appears to exhibit a significant effect on the manufacturing of liquor and favor formation of wine.
luzhou-flavor liquor;bacteria;separation;16S rDNA;distribution
TS261.1;TS262.3
A
1002-6630(2010)13-0209-05
2009-11-22
四川省教育厅重大培育项目(09ZZ039);四川省科技厅应用基础项目(2009JY0149);宜宾市自主创新专项(200905207)
周瑞平(1975—),男,工程师、高级技师,本科,主要从事酿酒微生物、酿酒工艺研究。E-mail:xufu9@126.com
