机械活化木薯淀粉羧甲基化产物的结构表征
2010-10-27谭义秋
谭义秋
(广西民族师范学院化学与生物工程系,广西 崇左 532200)
机械活化木薯淀粉羧甲基化产物的结构表征
谭义秋
(广西民族师范学院化学与生物工程系,广西 崇左 532200)
采用搅拌球磨机对木薯淀粉进行机械活化,以活化60min的木薯淀粉为原料,氢氧化钠为催化剂,一氯乙酸为醚化剂干法合成羧甲基淀粉,利用红外光谱、扫描电子显微镜、X射线衍射等手段对产物的结构进行表征分析,并与原木薯淀粉合成的羧甲基淀粉进行比较。结果表明:机械活化对木薯羧甲基淀粉的结构有显著影响;原木薯淀粉的羧甲基化反应受表面控制,主要发生在无定形区,部分发生在结晶区,产物含有结晶结构并保留着淀粉的颗粒形态;活化淀粉的羧甲基化反应在淀粉团粒表面及内部均匀进行,产物呈无规则黏连形态,是无定形的聚集状态结构。
机械活化;木薯羧甲基淀粉;结构表征
淀粉是一种多晶高聚物,其颗粒的内部是非晶区域,外层是结晶区域而且非常牢固,结晶区域占淀粉颗粒体积的25%~50%。淀粉的结晶区域对酶、水及其他化学试剂有很强的抵抗能力[1],给其羧甲基化改性制造了一定难度。特别是在干法介质中的羧甲基化反应,淀粉与反应试剂之间的非均相混合,反应物分子的扩散接触和能量交换受到很大的制约[2],醚化剂更加不易触及结晶区域的分子,导致淀粉反应不均匀,反应主要发生在淀粉颗粒的表面及非晶区,取代度低,取代基团也多分布于淀粉颗粒的表面,产品品质及性能欠缺,导致应用受到限制。
谭义秋等[3-4]研究表明,采用机械活化的方法对木薯淀粉进行预处理,能显著改善淀粉在干法介质中的羧甲基化反应效果,制得了取代度(degree of substitution,DS)比较高的羧甲基淀粉(carboxymethyl starch,CMS),同时,CMS的理化性质也发生了明显的改变而拓宽了应用范围。为了深入了解机械活化淀粉在干法介质中的反应本质及产物的结构特征,本研究采用红外光谱、扫描电子显微镜、X射线衍射等手段对其产物进行表征分析,并就机械活化对淀粉羧甲基化的强化机理进行探讨,旨在为机械活化淀粉羧甲基化产物在食品等行业上的开发及应用提供参考。
1 材料与方法
1.1 材料与试剂
木薯淀粉(工业级)由广西明阳生化科技股份有限公司提供。
氢氧化钠 哈尔滨市化工试剂厂;一氯乙酸 成都科龙化工试剂厂;浓盐酸、95%乙醇 广东汕头市西陇化工厂;以上试剂均为分析纯。
1.2 仪器与设备
HHS11-6型电热水浴恒温锅 北京长安科学仪器厂;HJ-型磁力加热搅拌器、SHZW-C型循环水式多用真空泵 河南巩义市英峪予华仪器厂;DF205型电热鼓风干燥箱 北京医疗设备二厂;AY220电子分析天平 日本岛津公司;Nicolet Nexue 470 FTIR红外光谱仪 美国Nicolet公司;S-570扫描电子显微镜 日本日立公司;D/MAX2500V X射线衍射仪 日本理光公司。
1.3 方法
1.3.1 机械活化木薯淀粉的制备
参照文献[5]。
1.3.2 CMS的制备
参照文献[4]。
1.3.3 DS的测定
参照文献[6]。
1.3.4 产物的结构表征
1)淀粉样品在红外灯辐射下与干燥的KBr粉末一起研细混匀,压片后用红外光谱仪进行测试;2)将样品用双面胶固定在样品台上喷金,用扫描电子显微镜拍摄具有代表性的淀粉样品颗粒形貌;3)室温下采用X射线衍射仪以粉末法测定淀粉颗粒的结晶特征。测定条件:特征射线Cukα,Ni片滤波,电压40kV,电流30mA,测量范围2θ=5°~40°。
2 结果与分析
2.1 CMS红外吸收光谱分析
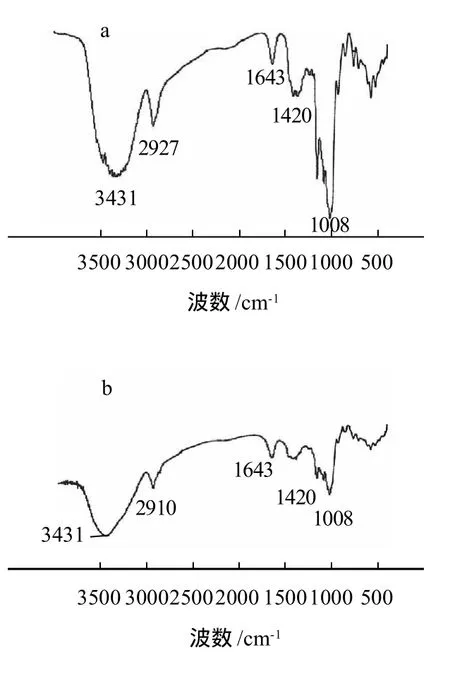
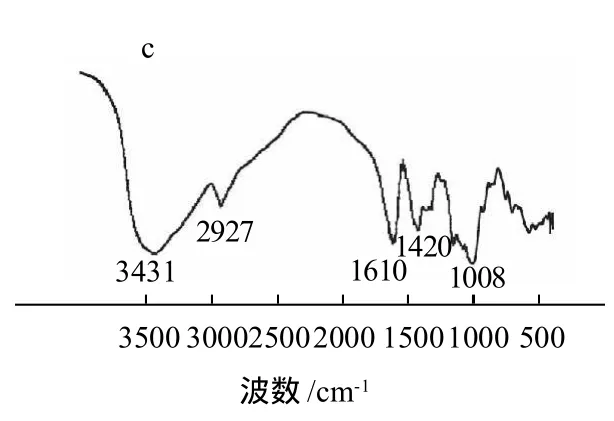
图1 原木薯淀粉、活化60min的木薯淀粉和ACMS的红外光谱图Fig.1 Infrared spectra of native cassava starch, activated cassava starch and carboxymethylated activated cassava starch
由图1可见,活化淀粉与原淀粉相比,各个特征吸收峰均减弱,但没有新的吸收峰产生,说明淀粉经机械活化后没有新的基团产生。ACMS中除了保留在3431cm-1处—OH伸缩振动宽强吸收峰、2910cm-1处出现的明显的饱和烃C—H伸缩振动吸收峰及1008~1150cm-1处的C—O伸缩振动吸收带等淀粉特征峰外,还在1610cm-1及1420cm-1处出现了很强的羧基特征吸收峰,表明在活化木薯淀粉分子上成功接入了羧基,得到了预期产物。
2.2 CMS电镜扫描分析
图2是原木薯淀粉及由原木薯淀粉合成的羧甲基淀粉(NCMS)的电镜图,图3是活化60min的木薯淀粉及ACMS的电镜图。

图2 原木薯淀粉及其羧甲基淀粉的电镜图Fig.2 SEM images of native cassava starch and its carboxymethylated counterparts with different degrees of substitution
由图2可见,原木薯淀粉颗粒呈圆球形,表面光滑、结构紧密、界面清晰;DS为0.182及DS为0.322的NCMS均呈颗粒状态结构,颗粒局部或有破损或有腐蚀的痕迹,但多数区域没有变化,说明淀粉的羧甲基化反应主要发生在颗粒的表面。经机械活化,在机械力的作用下,淀粉被冲击成扁长状或被撞击出凹洞,引起扭曲,从中间或外围破裂成更小的颗粒[7]。
由图3a可见,淀粉活化60min后,许多细小的颗粒聚集成团,形成椭圆形的团粒,表面粗糙,有缝隙,结构松散;其羧甲基化反应后,淀粉被严重侵蚀,DS为0.313及DS为0.851的ACMS均已失去原来的团粒状态结构并大片黏连在一起,表面凹凸不平,说明活化淀粉的羧甲基化反应很剧烈,反应既在团粒表面进行也在内部进行。

图3 活化60min木薯淀粉及其羧甲基淀粉的电镜图Fig.3 SEM images of activated cassava starch and its carboxymethylated counterparts with different degrees of substitution
2.3 CMS的X射线衍射分析
图4是原木薯淀粉(a)及NCMS(b)的X射线衍射图,图5是活化60min的木薯淀粉(c)及ACMS(d)的X射线衍射图。
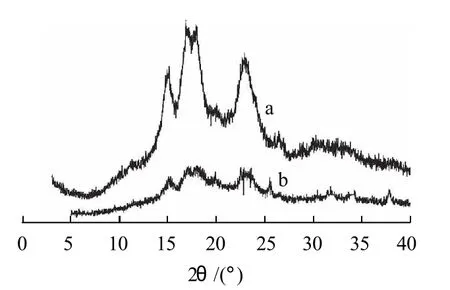
图4 原木薯淀粉(a)及其羧甲基淀粉(b)的X射线衍射图Fig.4 X-ray images of native cassava starch and its carboxymethylated counterpart
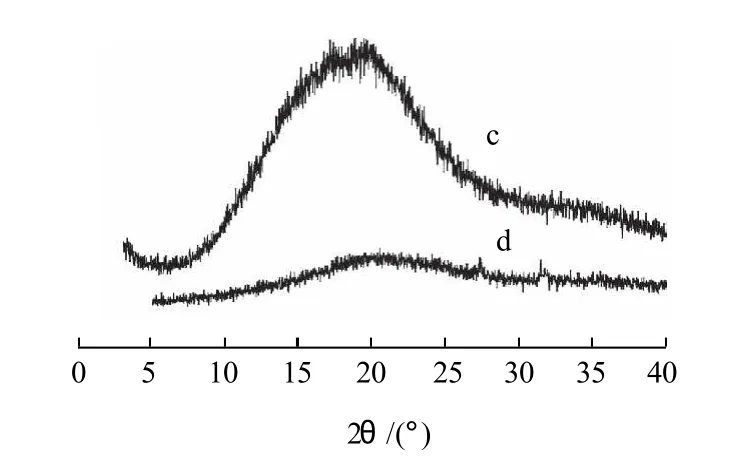
图5 活化60min木薯淀粉(c)及其羧甲基淀粉(d)的X射线衍射图Fig.5 X-ray images of activated cassava starch and its carboxymethylated counterpart
由图4可见,原木薯淀粉在其衍射图中的2θ=15.3°、17.3°、18.3°、23.5°处各出现强衍射峰,表明木薯淀粉的晶型是C型,其DS为0.322的NCMS在2θ范围内均能观察到相应的衍射尖峰,但与原淀粉相比,衍射峰已变宽,强度也已变弱,说明原淀粉的羧甲基化反应主要发生在非结晶区,也在一定程度上破坏了淀粉的结晶区,产物中结晶及非晶两区域并存。
由图5可见,活化60min的木薯淀粉,其2θ范围内的衍射尖峰几乎完全消失,整条曲线变成一个馒头峰,C型图谱已不存在,说明木薯淀粉的结晶结构已受到破坏;而活化淀粉反应后,DS为0.313的ACMS图谱没有出现衍射尖峰,说明活化淀粉的羧甲基化产物没有产生重结晶现象,产物是无定型的聚集状态结构。
2.4 机械活化对淀粉羧甲基化的强化机理
淀粉羧甲基化过程[8-10]是由一氯乙酸或其钠盐在强碱存在下对淀粉葡萄糖单元中C2、C3和C6上的羟基醚化得到。反应主要分两步进行,第一步是NaOH和淀粉(St-OH)羟基间的反应,这是反应速率的控制步骤:
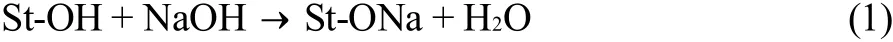
第二步是通过St-ONa的取代引入羧甲基基团,该步骤为SN2亲电子取代反应:

此过程伴随NaOH与ClCH2COONa反应生成HOCH2COONa的副反应发生:

因此,淀粉羧甲基化反应的先决条件是生成淀粉钠活性中心。原木薯淀粉颗粒是实心球体,颗粒中直链淀粉分子与支链淀粉分子交织缠绕在一起,分子内与分子间存在着强大的氢键结合力,淀粉颗粒外层的结晶区域致密,多数羟基基团被禁锢,淀粉存在对反应试剂强大的抵抗能力。传统的方法是使用氢氧化钠作催化剂,破坏淀粉的结晶区,削弱淀粉分子中氢键的结合力,激活羟基,以便形成淀粉钠活性中心,反应对碱的依赖很大。干法介质中的羧甲基化反应,由于是非均相混合体系,水分含量少,碱及醚化剂在淀粉颗粒中的扩散接触和能量交换受到更加大的制约,醚化剂很难触及结晶区域的羟基基团,反应主要发生在淀粉颗粒的表面及非晶区。由图2的电镜图及图4的X射线衍射图可以得到证实。
淀粉经过机械活化后,其致密的颗粒表面结构受到破坏,形成疏松凹凸不平的表面,同时,淀粉的结晶结构受到破坏,产生晶格缺陷,结晶度下降,有序的晶体结构被机械力破坏而逐渐形成非晶态层,最后导致整个颗粒结构无定形化[10],消弱了淀粉分子中强大的氢键结合力,原来被禁锢的羟基基团被激活,活化后形成的淀粉团粒是非实心体,结构松散,对反应试剂的抵抗力大大减弱。尽管是干法非均相价质,但辅以适量醇水,在浓度梯度的影响下,氢氧化钠就能随醇水顺利从团粒表面扩散渗透进入淀粉团粒内部,与淀粉分子链上已被激活的羟基反应形成淀粉钠活性中心并与醚化剂迅速反应;又由于原淀粉在机械活化的过程中,在机械力的作用下众多的支链淀粉侧链发生了断裂,淀粉长链也发生断裂,聚合度降低,黏度下降,直链淀粉含量增加[11-12],大大降低了羧甲基反应的空间位阻,也极大地提高了淀粉的羧甲基化反应能力。因此,活化淀粉的羧甲基化反应,反应均匀,反应程度深,取代度高。图3的电镜图及图5的X射线衍射图也得到了证实。
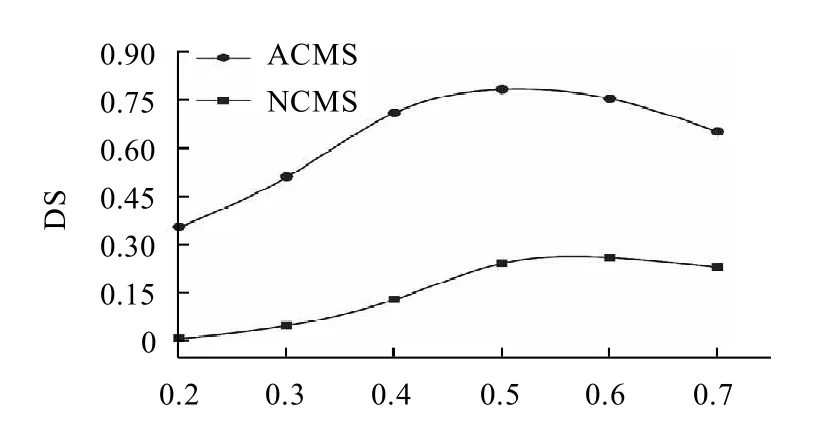
图6 醚化剂用量对羧甲基淀粉取代度的影响Fig.6 Effect of etherification agent dosage on degree of substitution of carboxymethylated starch
图6显示的是在相同反应条件下(氢氧化钠与淀粉的物质的量比0.60,反应时间120min,反应温度60℃,反应体系水的含量15%),一氯乙酸与淀粉的物质的量比n对NCMS及ACMS的DS的影响实验结果比较。由图6可见,在n相同时,ACMS的DS比NCMS的DS大得多,比如n=0.2时,NCMS 的DS=0.01,ACMS 的DS=0.36,当n=0.5时,NCMS的DS只有0.28,而ACMS的DS已高达0.78。由此也说明了活化淀粉的羟基利用率比较高,反应既发生在淀粉颗粒表面,也发生在淀粉颗粒内部,而原淀粉的反应主要发生在淀粉颗粒的表面及淀粉的无定形区域,羟基利用率比较低。
3 结 论
3.1 红外光谱表明,通过羧甲基化反应,活化淀粉成功引入羧基,得到目标产物;电镜分析表明,活化淀粉的羧甲基化反应,反应均匀,反应既在淀粉团粒表面进行,也在淀粉团粒内部进行,产物大片黏连在一起,失去了淀粉的团粒状态结构,而原淀粉的羧甲基化反应,反应很不均匀,受表面控制,主要发生在淀粉颗粒的表面,产物尚保留淀粉颗粒状态结构;X射线衍射分析表明,原淀粉的羧甲基化反应,反应主要发生在无定形区,部分发生在结晶区,产物是含有结晶结构的产物,而活化淀粉的羧甲基化产物是无定形的聚集状态结构。
3.2 使用机械活化的方法对淀粉进行预处理, 从内部强化淀粉,能显著地提高淀粉在干法介质中的羧甲基化反应活性,克服了原淀粉反应效果差的缺点,原料利用率高,产物取代度大,取代基分布均匀,产物的性质得到了改善而更能满足不同领域的需要,具有广阔的应用前景。
[1] GUAN J J, HANNA M A. Functional properties of extruded foam composites of starch acetate and corn cob fiber[J]. Industrial Crops and Products, 2004, 19(3): 255-269.
[2] 陈广德, 毛学锋. 复合催化干法制备交联-羧甲基变性淀粉[J]. 精细化工, 2008, 25(9): 904-907.
[3] 谭义秋, 赵汉民, 黄祖强, 等. 机械活化木薯淀粉干法制备羧甲基淀粉的研究[J]. 粮食与饲料工业, 2009(9): 20-23.
[4] 谭义秋, 赵汉民, 农克良, 等. 机械活化对木薯淀粉羧甲基化产物糊性质的影响(Ⅰ)[J]. 食品科学, 2010, 31(3): 102-105.
[5] 谭义秋, 黄祖强, 农克良. 机械活化预处理对木薯淀粉氧化产物理化性质的影响[J]. 食品与机械, 2008, 24(6): 20-24.
[6] 冯承, 张燕萍. 滚筒法制备的交联-羧甲基木薯淀粉的性能研究[J].粮食与饲料工业, 2005(4): 23-25.
[7] HUANG Zuqiang, LU Jianping, LI Xuanhai, et al. Effect of mechanical activation on physico-chemical properties and structure of cassava starch [J]. Carbohydrate Polymers, 2007, 68(1): 128-135.
[8] 张燕萍. 变性淀粉制造与应用[M]. 北京: 化学工业出版社, 2001:128-129.
[9] 姚杰, 尤宏, 包正, 等. 羧甲基木薯淀粉的取代方式研究[J]. 分析化学, 2005, 33(2): 201-206.
[10] SAWDA S, MATSUOKA S, NOKATA K, et al. Synthesis and ant tumor activity of 20(s) camptothecin derivatives: A-ring modified and 7, 10-disubstituted camptothecins[J]. Chemical and Pharmaceutical Bulletin , 1991, 39(12): 3183-3188.
[11] 黄祖强, 胡华宇, 童张法, 等. 玉米淀粉的机械活化效果分析[J]. 化学工程, 2006, 34(10): 51-54.
[12] 黄祖强, 陈渊, 钱维金, 等. 机械活化对木薯淀粉醋酸酯化反应的强化作用[J]. 过程工程学报, 2007, 7(3): 501-505.
Structural Characterization of Carboxymethylated Cassava Starch Prepared Based on Mechanical Activation
TAN Yi-qiu
(Department of Chemistry and Biology Engineering, Guangxi Normal University for Nationalities, Chongzuo 532200, China)
Cassava starch was mechanically activated for 60 min using a stirring type ball mill in order to provide activated cassava starch for preparing carboxymethylated starch using NaOH as a catalyst and ClCH2COOH as an etherification agent. The structure of carboxymethylated cassava starch was characterized by Fourier transform infrared spectroscopy (FTIR), scanning electron microscopy (SEM) and X-ray diffraction (XRD). After mechanical activation, the structure of cassava starch had no obvious changes. Carboxymethylation reaction could be observed on the surface and interior of activated cassava starch. Its carboxymethylated counterpart showed an irregular adhesive form and an aggregative state and maintained both the precarboxymethylation crystal structure and morphological features of starch granules. In contrast, carboxymethylation controlled on the surface area was mainly completed in the amorphous zone and partly in the crystalline area of inactivated cassava starch.
mechanical activation;carboxymethylated cassava starch;structural characterization
TS236.9
A
1002-6630(2010)13-0074-04
2009-11-25
广西省教育厅科研基金资助项目(200807 MS 111)
谭义秋(1967—),男,副教授,硕士,主要从事高分子材料的合成与改性研究。E-mail:tyq530202@163.com
