溶胶-凝胶血红蛋白电化学传感器的研制
2010-10-23武五爱郭满栋高宝平
武五爱,郭满栋,高宝平
(山西师范大学化学系,山西临汾041004)
溶胶-凝胶血红蛋白电化学传感器的研制
武五爱,郭满栋*,高宝平
(山西师范大学化学系,山西临汾041004)
运用溶胶-凝胶技术将血红蛋白(Hb)固载于玻碳电极(GC)表面,制得 Hb/Sol-Gel/GC修饰电极,找出了制备 Hb/Sol-Gel/GC修饰电极的最佳实验条件,建立了一种测定过氧化氢的新的、灵敏的方法.同时对该电极与过氧化氢的作用机理进行了探讨.
血红蛋白;溶胶-凝胶;生物传感器;修饰电极
血红蛋白(Hemoglobin,Hb)是体血液中红细胞的主要成分,尽管其不具备传递电子的功能,但由于它具有别构效应且对其结构已有较清楚的认识以及价廉易得,常常被选作探讨生物大分子电化学行为的理想模型物,国内外研究者对 Hb的结构与功能、电化学行为、小分子及金属离子与 Hb的相互作用等方面进行了大量的研究[1-4].近年来,人们发现溶胶-凝胶材料是一类非常适合于固定生物试剂的基质材料[5-9].凝胶过程通常在温和的条件下进行,可以很大程度地保持酶等生物物质的功能和活性[10-11].利用溶胶-凝胶技术固定各种生物试剂基质材料,制成的生物传感器具有灵敏度高、稳定性好、抗干扰能力强等特点[12-15].作者采用硅溶胶-凝胶技术制备了溶胶-凝胶固载血红蛋白的直接电化学传感器,找出了制备的最佳条件,并用多种方法对其电化学行为进行了研究.结果表明 Hb在膜中能够保持良好的生物活性和催化性质,且电极具有稳定性、重现性好,制备方法简便易行的优点.
1 实验部分
1.1 试剂与仪器
正硅酸乙酯(TEOS,中国医药集团上海化学试剂公司);十六烷基三甲基溴化铵(上海化学试剂采购供应站分装厂),牛血红蛋白(Hemoglobin,国药集团上海化学试剂有限公司);其他试剂均为分析纯.实验用水为二次蒸馏水.
L K98BⅡ微机电化学分析系统(天津兰力科化电子高技术有限公司);KQ-50超声洗涤器(上海超声仪器厂);UV-2201(日本岛津);p HS-3C型酸度计(上海伟业仪器厂).玻碳电极:直径d=2 mm(工作电极);铂丝电极(辅助电极);Ag/AgCl(饱和 KCl)电极(参比电极).
1.2 实验过程
1.2.1 玻碳电极的处理
将玻碳电极用氧化铝粉抛光,在二次水和无水乙醇中分别超声洗涤5 min,并重复3次,然后进行电化学活化处理,即在0.5 mol/L的 H2SO4中于-0.3 V~1.5 V进行循环伏安(CV)扫描,直到获得稳定的循环伏安响应.
1.2.2 储备液的配制
血红蛋白(Hemoglobin,Hb)储备液:称取50 mg牛血红蛋白,用水稀释,并定容至10 mL的容量瓶中,避光4℃保存,使用时逐级稀释.
溶胶-凝胶储备液:在室温下将1 mL正硅酸乙酯,0.2 mL 0.1 mol/L的HCl和3 mL水、10 mL乙醇混合于20 mL密封瓶中,超声震荡30 min,至形成均一溶胶液,密封存放于阴暗处.
表面活性剂储备液:称取0.25 g十六烷基三甲基溴化铵,加10 mL乙醇溶解,用水定容至25 mL,密封保存.
1.2.3 Hb/Sol-Gel/GC修饰电极的制备
取配制好的溶胶-凝胶储备液和表面活性剂储备液各1 mL,搅拌均匀后加入0.5 mL血红蛋白(Hemoglobin,Hb)储备液,置于一密闭容器中超声震荡5 min,使其分散均匀.吸取8μL该溶液,均匀涂敷在玻碳电极表面,置于4℃冰箱中干燥10 h以上,即可制得 Hb/Sol-Gel/GC修饰电极.该电极不用时可将其置于邻苯二甲酸氢钾缓冲液(p H=6)中并放入4℃冰箱中保存.相同条件下制备Sol-Gel/GC电极作为比较电极.
1.2.4 实验方法
电化学实验采用三电极体系:Ag/AgCl(饱和 KCl)电极为参比电极、铂丝为辅助电极、Hb/Sol-Gel/GC修饰电极为工作电极;缓冲液为邻苯二甲酸氢钾缓冲液(p H=6).实验时先向溶液中通氮气10 min,并保持缓冲液在实验过程中的氮气气氛.
2 结果与讨论
2.1 修饰电极的电化学行为
2.1.1 Hb/Sol-Gel/GC修饰电极的循环伏安行为
将干燥后的 Hb/Sol-Gel/GC电极从冰箱中取出,在空气中放置不同时间后放入邻苯二甲酸氢钾缓冲液(p H=6)中进行循环伏安扫描(扫描范围 -1.5 V~0.4 V,扫速为100 mV/s),如图1所示.图中曲线1为从冰箱中取出立即扫描所得曲线,可以看出在-0.450 V附近有一不可逆还原峰;随着电极在空气中放置时间的增加,发现在-0.450 V处还原峰逐渐消失,而在-0.891 V处有一新的不可逆还原峰出现,且随放置时间延长峰电流逐渐增大,在60 min后逐渐趋于稳定(曲线4);在溶液中加入1×10-5mol/L过氧化氢后-0.891 V处还原电流又显著上升(曲线5).而在相同条件下的Sol-Gel/GC修饰电极和裸电极上没有明显还原峰出现(曲线2,曲线3).
2.1.2 Hb和Sol-Gel的紫外-可见吸收光谱
用紫外-可见吸收光谱考察了 Hb在溶胶-凝胶溶液中的吸收曲线,结果如图2所示.其中图2a为溶胶-凝胶溶液的Soret吸收带曲线,图2b为 Hb的Soret吸收带曲线,图2c为 Hb在溶胶-凝胶溶液中的Soret吸收带曲线,通过比较可以看出血红蛋白在溶胶-凝胶中能够保持良好的生物活性和催化性质,没有发生变性.
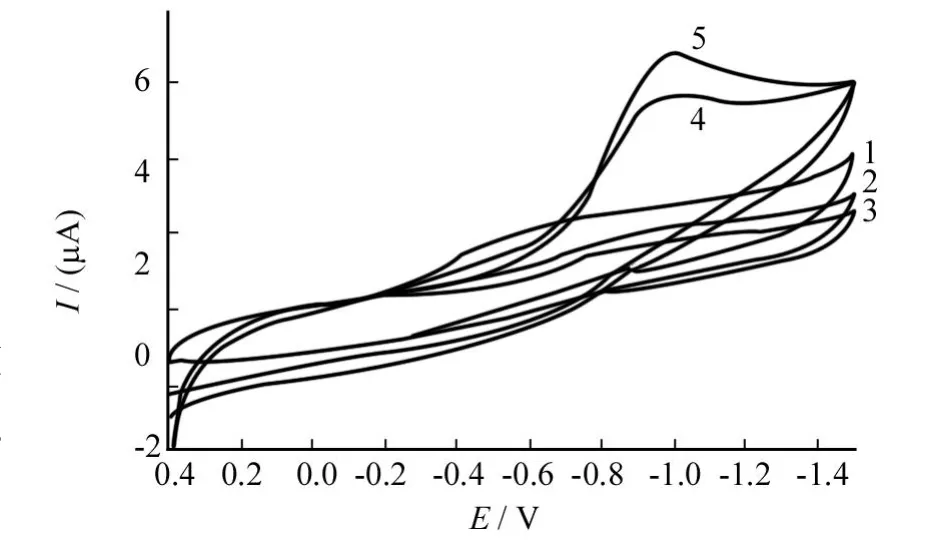
图1 Hb/Sol-Gel/GC修饰电极的循环伏安行为Fig.1 Cyclic voltammograms of Hb/Sol-Gel/GC modified electrode after different placed time
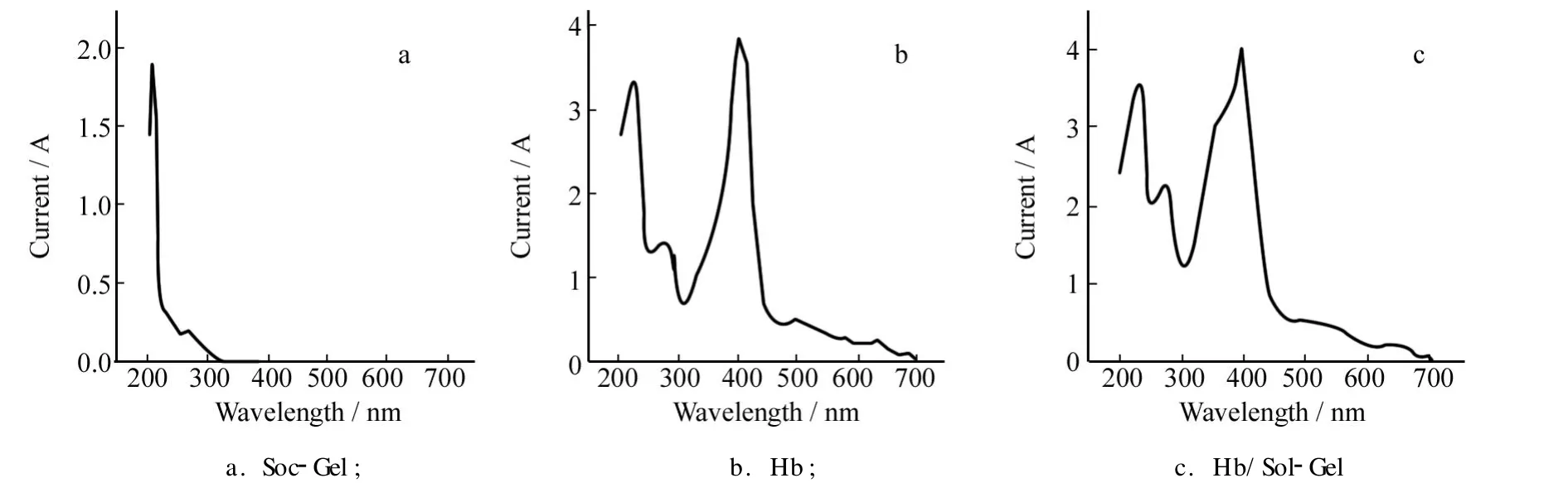
图2 Sol-Gel和 Hb的紫外-可见吸收光谱Fig.2 UV-Vis absorption spectra of Sol-Gel and Hb
2.2 实验条件优化
2.2.1 H2O与 TEOS的体积比对成膜性质的影响
H2O与 TEOS体积比是一个重要参数,直接与水解缩聚物的结构和溶胶的黏度和凝胶的时间有密切关系.较低的比值使Sol-Gel膜表面形成一些小的团聚,很难形成均一的薄膜,而且这样形成的Sol-Gel膜非常容易开裂.过高的比值使Sol-Gel膜表面的团聚过大,以至于血红蛋白很容易从表面上流失.为防止干燥过程较长产生较大的收缩张力,本实验制备Sol-Gel溶液时 H2O与 TEOS的最佳体积比为3∶1.
2.2.2 表面活性剂浓度对成膜性质的影响
在构建Sol-Gel膜的过程中,表面活性剂是一个非常重要的因素.因为凝胶中包裹着大量的溶剂和水,当它们从小孔中蒸发时,由于液体的表面张力造成的应力差易导致凝胶的开裂.表面活性剂由于挥发性低,吸附于电极表面能把不同孔径中醇的不均匀蒸发大大降低,有效地减少内部应力和表面张力,从而避免膜的开裂,并能够改善溶胶-凝胶表面的团聚现象.
本实验中采用不同浓度的十六烷基三甲基溴化铵为表面活性剂进行各种对比实验.结果表明当十六烷基三甲基溴化铵浓度为1 g/L,并与所配Sol-Gel溶液及 Hb溶液(或水)以体积比1∶1∶0.5混合时所制膜最稳定,不易开裂,且 Hb峰电流响应最好.
2.2.3 Hb在电极上的固载量对峰电流的影响
在其他条件固定的情况下,通过计算研究了玻碳电极(d=2 mm)上 Hb固载量对峰电流的影响,结果如图3所示,由图3可看出,随着 Hb固载量的增加,还原峰电流逐渐增大.但当固载量超过1.6μg时峰电流呈现下降趋势,这是由于当Hb固定量过大时,使包埋Hb的环境发生改变,电极表面的分布趋于复杂,膜的厚度也随之增加,降低了电子的传递能力,从而造成了电极响应电流有下降的趋势.因此本实验选1.6μg为Hb在电极上的最佳固载量.
2.2.4 测定介质对峰电流的影响
研究了Hb/Sol-Gel/GC电极分别在不同缓冲溶液如磷酸盐缓冲溶液、Tris缓冲溶液以及邻苯二甲酸氢钾缓冲液(p H调至约6、扫速100 mV/s)中的电化学行为,结果发现 Hb/Sol-Gel/GC电极在三种缓冲溶液中均表现为不可逆还原,且在邻苯二甲酸氢钾缓冲液中电流响应最大,峰电流最高.故选择邻苯二甲酸氢钾缓冲液为支持电解质.
2.2.5 扫描速率对峰电位的影响
研究了扫描速率对-0.891 V处峰电位的影响,结果发现,还原峰电位 E(V)随扫描速率v(V/s)的增大而负移.在0.005 V/s~0.7 V/s范围内,E与lgv的线性方程为 E =0.062 2 lgv+1.126 7(R2=0.992 8),从曲线的斜率[0.5×2.303R T×(anF)-1],可得αn=0.475,取α=0.5,可计算得 n≈1;由此可见该峰为1电子不可逆的还原峰.
2.2.6 p H对峰电位、峰电流的影响
在优化的实验条件下,用循环伏安法研究了不同酸度对-0.891 V处还原峰电流的影响,结果见图4.由图4可以看出,当p H ≤6时,传感器的响应电流随着p H值的增加而增大,而当p H过大时峰电流又逐渐减小,这主要是因为血红蛋白的活性依赖于p H范围(正常人体生理范围为6~8.5),过低或过高的p H降低了血红蛋白的活性.因此,选p H=6作为本实验的最适p H.
实验同时考察了p H在4~8范围内酸度对-0.891 V处峰电位的影响,结果发现,随着p H的增大,还原峰电位正移,表明电极反应中有质子参与.并根据公式dEp/dp H=0.059X/n(式中 X为质子数,n为电子数),求得 X≈1.
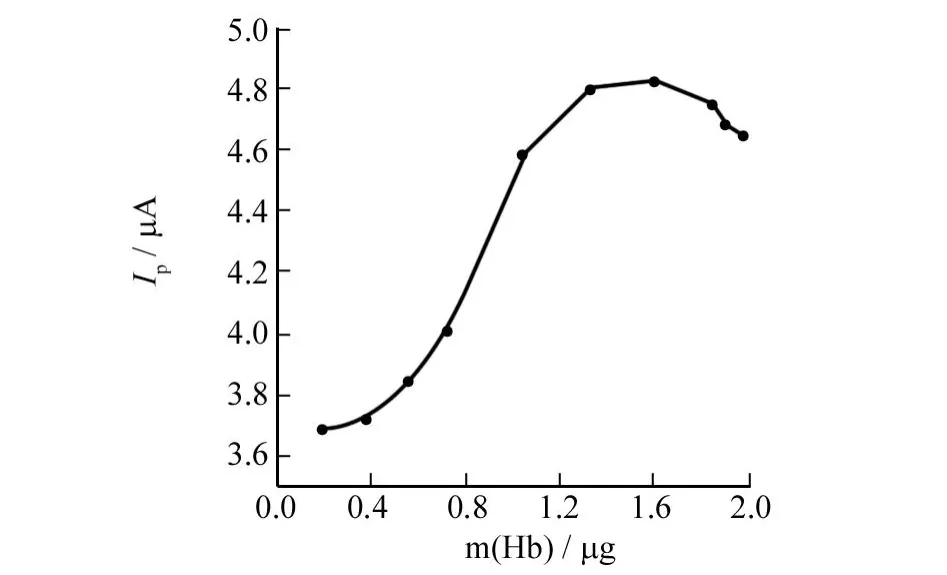
图3 Hb固载量与峰电流的关系Fig.3 Relation between Hb quantity and peak current
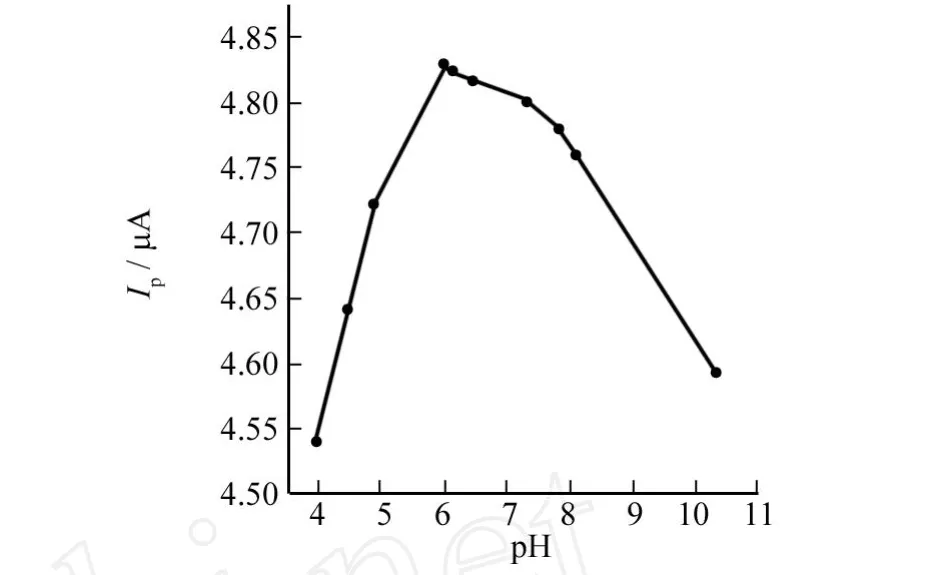
图4 p H对峰电流的影响Fig.4 Effects of p H on peak current
2.3 电极机理反应探讨
结合以上实验现象,本文对血红蛋白在 Hb/Sol-Gel/GC电极上的电化学行为进行了详细探讨,得出以下结论:
Hb/Sol-Gel/GC电极先后在-0.450 V和-0.891 V处产生的还原峰是由包埋在修饰物中的 Hb产生,且由于电极表面有机介质和表面活性剂的影响,电子转移的可逆性受到抑制,为不可逆过程;而-0.450 V处还原峰的消失和-0.891 V处还原峰的出现则是由于Hb具有别构效应,高亲氧态(R态,0.450 V处)与低亲氧态(T态,0.891 V)间的构象转变[16-17]:
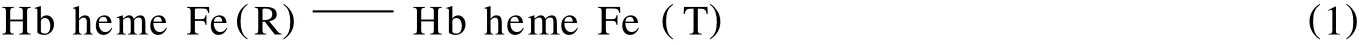
在-0.891 V处产生还原峰电流,是由于Hb Fe heme(T)中一个血红素辅基在电化学驱动下被溶液中残氧氧化,发生一个电子转移:
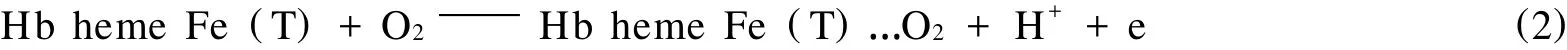
在加入过氧化氢后-0.891 V处还原电流显著上升,则是Hb Fe(T)中一个血红素辅基在电化学驱动下被 H2O2氧化所导致:
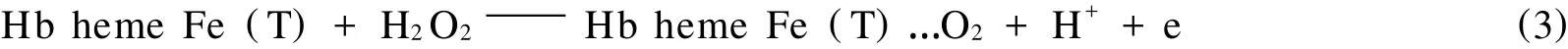
实验表明,将使用过的Hb/Sol-Gel/GC电极悬置在缓冲溶液中一段时间(约30 min)可发现其又恢复至初态,体现了较好的重复性.其反应机理可能是:
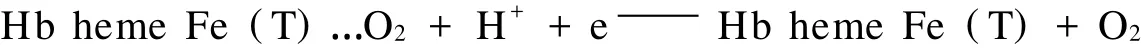
2.4 Hb/Sol-Gel/GC修饰电极的稳定性
稳定性是衡量电极实用性的重要指标.因此,我们考察了 Hb/Sol-Gel/GC修饰电极与其还原电流在缓冲溶液中保存时间的关系.结果发现,将 Hb/Sol-Gel/GC修饰电极密封悬置在邻苯二甲酸氢钾缓冲液(p H=6)中,在4℃冰箱中保存23天,其峰电流仅下降12%,表明电极是比较稳定的.
2.5 Hb/Sol-Gel/GC修饰电极对 H2O2的响应
在优化的实验条件下,用方波伏安法(电位范围:-0.4~ -1.2 V,电位增量50 mV,方波频率5Hz,方波幅度50 mV)考察了修饰电极对 H2O2的响应,发现还原峰电流与 H2O2浓度分别在4.0×10-6~4.3×10-5mol/L(R2=0.993 6)及4.3×10-5mol/L~6.5×10-5mol/L(R2=0.986 1)范围内成线性关系,检测限为2×10-6mol/L(S/N=3).
3 结论
利用溶胶-凝胶技术将血红蛋白固载于玻碳电极表面,并用循环伏安法、方波伏安法和紫外-可见吸收光谱研究了血红蛋白在修饰电极上的电化学行为.实验发现血红蛋白包埋在溶胶-凝胶中,能在玻碳电极上实现蛋白质的直接电子转移,表明溶胶-凝胶与血红蛋白有较好的生物兼容性.实验同时找出了 Hb/Sol-Gel/GC修饰电极的最佳制备条件,表明该传感器具有制作方法简单,有较好重现性、稳定性以及高灵敏度等优点,在生化和临床过氧化氢检测中可望得到较为广泛的应用.
[1]Gu H Y,Yu A M,Chen H Y.Direct electron transferand characterization of hemoglobin immobilized on an aucolloid-cysteamine-modified gold electrode[J].Electroanal Chem,2001,516:119-126.
[2]Ellerby L M,Nishida C R,Nishida F,et al.Encap sulation of protein in transparent porous silicate geasses prepared by the sol-gel method[J].Science,1992,255:1113-1115.
[3]刘传银,李学强,陆光汉.碳糊电极在有机物电化学分析中的应用[J].化学研究与应用,2005,17(4):443-447.
[4]王全林,杨宝军,吕功煊,碳糊电极上无机膜固载血红蛋白的直接电化学[J].高等学校化学学报,2003,24(9):1561-1566.
[5]Wang Q L,Lu G X,Yang B J.Direct electrochemistry and electrocatalysis of hemoglobin immobilized on carbon paste electrode by silica sol-gel film[J].Biosens Bioelectr,2004,19:1269-1275.
[6]Wang Q L,Lu G X,Yang B J.Hydrogen peroxide biosensor based on direct electrochemistry of hemoglobin immobilized on carbon paste electrode by a silica sol-gel film[J].Chemical,2004,99:50-57.
[7]Liu H,Wang L,Hu N.Electrocatalysis by a C60cyclodextrin(1∶2)and nafion chemically modified electrode of hemoglobin[J].Electrochim Acta,2002,47:2515-2523.
[8]Jiang Z,Zuo Y.Incorporation of horseradish peroxidase in akieselguhr membrane[J].A nal Chem,2001,73(2):686-692.
[9]Bach U,Deng L P,Paul C,et al.Optimization of 1,2-dimethyl-3-propylimidazolium iodide concentration in dyesensitized solar cells[J].N ature,1998,395(5):583-588.
[10]Hulteen J C,Treichel D A,Smith M.Size and shape controlled fabrication of large-area periodic nanopillararrays[J].Phys Chem B.1999,103(4):3854-3859.
[11]Wen J Y,Wilkes GL.Synthesis of polystyrene-silica hybrid mesoporous materialsviathe nonsurfactant templated sol-gel process[J].Chem Mater,1996,8(3):1667-1673.
[12]宋昭,黄加栋,史海滨,等.纳米碳管修饰铂结合溶胶-凝胶固定酶制备高性能胆碱生物传感器[J].分析化学,2006,34(7):910-914.
[13]李建平,彭图治.溶胶-凝胶法固定胆固醇氧化酶偶联普鲁士蓝化学修饰电极的研究[J].高等学校化学学报,2003,24(5):798-820.
[14]黄加栋,史海滨,陈强,等.基于溶胶-凝胶技术结合多壁纳米碳管化学修饰电极的方法制备高灵敏葡萄糖生物传感器的研究[J].高技术通讯, 2006,16(5):492-496.
[15]李亚卓,张素霞,孙长青,等.基于溶胶-凝胶技术的聚烯丙胺基二茂铁化学修饰电极的组装及其对抗坏血酸的电催化氧化[J].高等学校化学学报,2003,24(8):1373-1376.
[16]关凌霄,王全林.血红蛋白在有机溶剂中的电化学行为及其类酶电催化研究[J].化学研究与应用,2006,18(9):1035-1040.
[17]高筱玲,郭彦,田燕妮,等.表面活性剂与血红蛋白的作用对转移电子数的影响[J].物理化学学报,2007,23(8):1178-1182.
Preparation of Modified Glassy Carbon Electrode with Hemoglobin Immobilized via Sol-Gel Route
Hemoglobin(Hb)was modified on the surface of glassy carbon(GC)electrode by sol-gel technology to generate a steady Hb/Sol-Gel/GC electrode.The optimal condition for preparing Hb/Sol-Gel/GC electrode was investigated,and a new sensitive analysis method for determination of H2O2is established based on the modified GC electrode.At the same time,the response mechanism between Hb/Sol-Gel/GC and H2O2is discussed.
hemoglobin;sol-gel;biosensor;modified electrode
O 657.1
A
1008-1011(2010)05-0063-05
2010-06-08.
山西省自然科学基金资助项目(20001057).
武五爱(1977-),男,副教授,主要从事电分析化学研究.*
.E-mail:guomd@dns.sxnu.edu.cn.
