致病溶藻弧菌脂多糖对点带石斑鱼毒性和免疫原性的影响
2010-10-23徐先栋谢珍玉王世锋宣雄智周永灿
徐先栋, 谢珍玉, 王世锋, 宣雄智, 周永灿
(海南大学 海洋学院, 海南省热带水生生物技术重点实验室, 海南 海口 570228)
致病溶藻弧菌脂多糖对点带石斑鱼毒性和免疫原性的影响
徐先栋, 谢珍玉, 王世锋, 宣雄智, 周永灿
(海南大学 海洋学院, 海南省热带水生生物技术重点实验室, 海南 海口 570228)
以热酚水抽提法提取致病溶藻弧菌(Vibrio alginolyticus)粗脂多糖(Lipopolysaccharides, LPS), 并将不同浓度的溶藻弧菌粗LPS通过腹腔注射法接种点带石斑鱼(Epinephelus coioides), 研究该LPS对点带石斑鱼毒性和免疫原性的影响, 并同弱致病溶藻弧菌粗LPS及高纯度大肠杆菌(Escherichia coli)LPS对石斑鱼的刺激效果进行比较。结果表明: 溶藻弧菌致病株和弱致病株粗LPS均对石斑鱼具有比较强的毒性, 溶藻弧菌LPS对石斑鱼的免疫原性随LPS浓度的增高而增强, 高纯度大肠杆菌LPS对石斑鱼的免疫原性效果要优于溶藻弧菌粗LPS。
溶藻弧菌(Vibrio alginolyticus); 脂多糖; 毒性; 免疫原性
脂多糖(Lipopolysaccharides, LPS)是位于革兰氏阴性菌(G-)细胞壁最外层的类脂多糖类物质, 是 G-病原菌致病物质内毒素的物质基础[1], 同时, LPS也具有良好的免疫原性, 可以刺激增强受免机体的免疫力[2~4], 为鱼用免疫制剂的研究和应用提供了一条良好途径。目前, 有关 LPS对水产动物免疫原性影响的研究报道很多[5~8], 但将LPS的毒性及免疫原性结合起来研究报道较少, 为此, 本研究利用热酚水抽提法[9]提取的海水养殖动物常见病原菌——溶藻弧菌(Vibrio alginolyticus)的LPS, 并以该LPS为研究对象, 对致病力不同的溶藻弧菌粗制 LPS的毒性进行了初步的比较, 同时, 也选择了高纯度大肠杆菌(Escherichia coli)作为对照, 比较溶藻弧菌粗制 LPS与高纯度的大肠杆菌 LPS 对点带石斑鱼(Epinephelus malabaricus)的免疫刺激效果。
1 材料与方法
1.1 材料
1.1.1 供试菌及LPS试剂
本实验采用的致病菌株 HN08155为 2006年 5月从海南陵水某石斑鱼养殖鱼排患病点带石斑鱼(Epinephelus malabarieus),体内分离获得的菌株, 经分离纯化, 生化鉴定, 及溶藻弧菌快速检测试剂盒(专利号: ZL01130127.9, 中国科学院南海海洋研究所)鉴定和攻毒实验确定为致病性溶藻弧菌, Genbank登录号 FJ906748。弱致病菌株 HN07006为 2006年 6月从海南海口周边海域水体中分离, 经纯化, 生化鉴定, 溶藻弧菌快速检测试剂盒鉴定和攻毒实验确定为弱致病性溶藻弧菌, Genbank登录号FJ906747。菌种于-80℃冰箱保存。
1.1.2 实验石斑鱼
实验用点带石斑鱼购自海南陵水养殖场, 为体质量50 g±10 g的无患病史的健康个体。试验鱼在室内玻璃水族缸(50 cm×40 cm×50 cm)中经7 d充气暂养无异常后按实验要求分组, 每个水族箱放养点带石斑鱼8尾, 每天定时投喂新鲜小杂鱼1次, 投喂量为鱼体质量的1.0%, 实验水温为28 ℃±2 ℃。
1.2 方法
1.2.1 脂多糖的提取
脂多糖的提取按改良的热酚水抽提法[9]进行,具体如下:
A. 经扩大培养的菌液以5 000 r/min 离心5 min,沉淀称湿质量, 收集后置4 ℃保存;
B. 取5 g 细菌悬浮于15 mL浓度为50 mmol/L的磷酸缓冲液(pH 7.0, 内含5 mmol/L的EDTA)中,-80 ℃作用15 min, 室温解冻, 反复冻融 5次;
C. 加入100 mg 溶菌酶, 4 ℃过夜, 再在37 ℃温育30 min;
D. 加入 50 mmol/L磷酸缓冲液(pH 7.0, 内含5 mmol/L EDTA, 20 mmol/L MgCl2) 至 30 mL, 加入RNase和 DNase 加至终质量浓度为 5 μg/mL, 悬液37 ℃温育 3 h; 加入蛋白酶 K, 至终质量浓度为5 μg/ mL, 50 ℃温育 2 h;
E. 置于 70 ℃的水浴中平衡后, 加入相同体积的预热至70 ℃的酚, 充分剧烈混合并作用20 ~ 30 min;
F. 用冰水浴快速冷却15 min, 10 000 r/min离心(4 ℃ )15 min,离心后分3层(由上至下分别为含LPS的水层、含变性蛋白的酚层和含其他物质的不溶层),小心吸取上层水相装于透析袋;
G. 用蒸馏水透析3 d(4 ℃), 每天换水数次;
H. 聚乙二醇2 000浓缩为原来体积的1/4;
I. 1500 r/min离心 30 min, 弃沉渣, 收集上清,经冷冻干燥后-20 ℃保存备用。
1.2.2 脂多糖的检测
所分离的LPS先经十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳, 再以Tsai 等[10]的方法银染检测。
1.2.3 LPS毒性试验
LPS毒性试验按以下方法进行分组: 第1~7组为腹腔注射以灭菌磷酸缓冲液(PBS, pH7.2)配制的溶藻弧菌HN08155菌株粗制LPS溶液, 其质量浓度分别为80、40、20、10、5、2.5和1.25 g/L; 第8组为腹腔注射以灭菌PBS配制的溶藻弧菌HN07006菌株粗制LPS溶液, 其质量浓度为40 g/L; 第9组为腹腔注射购自 Sigma公司的大肠杆菌LPS溶液, 其浓度为2 g/L; 第10组为对照组, 腹腔注射无菌PBS。上述配制的各组LPS溶液经65 ℃加热10 min[6], 每组分别注射8尾点带石斑鱼, 注射剂量为0.1 mL/尾。每组设置1个重复(每组接种16尾石斑鱼)。首次接种7 d后, 对存活的各组实验点带石斑鱼再以相同的方法加强注射1次。每天观察, 统计各组点带石斑鱼的死亡率。
1.2.4 LPS免疫原性测定
第2次注射LPS 28 d后, 取具有统计学意义(即实验石斑鱼数量≥5尾, 或加上重复组实验石斑鱼数量≥10尾)[13]的实验组和对照组进行 LPS免疫原性测定。每组随机捞取5尾供试点带石斑鱼, 尾静脉取血。每尾鱼的血液分2份, 先取约50 μL添加肝素抗凝, 按沈萍等[11]方法测定吞噬细胞的吞噬活性; 剩余部分不添加肝素, 于室温下倾斜放置 1 h后, 置4 ℃冰箱过夜, 1 000 r/min离心10 min分离血清,-20 ℃保存备用, 用于测定血清抗菌活性、溶菌活性和酚氧化酶(PO: Polyphenol oxidase)活性, 测定方法同王雷等[12]方法。
2 结果
2.1 LPS的提取及检测
用 2216E培养液分别培养 2 L 溶藻弧菌HN08155菌株和HN07006菌株, 培养36 h后离心各得菌液45 mL。采用改良的热酚水抽提法获得粗LPS溶液各50 mL。分别取溶藻弧菌HN08155菌株粗制LPS溶液和HN07006菌株粗制LPS溶液10 μL, 经SDS-PAGE电泳检测和银染, 结果(图 1)表明, 溶藻弧菌HN08155菌株粗制LPS和HN07006菌株粗制LPS存在明显差异, 其中, HN07006菌株的LPS明显可见8条分子质量大小不一的条带, 而HN08155菌株的 LPS除 2条明显可辨的小分子质量条带外, 其他部分呈弥散状态。
图 1各胶孔处未见染色表明无残留不溶于水的多糖类物质, 且 LPS提取过程中使用大量蛋白酶 K处理, 避免蛋白质污染, 因而本实验所提的 LPS具有较高的纯度。本实验所得溶藻弧菌HN08155菌株粗制LPS和溶藻弧菌HN07006菌株粗制LPS浓缩溶液各 30 mL, 经冷冻干燥后, 分别获得干燥的粉末512 mg和351.7 mg。

图1 不同LPS的SDS-PAGE电泳检测银染结果Fig. 1 The silver-stain result of SDS-PAGE for different LPSs1. 溶藻弧菌HN08155菌株粗制LPS; 2. 溶藻弧菌HN07006菌株粗制LPS; 3.大肠杆菌(E.coli)LPS1. the rough LPS of V. alginolyticus HN08155; 2. the rough LPS of V. alginolyticus HN07006; 3. the LPS of E.coli
2.2 LPS对点带石斑鱼的毒性
通过腹腔注射溶藻弧菌致病菌株HN08155和弱致病菌株 HN07006粗制 LPS溶液和大肠杆菌 LPS溶液, 检测 LPS溶液对点带石斑鱼的毒性结果表明(表1), 溶藻弧菌致病菌株HN08155粗制LPS注射剂量在0.25 mg/尾以下时, 实验点带石斑鱼100%成活;注射剂量达0.5 mg /尾以上时, 实验石斑鱼开始死亡;注射剂量达4 mg/尾以上时, 死亡率达100%。溶藻弧菌弱致病性菌株 HN07006粗制 LPS注射剂量为 4 mg/尾时, 实验石斑鱼死亡率也达到 100%, 说明溶藻弧菌致病菌株 HN08155和弱致病菌株 HN07006粗制 LPS对点带石斑鱼均具有较强的毒性, 并且,实验中可观察到点带石斑鱼濒死前出现抽搐症状。大肠杆菌LPS的注射剂量为0.2 mg/尾时, 实验点带石斑鱼未出现死亡现象。
2.3 吞噬细胞的吞噬活性
LPS经毒性检测后, 根据在数量上具有统计学意义的原则(即实验石斑鱼数量≥5尾, 或加上重复组实验石斑鱼数量≥10尾)[13], 取实验组 4、组 6、组7、组9和对照组10进行免疫活性测定, 其中, 各组吞噬细胞的吞噬活性的测定结果见表2。结果表明,各实验组点带石斑鱼血液中吞噬细胞的吞噬率和吞噬指数均显著高于对照组(P<0.05)。其中, 在溶藻弧菌致病性菌株HN08155粗制LPS的安全接种范围内,点带石斑鱼血液吞噬细胞的吞噬活性随该LPS的接种剂量增加而增强; 溶藻弧菌致病性菌株 HN08155粗制LPS的接种量为1 mg/尾时(实验第4组), 对石斑鱼血液吞噬细胞的吞噬活性与接种0.2 mg/尾的大肠杆菌LPS相当。
2.4 血清的抗菌活性、溶菌活性及酚氧化酶活性
点带石斑鱼经LPS加强免疫刺激28 d后, 其血清进行溶菌活性、抗菌活性及酚氧化酶活性检测, 结果见表3和表4。由表3可见, 注射0.2 mg/尾大肠杆菌 LPS组各项指标表现为最强, 显示大肠杆菌 LPS对点带石斑鱼产生良好的免疫刺激效果, 注射1 mg/尾量的溶藻弧菌致病菌株HN08155粗制LPS组点带石斑鱼的效果次之, 接种低浓度(0.25 mg/尾和0.125 mg/尾)溶藻弧菌致病菌株HN08155粗制LPS组对石斑鱼血清的溶菌活性、抗菌活性及酚氧化酶活性的刺激作用最差。

表1 不同LPS对点带石斑鱼的毒性Tab. 1 The lethalities of different LPSs on E. malabaricus
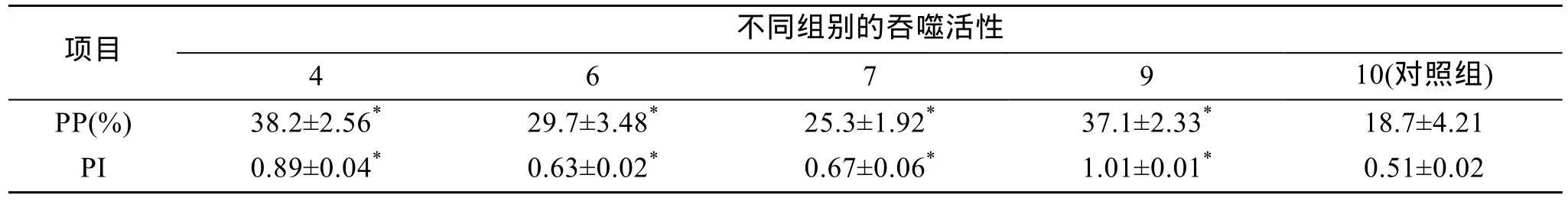
表2 点带石斑鱼血液中吞噬细胞吞噬活性比较Tab. 2 Comparison of phagocytic activities of leucocytes of E. malabaricus immunized by different LPSs
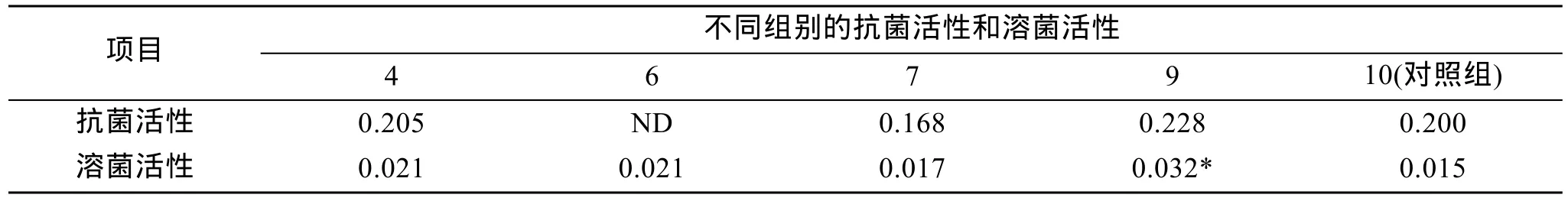
表3 LPS对点带石斑鱼血清及抗菌活性和溶菌活性的影响Tab. 3 The influences of LPSs on serum antibacterial and lysozyme activities in E. malabaricus

表4 LPS对点带石斑鱼血清酚氧化酶活性的影响Tab. 4 The influences of LPS on serum phenol oxidase (PO) activities in E. malabaricus
3 讨论
已有研究表明, 不同来源的 LPS对水产动物都具有较强的毒性, 在一定浓度范围内, 随着接种剂量的增加, 其致死率也随着增加。叶剑敏等[13]以 17 mg/kg鱼的剂量为40 ~ 70 g赤点石斑鱼接种溶藻弧菌 LPS, 可造成 40%供试石斑鱼死亡; 周永灿等[14]以嗜麦芽假单胞菌 LPS接种卵形鲳 , 结果表明该LPS对卵形鲳 (Trachinotus ovatus)最低致死剂量大于80 mg/kg; 陈昌福等[15]以鱼害粘球菌(Myxococcus piscicola)LPS腹腔接种草鱼, 结果表明该 LPS对50 ~100 g草鱼造成伤害的剂量为5 mg/kg, 全致死剂量为 25 mg/kg; 张建设等[16]测定的副溶血弧菌 LPS对牙鲆的最低致死剂量为 60 mg/kg; 此外, 陈昌福等[17]以45 mg/kg 鱼的剂量对鳜(Siniperca chuatsi)接种嗜水气单胞菌 LP却未发现中毒症状; Matsuyama等[18]以2 ~ 10 mg/kg的多种LPS接种鲤鱼也未发现异常反应。本研究用热酚水抽提法提取的溶藻弧菌粗 LPS对点带石斑鱼的毒性研究结果也表明, 该溶藻弧菌粗提 LPS对点带石斑鱼也具有较强毒性, 粗LPS的接种量为 9 mg/kg时, 点带石斑鱼致死率为65.5%; 而粗LPS接种量为72 mg/kg时, 受免点带石斑鱼的死亡率为100%。作者制备的溶藻弧菌粗LPS对点带石斑鱼的最低致死剂量为5 mg/kg, 其毒性与陈昌福等[15]制备的鱼害粘球菌 LPS相当, 但强于叶剑敏等[13]制备的溶藻弧菌 LPS、周永灿等[14]制备的嗜麦芽假单胞菌 LPS、张建设等[16]制备的副溶血弧菌LPS、陈昌福等[17]制备的嗜水气单胞菌LPS以及Matsuyama等[18]研究的多种LPS。
作者对致病性溶藻弧菌菌株HN08155粗制LPS和弱致病性溶藻弧菌菌株HN07006粗制LPS对点带石斑鱼的毒性差异研究结果表明, 尽管两者SDS-PAGE 条带的银染结果存在明显差异, 但它们对点带石斑鱼毒性相当, 以4 mg/尾的用量接种50 g左右的点带石斑鱼后, 两者均可造成接种石斑鱼100%死亡, 这说明溶藻弧菌LPS的2条分子质量最小条带不是其菌株毒力的主要成分, 同时也表明LPS不是溶藻弧菌关键毒力因子。
国内外很多研究报道均表明, LPS对水产动物具有良好的免疫保护作用。本研究结果表明, 以 1 mg/尾的剂量对点带石斑鱼接种(实验第 4组)的 LPS后, 血液中白细胞吞噬活性、血清抗菌活性、溶菌活性及酚氧化酶活性与对照组相比均明显增强, 说明溶藻弧菌的 LPS也对提高点带石斑鱼非特异性免疫保护力作用显著。但本研究结果也表明, 产生良好免疫保护作用的LPS剂量对实验动物也产生一定的毒性, 一般情况下, 在安全剂量范围内的 LPS对点带石斑鱼的免疫保护效果不强, 因此, 应用溶藻弧菌LPS作为免疫制剂需权衡其毒性和免疫保护作用的利弊, 这与鄢庆枇等[19]利用该菌的 LPS对大黄鱼(Pseudosciaena crocea Richardson)毒性和免疫效果研究结果一致。不过, 简纪常等[5]利用3.2 mg/尾剂量的溶藻弧菌 LPS接种 40 ~ 70 g赤点石斑鱼(Epinephelus akaara)的研究结果则表明, 该浓度的溶藻弧菌 LPS不但对赤点石斑鱼没有毒性, 还可诱导提高赤点石斑鱼的非特异性免疫功能, 说明不同试验动物对溶藻弧菌LPS的敏感性可能存在差异。此外, 本研究采用低剂量(0.2 mg/尾)、高纯度的大肠杆菌LPS刺激点带石斑鱼的结果也表明, 该LPS不仅对实验点带石斑鱼没有明显毒性, 比本研究制备的溶藻弧菌 LPS还有更好的免疫保护效果, 说明不同菌种来源的LPS对点带石斑鱼的毒性和免疫保护作用也可能存在差异。
[1] 周德庆. 微生物学教程[M]. 第二版. 北京:高等教育出版社, 2002. 15.
[2] Kawai K, Kusuda R. Efficacy of the lipopolysaccharide vaccine against virbriosis in cultured ayu[J]. Bull Jap Soc Sci Fish, 1983, 49(4): 511-514.
[3] Ingram G A, Alexander J B. The immune response of brown trout Salmo trutta to lipopolysaccharide[J].J Fish Biol, 1980, 16(2): 181-197.
[4] 陈昌福, 陈超然. 鱼类三种致病菌的粗脂多糖对异育银鲫的免疫原性[J]. 水生生物学报, 2002, 26(5):483-488.
[5] 简纪常, 叶剑敏, 吴灶和. 溶藻弧菌脂多糖对石斑鱼免疫功能的影响[J]. 水生生物学报, 2004, 28(1):103-105.
[6] 陈昌福, 吴志新. 三种爱德华氏菌脂多糖对日本鳗鲡免疫原性的比较[J]. 水生生物学报, 1998, 22(增刊):126-131.
[7] Solem S T, Jørgensen J B, Roberrtsen B. Stimulation of respiratory burst and phagocytic activity in Atlantic salmon(S. salar L)macrophages by lipopolysaccharide[J].Fish and Shellfish Immunology, 1995, 5: 475-491.
[8] Salati F, Kawai K, Kusuda R. Immune response of eel to Edwardsiella tarda lipopolysaccharide[J]. Fish Path,1984, 19: 187-192.
[9] Westphal O, Jann K. Bacterial lipopolysaccharide extraction with phenol-water and further applications of the procedure[J]. Methods Carbohydr Chem, 1965, 5:83-91.
[10] Tsai C M , Frasch C E. A sensitive silver stain for detecting lipopolysaccharides in polyacrylamide gels[J].Anal Biochem, 1982, 119: 115-119.
[11] 沈萍, 范秀容, 李广武. 微生物学实验[M]. 第三版.北京: 高等教育出版社, 1999. 162-163.
[12] 王雷, 李光友, 毛远兴, 等.口服免疫型药物对养殖中国对虾病害防治作用的研究[J]. 海洋与湖沼, 1994,25(5): 486-491.
[13] 叶剑敏, 简纪常, 吴后波, 等. 溶藻弧菌脂多糖的化学成分分析及其对石斑鱼的毒性[J].水生生物学报,2004, 28(5): 574-576.
[14] 周永灿, 张本, 陈雪芬, 等. 嗜麦芽假单胞菌脂多糖的制备及其在卵形鲳 中的免疫效应[J]. 水产学报,2002, 26(2): 143-148.
[15] 陈昌福, 纪国良. 草鱼对鱼害粘球菌类脂多糖的免疫反应[J]. 淡水渔业, 1989, 4: 3-5.
[16] 张建设, 周丽, 邢婧, 等. 致病性副溶血弧菌脂多糖的制备及其对牙鲆的免疫效应[J]. 中国海洋大学学报, 2004, 34(4): 571-576.
[17] 陈昌福, 邓建平, 楠田理一. 不同方法提取的嗜水气单胞菌脂多糖对鳜免疫活性的比较[J]. 华中农业大学学报, 1999, 10: 469-471.
[18] Matsuyama Y H, Mangindaan R E P. Polysaccharide-induced protection of carp, Cyprinus carpio against bacterial infection[J]. J Fish Dis, 1991, 14: 577-582.
[19] 鄢庆枇, 苏永全, 王军, 等. 溶藻弧菌脂多糖对大黄鱼的毒性与免疫保护性试验[J]. 台湾海峡, 2003, 22:163-167.
Toxicity and immunogenicity of LPS from pathogenic Vibrio alginolyticus to grouper, Epinephelus malabaricus
XU Xian-dong, XIE Zhen-yu, WANG Shi-feng, XUAN Xiong-zhi, ZHOU Yong-can
(Key Laboratory of Tropical Aquatic Biotechnology of Hainan Province; College of Marine Science, Hainan University, Haikou 570228, China)
Apr., 20, 2009
Vibrio alginolyticus; lipopolysaccharides; toxicity; immunogenicity
In order to study the toxicity and immunogenicity of the LPS from pathogenic Vibrio alginolyticus to Epinephelus malabaricus, the crude LPS was extracted by hot phenol-water extraction, and was intraperitoneally injected to healthy groupers at different concentrations. It was found that crude LPSs from both the pathogenic strain and the weak pathogenic strain of V. alginolyticus were highly toxic to groupers. The immunogenicity of the crude LPS from V. alginolyticus to the groupers was enhanced at elevated concentrations of LPS. The immunogenicity of high purity LPS from E.coli to the groupers was better than the crude LPS from V. alginolyticus.
S942.5
A
1000-3096(2010)03-0047-05
2009-04-20;
2009-08-19
国家自然科学基金项目(30660144); 新世纪优秀人才支持计划项目(NCET-05-0755); 海南大学2009年度科研项目(hd09xm57)
徐先栋(1982- ), 男, 江西鄱阳人, 硕士研究生, 研究方向:水生生物病害及其控制, 电话: 15270927610, E-mail: xuxd2009@163.com,周永灿, 通信作者, E-mail: zychnu@163.com
(本文编辑: 康亦兼)
