可口革囊星虫人工繁殖试验
2010-10-23吴洪喜曾国权周志明蔡景波黄振华
吴洪喜, 陈 琛, 曾国权, 周志明, 蔡景波, 彭 欣, 黄振华
(1. 浙江省海洋水产养殖研究所, 浙江 温州 325005; 2. 浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
可口革囊星虫人工繁殖试验
吴洪喜1,2, 陈 琛1, 曾国权1, 周志明1, 蔡景波1,2, 彭 欣1,2, 黄振华1,2
(1. 浙江省海洋水产养殖研究所, 浙江 温州 325005; 2. 浙江省近岸水域生物资源开发与保护重点实验室,浙江 温州 325005)
采用亲体培养、人工催产和幼虫培养等方法研究了可口革囊星虫(Phascolosoma esculenta)的人工繁殖技术。结果表明, 可口革囊星虫亲体可室内培养成熟; 阴干和降温刺激亲体能达到较好的催产效果; 球等鞭金藻(Isochrysis galbans)和亚心形扁藻(Platymonas sp.)可作为海球幼虫的主要饵料。海球幼虫体长生长速度较快, 日增长高达46 μm, 孵化后一周内, 幼虫体长达500 μm, 然后开始附着营埋栖生活。
可口革囊星虫(Phascolosoma esculenta); 亲体培养; 人工催产; 人工繁殖; 海球幼虫
可口革囊星虫(Phascolosoma esculenta), 俗称泥蒜、沙虫, 隶属于星虫动物门(Sipuncula)、革囊星虫纲(Phascolosomatidea) 革囊星虫目(Phascolosomatiformes)、革囊星虫科(Phascolosomatidae)、革囊星虫属(Phascolosoma)。可口革囊星虫喜欢栖息在中、高潮区的泥质或沙泥质滩涂, 中国的山东、浙江、福建、广西、广东和海南等沿海地区均有分布[1~3]。
可口革囊星虫具有丰富的营养成分[4~7]和保健功能[8~12], 不仅是海洋底栖经济鱼类和甲壳类的天然饵料, 而且还是人类喜食的海产动物。用其制成的胶冻称之为“泥蒜冻”、“土笋冻”、“土蒜冻”。目前,可口革囊星虫的人工养殖已在浙江省乐清市和温岭市等地取得成功[13,14], 但养殖苗种仍依赖于自然海区。迄今, 关于星虫类动物的繁殖生物学和发生的研究论文已有发表[15~20], 但未见其人工繁殖取得成功的报道。作者总结了自己2005年、2006年可口革囊星虫人工繁殖试验的结果, 旨在为发展可口革囊人工苗种生产提供基础资料和理论依据。
1 材料与方法
1.1 材料
1.1.1 亲体
选于浙江省温岭市坞根镇沿海的人工养殖塘,2龄, 大小均匀、活力强、无外伤, 规格 190~200条/kg, 2005年、2006年共入选室内人工培养的亲体55 kg。
1.1.2 亲体培养池
室内长方形水泥池1个(长、宽、高分别为5 m, 6 m, 1.2 m), 池底铺设海泥, 厚度15 cm。为有利于排干池水, 在培养池底按对角线开沟2条, 并与排水孔相通。
1.1.3 催产和幼体培养缸
5只圆柱形FRP水缸(半径和高分别为0.85 m、0.85 m)。
1.1.4 幼虫饵料
球等鞭金藻(Isochrysis galbans)、亚心形扁藻(Platymonas sp.)、酵母、蛋黄。
1.1.5 试验用水
亲体培养用水为凡纳滨对虾(Litopenaeus vannamei)的养殖排放废水, 催产、孵化和幼虫培养用水均取自温州市瓯江口南部海区, 沉淀时间不少于 24 h, 沙滤后使用, 盐度为22.5~26.3。
1.2 方法
1.2.1 亲体培养
亲体按 0.5~1.0 kg/m2的密度放养, 每天蓄水和干露轮换管理, 一般白天蓄水50 cm, 晚上排水干露,培养期间不投饵。由于星虫类生殖细胞在早期即脱离生殖腺游离于体腔液中完成发育过程, 因此雌、雄生殖细胞的观察采用注射器抽取体腔液, 然后涂片,在光学显微镜下用显微测微尺测量细胞大小并计数,统计不同大小生殖细胞的相对含量, 确定生殖细胞的发育情况。
1.2.2 人工催产与受精
经人工培养成熟后的亲体, 用沙滤海水洗净外表附着物, 沥水后置于阴凉通风处自然风干10~20 h,或置于恒温箱中降温(低于自然水温 8~10℃)处理24~36 h, 然后放养于盛有海水的产卵缸中充气待产,精子和卵子在自然排放并受精。2005年, 有部分卵子和精子来自于解剖人工催产后的亲体, 获取的卵子和精子在500 mL烧杯中人工授精。
1.2.3 人工孵化
均在圆柱形 FRP水缸中进行, 自然排放的卵子和精子在产卵缸中受精后直接孵化, 人工解剖获取的卵子和精子在500 mL烧杯中人工授精后倒入缸中孵化。孵化条件: 盐度为 23.8~25.5 , pH 为 8.1~8.2, 水温为28~30℃, 孵化期间连续充气。
1.2.4 初期海球幼虫培养
1.2.4.1 环境条件
水温为22.0~34.0℃, 盐度为22.5~26.3, pH 值为8.2~8.4, 光照强度为 2 000~12 000 lx。
1.2.4.2 换水
从胚胎发育成初期海球幼虫次日起, 每天加水或换水2次, 上、下午各1次, 日加、换水总量从初期的加水30%逐渐增加至后期的换水80%(表1)。
1.2.4.3 投饵
从受精卵变态为初期海球幼虫的当天起就开始投喂饵料。前期基本上隔天轮换投喂球等鞭金藻或亚心形扁藻, 中、后期除投喂藻类外, 还适量添加蛋黄和酵母粉。所有饵料每天投喂2次, 均在加水后进行(表 1)。

表1 换水和投饵Tab. 1 Water-exchange and feeding schedule
1.2.5 后期海球幼虫的附着和稚虫培养
后期海球幼虫的附着也在圆柱形FRP水缸中进行, 投饵和加换水管理同初期海球幼虫。幼虫附着后5 d移到室外模拟海区潮间带生态的3个面积均为6 m2的土塘里进行稚虫培养, 白天蓄水 30 cm, 晚上干露, 饵料以土壤中的有机碎屑和自然生长的硅藻为主。
2 结果
2.1 亲体培养
2005年6月和2006年7月, 对入选的55 kg亲体经近2个月的培养, 体腔生殖细胞发育成熟, 存活亲体45.5 kg(表2), 亲体培养成活率达82.7%。首次产卵后的亲体经短时间的培养后, 还会再次成熟、排卵。
2.2 人工催产和受精
成熟的亲体经过阴干和降温处理后, 暂养于盛有海水的产卵缸中连续充气, 一般2天内排放精、卵,排放率一般为40%~60%; 平均受精率为70.7%(表2)。
2.3 胚胎发育
胚胎发育经历第1极体、第2极体、2细胞、多细胞、原肠胚、担轮幼虫、初期海球幼虫等阶段(图1)。在海水盐度23.8 、pH 8.1、温度30℃的条件下,从受精卵发育到上述各期的时间分别为0 h 17 min、0 h 33 min、1 h 28 min、1 h 40 min、3 h 7 min、3 h 39 min、6 h 18 min、41 h 8 min和47 h 8 min。2005年、2006年共获得受精卵 3 527万粒, 获初期海球幼虫2 374万条, 平均孵化率67.3%(表2)。
2.4 海球幼虫及其生长特征刚孵化的初期海球幼虫体积约为 120 μm×260
μm~125 μm×280 μm, 虫体分头部和躯干部, 自然伸直时体长可达350 μm(图1)。头部有口前、口后纤毛环和口器等; 躯干部呈圆筒形, 身体透明, 体壁较薄,
末端弯且尖, 消化道大, 几乎占据体腔空间的一半以上。静止或受到外界刺激时, 口前、口后纤毛环及口器等整个头部全部收缩于躯干部的体腔内, 形似樽状。
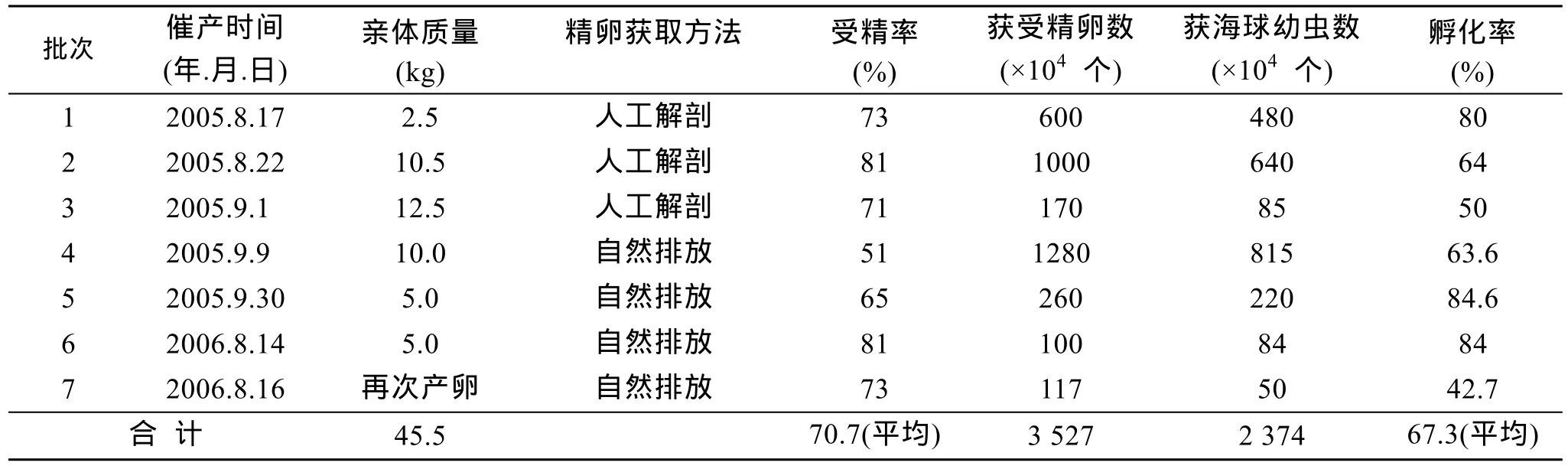
表2 人工催产和受精卵孵化结果Tab. 2 Artificial inducing and zygote hatching of Phascolosoma esculenta

图1 可口革囊星虫的胚胎和幼虫的发生Fig. 1 Embryo and larval developments of Phasocolosoma esculenta
海球幼虫的体长在孵化后1周内生长速度较快,日均增长高达 46 μm(图 2), 第 7天达 500 μm, 然后体长生长速度开始减慢(图 3), 但身体开始变粗, 体腔壁加厚, 体表突起角质化, 整个虫体颜色变深, 内脏器官不易看清(图1)。在后期海球幼虫的发育过程中, 位于口器下方呈马蹄形的肾管也逐渐形成, 且明显可见。原来几乎占大半个体腔的消化道也变细、变长, 并开始盘曲。口后纤毛摆动频率降低, 并逐渐脱落准备营埋栖生活。本试验结果: 从海球幼虫初期到附着的成活率为9.5%~30.5%。

图2 海球幼虫的体长日增长Fig. 2 Daily increase of body length of pelagosphere
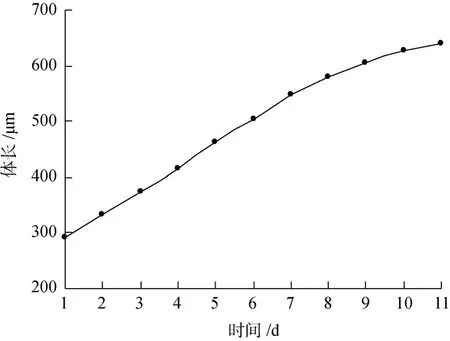
图3 海球幼虫的体长生长曲线Fig. 3 Curve of body length of pelagosphere
2.5 海球幼虫的附着和稚虫培养
海球幼虫经过 1周多时间的生长, 口后纤毛环上的纤毛开始脱落, 游泳能力降低, 逐渐下沉匍匐,随着吻的变长, 逐渐发育为稚虫, 营埋栖生活。
2006年6月21日、25日、26日分别从海球幼虫培养缸里移出匍匐幼虫30万条(体长0.8~1.0 mm)、4万条(体长 0.7~0.9 mm)和 12万条(体长 0.7~0.9 mm)放养到模拟海区潮间带生态的 3个面积均为 6 m2的土塘里继续培养, 但幼虫在土塘里生长十分缓慢,且在2周内陆续死亡, 稚虫培养未取得进展。
3 讨论
3.1 亲体的来源及其催产效果
亲体的来源与催产成功与否是可口革囊星虫人工繁殖的第一关键, 生长在自然滩涂上的可口革囊星虫, 体腔液中的生殖细胞发育不大整齐, 很难取得精卵排放率较高的亲体; 取自人工养殖塘的亲体,虽然体腔液中的生殖细胞发育较整齐, 但对人工催产刺激很不敏感, 作者曾对同一养殖塘中的可口革囊星虫作了 1个多月的跟踪观察, 每隔一段时间取回少量亲体观察和催产, 结果发现首次采捕到和最后一次采捕到的亲体, 其排放率没有明显提高。而本试验人工培养成熟的亲体, 催产后其精卵排放率明显高于来自人工养殖塘和自然滩涂的亲体。究其原因, 可能是由于生长在人工养殖塘和自然滩涂的亲体, 每天受高强度的干露、流水等环境因素刺激, 除了成熟亲体“流水式”排放精卵, 难以保留充分成熟的精卵外, 亲体自身还形成了对高强度刺激的耐受性, 一般的诱导刺激强度难以达到产生排放精卵的效果。
3.2 海球幼虫的饵料营养与附着变态
研究发现用等鞭金藻或亚心形扁藻或二者混合投喂可口革囊星虫的海球幼虫, 前期生长较快, 体长日增长高达46 μm, 但7 d 后幼虫体长生长速度开始减慢。在投喂等鞭金藻和亚心形扁藻的同时, 适当添加酵母和蛋黄, 对提高海球幼虫的生长速度和存活率起到一定的作用, 这可能与营养成分比较全面有关。但添加酵母和蛋黄对后期海球幼虫的变态及其成活率作用并不明显。兰国宝等[21]在做方格星虫(Sipunculus nudus)幼虫培养试验时, 在底质、饵料及成体介入等方面均做了大量的实验, 但均未发现能提高幼体变态成活率的效果。据 Rice[22]报道, 戈芬星虫属(Golfingia)中的Golfingia misakiana 的幼体变态由同种成体释放的一种水溶性小分子物质所诱导,并且这种诱导作用只在幼体潜入未经过处理的天然底质时才发生效应, 当实验性地减少底质中的有机物质时, 变态诱导物对幼体附着变态的诱导作用亦随之降低。可见星虫幼体的变态所必需的底质成分、生态条件、食物营养和诱导因子等一系列关键性生态因子与生理机制尚未确切了解和掌握, 要想进一步提高人工繁殖技术, 解决上述问题已成关键和当务之急。
[1] 周红, 李凤鲁, 王玮. 中国动物志 [M]. 北京: 科学出版社, 2007. 53-77.
[2] 李凤鲁. 中国沿海革囊星虫属(星虫动物门)的研究[J].青岛海洋大学学报, 1988, 18(3): 78-90.
[3] 李凤鲁, 周红, 王玮. 中国沿海星虫动物门名录[J].青岛海洋大学学报, 1992, 22(2): 72-88.
[4] 黄晓春, 苏秀榕, 苏月萍. 沙蚕和星虫的营养成分研究[J]. 水产科学, 2005, 24(6): 10-11.
[5] 胡笑丛. 星虫微量元素含量的测定[J]. 水产科学,2005, 24(6): 12-14.
[6] 周化斌, 张永普, 吴洪喜, 等. 可口革囊星虫的营养成分分析与评价[J]. 海洋湖沼通报, 2006, 2:62-68.
[7] 常敏毅. 可与冬虫夏草媲美的还星虫[J]. 海洋世界,2002, 1: 46-47.
[8] 黄哲元. 星虫 Phascolosoma制成品—土蒜冻的药学研究[J]. 中国海洋药物, 1990, 3: 52-54.
[9] 沈先荣, 蒋定文, 贾福星, 等. 海洋星虫提取物的抗疲劳作用研究[J]. 中华航海医学与高气压医学杂志,2003, 10(2): 112-114.
[10] 沈先荣, 蒋定文, 贾福星, 等. 海洋星虫延缓衰老作用研究[J]. 中国海洋药物, 2004, 1: 30-32.
[11] 蒋定文, 沈先荣, 贾福星, 等. 海洋星虫提取物的营养分析及免疫调节做用的初步观察[J]. 中国生化药物杂志, 2004, 25(2): 96-97.
[12] 张柳, 钱捷. 星虫动物中化学和生物活性成分研究综述[J]. 浙江化工, 2006, 1: 8-13.
[13] 丁理发, 竺俊全, 叶荣华, 等. 可口革囊星虫人工养殖试验[J]. 水产养殖, 2004, 25(5): 24.
[14] 丁理发, 竺俊全, 叶荣华, 等. 可口革囊星虫人工养殖获高产[J]. 科学养鱼, 2004, 5:17-18.
[15] 郑燕玲, 冯丹青, 郭丰, 等. 星虫动物繁殖生物学研究进展[J]. 海洋科学, 2006, 30(1): 84-87.
[16] 郭学武, 李复雪. 光裸星虫生殖周期的研究[J]. 热带海洋, 1993, 12(2): 69-75.
[17] 吴洪喜, 应雪萍, 陈琛, 等. 可口革囊星虫胚胎与幼体的发育[J]. 动物学报, 2006, 52(4): 765-773.
[18] 吴斌. 光裸方格星虫生殖细胞及胚胎发育[J]. 广西科学, 1999, 6(3): 222-226.
[19] 兰国宝, 阎冰. 方格星虫繁殖生物学研究[J]. 水产学报, 2002, 26(6): 503-509.
[20] 李进喜, 冯丹青, 周时强, 等. 光裸方格星虫(Sipunculus nudus)人工繁殖及生物学的初步研究[J].杭州师范学院学报, 2004, 3(2): 136-139.
[21] 兰国宝, 阎冰, 廖思明.方格星虫胚胎与幼体发育的研究[J]. 热带海洋学报, 2003, 22(6): 70-75.
[22] Rice M E. Factors influencing larval metamorphosis in Golfingia misakiana (Sipuneula)[J]. Bullentin of Marine Science, 1986, 39(2): 362-375.
(本文编辑: 谭雪静)
Artificial breeding of Phasocolosoma esculenta
WU Hong-xi1,2, CHEN Chen1, ZENG Guo-quan1, ZHOU Zhi-ming1, CAI Jing-bo1,2,PENG Xin1,2, HUANG Zhen-hua1,2
(1. Zhejiang Mariculture Research Institute, Wenzhou 325005, China; 2. Zhejiang Key Lab of Exploitation and Preservation of Coastal Bio-Resource, Wenzhou 325005, China)
Jul., 23, 2008
Phasocolosoma esculenta; broodstock rearing; artificial induce; artificial breeding; pelagosphere
Artificial breeding of Phasocolosoma esculenta was investigated through culturing bloodstocks. It was found that P. esculenta could be reared to mature in the lab. Either drying in the shade or dropping the temperature were very efficient to induce mature P. esculenta to spawn. Isochrysis galbans and Platymonas sp. could be used as the main feeds for pelagospheres. P. esculenta grew faster at the pelagospheres stage in comparison with other stages. Settlement for burrowing life started when their body length reached about 500 μm.
S 961.2
A
1000-3096(2010)03-0021-05
2008-07-23;
2008-09-24
温州市科技局重点科技计划资助项目(S2003A003); 浙江省海洋开发管理项目(2005-10)
吴洪喜(1963-), 男, 浙江乐清人, 研究员, 硕士, 主要从事海水增养殖技术和生物资源与环境学研究,电话: 0577-88228385,E-mail: whxchina@126.com
